重组人生长激素对POR/DOR 患者IVF-ET 周期取消率及妊娠结局的影响
2024-03-25倪莉莉谭丽
倪莉莉 谭丽
(郑州大学第二附属医院 河南郑州 450000)
自1978 年两位英国专家培育出第一个试管婴儿至今,体外受精-胚胎移植(IVF-ET)作为辅助生殖技术已日臻成熟,但因遗传、药物、环境等因素的影响,出现卵巢低反应(POR)患者逐渐增多[1]。POR是指在IVF-ET 过程中卵巢对促性腺激素(Gn)反应不良,导致生理性或病理性的卵巢储备功能减退(DOR),出现高周期取消率、低临床妊娠率和获卵数少等问题,极大影响治疗结局[2]。重组人生长激素(r-hGH)主要促进儿童身高增长及对各组织器官生长发育的改善,已有研究表示在生殖领域、抗衰老领域等也能发挥重要作用[3~4]。本研究选取行IVF-ET治疗的80 例POR/DOR 患者为研究对象,探讨r-hGH 对POR/DOR 患者IVF-ET 周期取消率及妊娠结局的影响。现报道如下:
1 资料与方法
1.1 一般资料 选取2022 年1 月至2023 年1 月医院行IVF-ET 治疗的80 例POR/DOR 患者为研究对象,采用随机分层化法随机分为常规组和激素组,每组40 例。两组年龄、不孕年限、体质量指数(BMI)和基础指标等资料比较,差异无统计学意义(P>0.05)。见表1。本研究经郑州大学第二附属医院医学伦理委员会审查同意(郑二附医伦理20220012 号)。
表1 两组患者一般资料比较(±s)
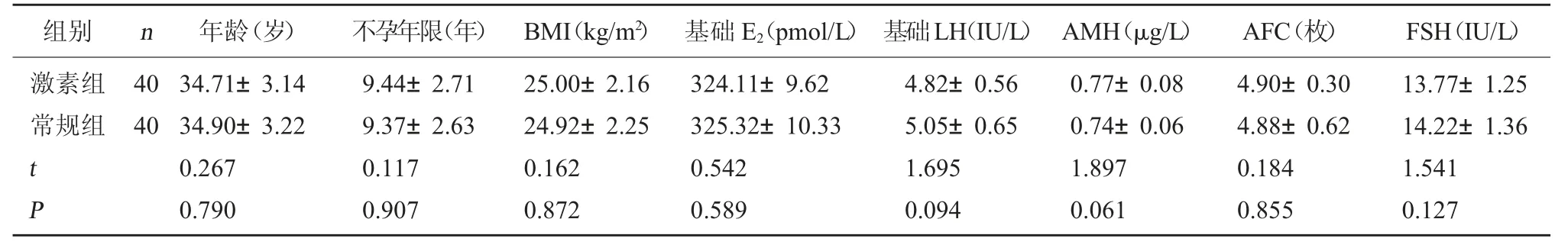
表1 两组患者一般资料比较(±s)
组别n年龄(岁)不孕年限(年) BMI(kg/m2) 基础E2(pmol/L) 基础LH(IU/L) AMH(μg/L)AFC(枚)FSH(IU/L)激素组常规组40 40 t P 34.71±3.14 34.90±3.22 0.267 0.790 9.44±2.71 9.37±2.63 0.117 0.907 25.00±2.16 24.92±2.25 0.162 0.872 324.11±9.62 325.32±10.33 0.542 0.589 4.82±0.56 5.05±0.65 1.695 0.094 0.77±0.08 0.74±0.06 1.897 0.061 4.90±0.30 4.88±0.62 0.184 0.855 13.77±1.25 14.22±1.36 1.541 0.127
1.2 入组标准 纳入标准:存在卵巢反应不良的危险因素;伴有抗苗勒管激素(AMH)水平降低且<1.1 μg/L,窦卵泡数(AFC)减少且<7 枚,满足专家共识中对POR/DOR 的诊断标准[5~6];年龄25~45 岁,不孕年限1~18 年,BMI 18.0~32.0 kg/m2;基础雌二醇(E2)≥293 pmol/L,基础黄体生成素(LH)≥3 IU/L,10 IU/L≤基础血清激素(FSH)<20 IU/L。排除标准:合并排卵障碍、子宫内膜异位症、子宫畸形或妇科肿瘤等;伴有未获得控制的内分泌疾病、自身免疫疾病、糖尿病、高血压等;存在子宫或卵巢手术史、复发性流产史;无法完成研究或拒绝签署知情同意书;夫妻任一方染色体异常或配偶因素导致不孕;对本研究所用药物成分过敏或近期服用类固醇类药物。
1.2 治疗方法 常规组给予常规促排卵治疗:在月经第2 天检测FSH、LH、E2、AMH 水平,AFC 数量采用阴道超声探测,卵巢基础状态评估完毕后决定重组人促卵泡激素注射液(Gn,国药准字SJ20210005)用量并给予注射;根据卵泡发育情况和激素水平,在Gn 启动第5 天添加注射用醋酸西曲瑞克(国药准字H20183468)0.25 mg/d 皮下注射;月经第7 天开始每日复查B 超监测卵泡生长情况,有2 个主导卵泡直径≥18 mm 或3 个卵泡直径≥17 mm 时,当晚结合血清E2激素水平给予重组人绒毛促性激素注射液(国药准字SJ20130091)250 μg 肌内注射。激素组在常规组基础上加用重组人生长激素注射液(国药准字S20050025) 治疗:在促排卵启动前4 周给予r-hGH 注射液治疗至HCG 日,方式为6 IU 隔日皮下注射。两组均于促排卵治疗完成36 h 后行取卵术穿刺取卵,经显微注射授精18 h 后观察受精情况,在第2~3 天分别观察胚胎发育情况。选择移植的优质胚胎≥1 枚,胚胎移植(ET)后给予黄体支持。
1.3 观察指标 (1)HCG 日促排卵相关指标:抽取患者5 ml 静脉血经10 min 离心(3 000 r/min)处理后取上清,采用生化分析仪检测E2、LH 和FSH 水平;采用B 超诊断仪检测子宫内膜厚度。(2)Gn 使用情况:记录两组启动量、使用时间和总剂量。(3)胚胎情况:记录两组获卵总数、成熟卵(MⅡ)数、正常受精(2PN)数、可移植胚胎数和优质胚胎数。优质胚胎按D3 胚胎等级划分标准选择细胞数7~8 及Ⅰ级(细胞碎片≤5%,卵裂球大小均匀,胞质透亮无颗粒)~Ⅱ级(6%≤细胞碎片≤20%,卵裂球大小较不均等、胞质间有颗粒);选择细胞数4 及Ⅲ级(卵裂球大小不一,胞质明显颗粒,20%<细胞碎片≤50%)以上作为可移植胚胎[7]。(4)IVF-ET 周期取消率和妊娠结局:取卵至胚胎移植期间出现卵泡早排、未获卵、受精异常及无可用胚胎等情况则周期取消,IVF-ET 周期取消率=周期取消数/总例数×100%。生化妊娠诊断为ET 后14 d 尿HCG 实验呈阳性;临床妊娠诊断为在生化妊娠3 周后对宫腔行阴道B超检查见妊娠囊、胎芽及胎心搏动;早期流产为发生难免流产、完全流产或在妊娠12 周内胚胎停止发育等。统计生化妊娠率、临床妊娠率和早期流产率。
1.4 统计学方法 采用SPSS21.0 软件统计分析数据。计量资料以(±s)表示,采用t检验;计数资料以%表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组Gn 使用情况比较 治疗期间激素组Gn的启动量、总使用时间和总剂量均较常规组更少,差异有统计学意义(P<0.05)。见表2。
表2 两组Gn 使用情况比较(±s)
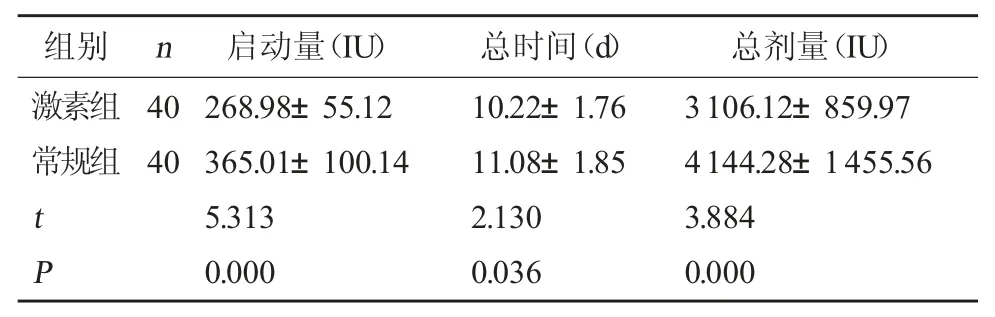
表2 两组Gn 使用情况比较(±s)
组别 n启动量(IU)总时间(d)总剂量(IU)激素组常规组40 40 t P 268.98±55.12 365.01±100.14 5.313 0.000 10.22±1.76 11.08±1.85 2.130 0.036 3106.12±859.97 4144.28±1455.56 3.884 0.000
2.2 两组HCG 日促排卵相关指标比较 激素组HCG 日E2水平及子宫内膜厚度数值均较常规组更高(P<0.05),LH、FSH 水平均较常规组更低(P<0.05)。见表3。
表3 两组HCG 日促排卵相关指标比较(±s)
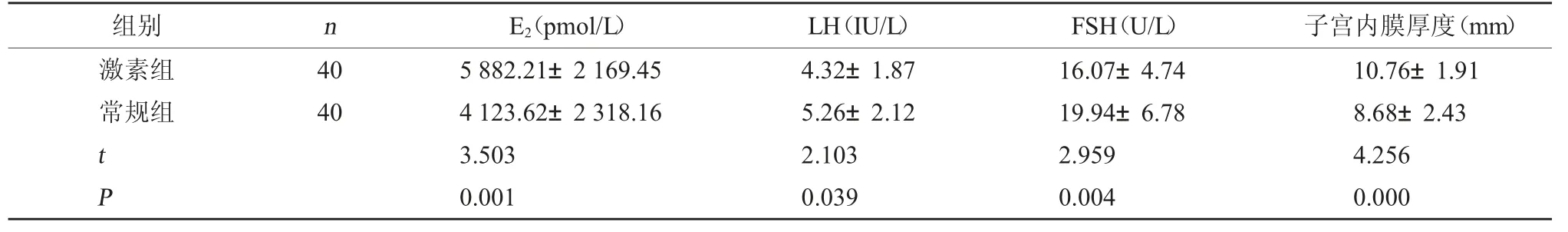
表3 两组HCG 日促排卵相关指标比较(±s)
组别nE2(pmol/L)LH(IU/L)FSH(U/L)子宫内膜厚度(mm)激素组常规组40 40 t P 5 882.21±2 169.45 4 123.62±2 318.16 3.503 0.001 4.32±1.87 5.26±2.12 2.103 0.039 16.07±4.74 19.94±6.78 2.959 0.004 10.76±1.91 8.68±2.43 4.256 0.000
2.3 两组胚胎情况比较 在胚胎发育第3 天,激素组获卵总数、MⅡ数、2PN 数、可移植胚胎数和优质胚胎数均较常规组更多,差异有统计学意义(P<0.05)。见表4。
表4 两组胚胎情况比较(个,±s)
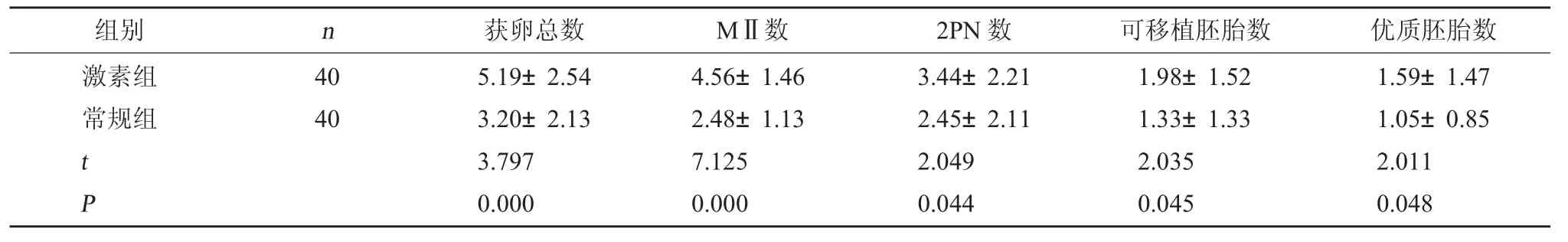
表4 两组胚胎情况比较(个,±s)
组别n获卵总数MⅡ数2PN 数可移植胚胎数优质胚胎数激素组常规组40 40 t P 5.19±2.54 3.20±2.13 3.797 0.000 4.56±1.46 2.48±1.13 7.125 0.000 3.44±2.21 2.45±2.11 2.049 0.044 1.98±1.52 1.33±1.33 2.035 0.045 1.59±1.47 1.05±0.85 2.011 0.048
2.4 两组妊娠结局和IVF-ET 周期取消率比较 激素组周期取消率明显低于常规组,差异有统计学意义(P<0.05);激素组的生化妊娠率和临床妊娠率均明显高于常规组,差异有统计学意义(P<0.05);两组早期流产率比较,差异无统计学意义(P>0.05)。见表5。
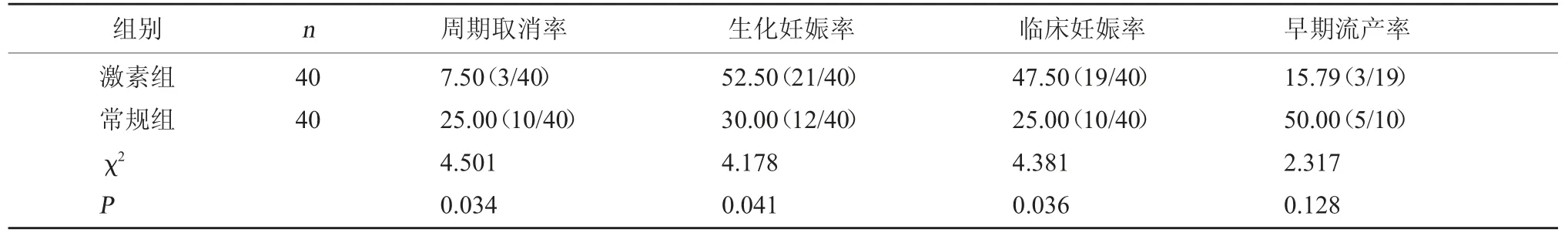
表5 两组IVF-ET 周期取消率和妊娠结局比较[%(例/ 例)]
3 讨论
有研究发现,引起IVF-ET 周期取消的原因主要有POR、重度卵巢过度刺激综合征(OHSS)、卵裂差及感染等,并且因IVF-ET 费用昂贵,对降低其周期取消率、改善POR/DOR 患者妊娠结局的方案临床还在探索[8]。临床上关于POR/DOR 的定义主要为卵巢在Gn 充分刺激后获卵数<4 个,或生长卵泡在促排卵过程中数量≤3 个,基础E2≤1 830 pmol/L,且目前尚无方案能够完全预测POR/DOR,只能在卵巢刺激周期暴露时发现[9]。r-hGH 与分泌自人脑垂体的生长激素(GH)在蛋白质结构及氨基酸含量、序列上完全一致,是通过基因重组大肠杆菌分泌型表达技术生产的,且有研究表明在增强卵巢反应功能、提高胚胎着床率和临床妊娠率等方面也发挥作用[10]。
本研究结果显示,激素组HCG 日E2水平显著高于常规组,LH、FSH 水平均显著低于常规组,子宫内膜也较常规组更厚,并且治疗期间激素组Gn 的启动量、总使用时间和总剂量均显著少于常规组。显然r-hGH 可提高E2水平,抑制LH 和FSH 水平,增加子宫内膜厚度,减少Gn 使用剂量和时间。这是因为常规超促排卵方案虽然能通过Gn 降调节抑制FSH、LH 合成与释放,但POR 患者对Gn 刺激反应不良也将导致Gn 用量增加、促排卵时间延长。而GH 受体在人卵巢颗粒细胞、卵母细胞及卵泡发育成熟期间的子宫内膜中表达,当促排卵前4 周采用r-hGH 进行预处理,r-hGH 将通过对线粒体功能障碍进行抑制,使卵母细胞质量和卵巢对Gn 刺激的反应能力得到提高,并抑制LH 和FSH 水平;同时与GH 受体结合或增加胰岛素样生长因子-1(IGF-1)水平促协调内膜血管和内膜细胞发育成熟,使POR/DOR 患者子宫内膜容受性和E2水平提高、内膜厚度增加,治疗结局得以改善[11~12]。
本研究结果显示,激素组获卵总数、MⅡ数、2PN 数、可移植胚胎数和优质胚胎数均显著多于常规组。提示加用r-hGH 可增加POR/DOR 患者的获卵总数、MⅡ数和胚胎数,提高授精成功率。而脑垂体前叶嗜酸粒细胞分泌的GH 作用于靶细胞受体可调节机体生长发育和新陈代谢,对不孕症及GH 分泌量低的POR/DOR 患者给予外源性r-hGH 补充能促进生殖细胞增殖,刺激卵泡生长成熟,使MⅡ数和获得胚胎数增加,而卵巢反应性增加及子宫内膜容受性提高也更利于患者胚胎着床[13~14]。POR/DOR患者常在IVF-ET 促排卵过程中因卵子早排、获卵率低、卵母细胞质量低及无可用胚胎导致妊娠结局不良[15]。本研究在POR/DOR 患者促排卵阶段应用r-hGH 并与常规排卵手段对照,显示激素组周期取消率显著低于常规组,生化妊娠率和临床妊娠率均显著高于常规组;两组早期流产率对比无显著差异。r-hGH 可通过激活相关蛋白激酶信号传导途径使氧化反应被抑制,从而减少卵巢颗粒细胞凋亡,并促使GH 受体表达将子宫内膜容受性上调,周期取消率降低,改善助孕结局[16]。
