万年县古稻原产区细菌多样性分析及功能预测*
2024-03-25刘亚军汪成钵储小东廖文成李荣富吴永明
刘亚军 ,汪成钵 ,章 涛 ,叶 翠 ,储小东 ,廖文成 ,李荣富,吴永明**
(1.江西省科学院微生物研究所 南昌 330096;2.江西省煤田地质勘察研究院 南昌 330001)
水稻(Oryza sativa)是我国主要的粮食作物,为提高作物产量,农药和化肥被大量施用,严重威胁着农业的可持续化发展[1-2]。万年贡谷原名“坞源早”,是一种人工栽培的野生稻,起源于南北朝时期,以江西省万年县裴梅镇荷桥村最为正宗。受当地独特水土环境的影响,加之采用传统环境友好的耕作方式,保证了万年贡谷优良品质,富含蛋白质、维生素B和多种有益微量元素[3]。然而,目前关于万年贡谷原产区土壤环境特异性的研究较为缺乏。
万年县古稻原产区主要分布在裴梅镇一带,地处珠溪河上游、怀玉山北麓的丘陵峡谷地带,稻田土壤常年温度在15 ℃左右,富含N、P、K 及Cu 等元素,形成贡谷生长得天独厚的自然环境。此外,古稻生长周期180 d 左右,为保证作物产品质量,当地坚持施撒有机肥和人工去除杂草等低强度管理措施,从而有效地保护了当地的土壤环境。同样位于珠溪河流域的邻近区域稻田,多采用现代农田管理方式,大量使用化肥和农药。大量的研究发现,差异化的管理措施不仅会影响土壤的养分状况,还会影响土壤 的结构特征[4-5]。微生物作为农田生态系统的一部分,参与了几乎所有的土壤过程,其催化的养分循环直接关系到作物的产量和质量[6]。同时,微生物对土壤环境变化极度敏感,能够很好地指示土壤生态系统功能的改变[7]。因而,关于农田系统微生物的研究越来越受到重视。长期施肥不仅提高了耕地土壤微生物的丰度,还能够改变微生物的组成类群[8]。化肥和农药的过量施用则会显著改变N 循环相关功能菌群,包括硝化、反硝化和厌氧氨氧化古菌/细菌,从而对农田生态系统产生不利的影响[9]。考虑到微生物的重要性,通过调节和控制地下生物过程可作为提高水稻产量和减少肥料对环境不利影响的一种策略,从而有助于农田生态系统的可持续性发展。有研究发现,平衡施肥能够维持水稻土微生物群落多样性特征,可能有助于提高土壤肥力和水稻产量[10]。然而,土壤质量变化是一个缓慢的过程[11],同时微生物群落结构的稳定也需要一定的时间[12]。因此,研究长期、无间断健康管理下古稻种植区的土壤微生物群落及其功能特征,不仅可以明晰古稻原产区土壤微生态环境的特异性,为贡米的推广种植提供理论依据,同时对于规范水田管理措施也至关重要。
据此,本研究以古稻原产区(江西省万年县裴梅镇)及其周边区域常规稻田土壤为研究对象,分析水稻土壤物化性质、微生物群落结构及其功能潜力,探求古稻原产区土壤微生态环境特征,为农田环境监测、生态治理及创建生态友好型水稻种植模式提供理论参考。
1 材料与方法
1.1 研究区域概况
万年县地处江西省东北中部(图1),属亚热带季风湿润气候,年均气温17.5 ℃,年均无霜期为260 d,年均降水量为1908.4 mm。万年县是一个典型的特色农业县,素有“南方古稻米之乡”和“中国贡米之乡”等美誉。万年贡米原产区集中在裴梅镇,位于怀玉山北麓的丘陵峡谷地带,土壤属偏酸性黏土,独特的水土环境和优化的田间管理方式是保持万年贡米高质量的保障。邻近区域包括上坊乡和珠田乡,均位于乐安河支流—珠溪河汇集区内。
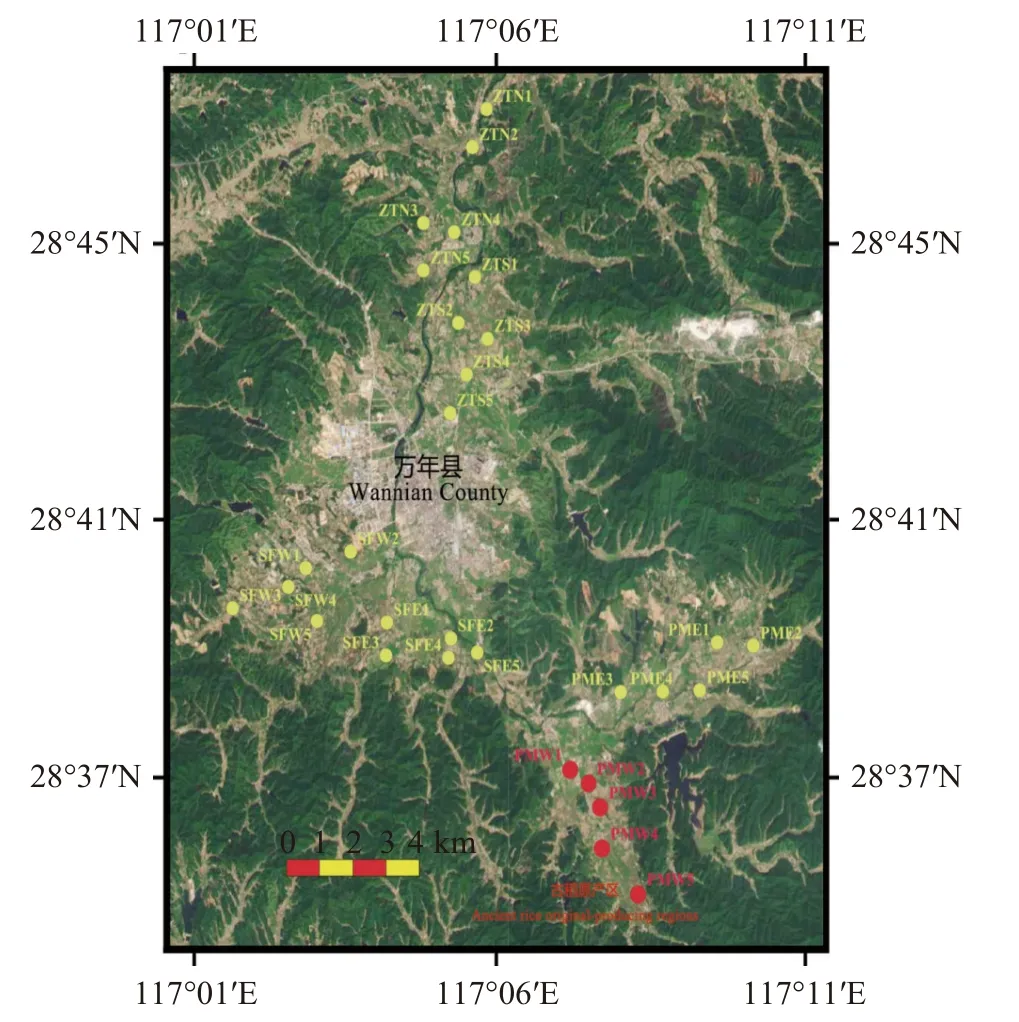
图1 研究区域及样点分布图Fig.1 Locations of study area and sampling sites
1.2 样品采集及处理
通过文献资料和实地勘察,依据当地地形地貌、水系特征,共采集6 个研究区域的稻田土壤,包括:珠田乡北(ZTN)、珠田乡南(ZTS)、上坊乡东(SFE)、上坊乡西(SFW)、裴梅镇东(PME)和裴梅镇西(PMW)。珠田乡、上坊乡和朱田镇分别位于珠溪河下游、中上游和上游。PMW 为古稻种植区,采用传统耕作方式,包括施撒有机肥和人工杂草清理;其他研究区域多采用现代耕作方式,化肥和农药使用量较大。为了更好地表征农田土壤状况,降低田间水肥管理短暂的影响和干扰,于水稻移栽前(2023 年2 月),在每个区域设置5 个采样点(间距>2 km),每个采样点采用梅花法(间距>20 m)进行耕层土壤(0~20 cm)样品采集,共获得30 个混合样品。土样低温运至实验室,剔除残留的枯枝落叶和石砾后分装两份,一份自然风干后用于土壤理化性质的测定,另一份保存在-80 ℃,用于DNA 提取。
1.3 土壤基础物化参数测定
稻田土壤基础理化性质的测定均采用常规方法[13]。具体而言,含水量(SM)采用烘干差重法,pH(水土比v∶w=2.5∶1)采用电位法,阳离子交换量(CEC)采用乙酸铵交换-蒸馏滴定法,总有机质(OM)采用重铬酸钾外加热法,总氮(TN)和有效氮(AN)采用微量凯氏定氮法,总磷(TP)采用钒钼黄分光光度法,有效磷(AP)采用联合浸提-比色法,有效钾(AK)采用乙酸铵提取-火焰光度法,金属元素(Cd、Cr、Pb、Zn、Cu、Hg、Ni 和As)均采用电感耦合等离子体质谱法测定。
1.4 DNA 提取及高通量测序及分析
称取保存于-80 ℃冰箱的土壤样品0.25 g,使用MOBIO 的强力土壤DNA 提取试剂盒(PowerSoil®DNA Isolation Kit)提取土壤微生物总DNA。采用分光光度计(NanoDrop2000TM;ThermoScientific Inc,West Palm Beach,FL)和琼脂糖凝胶电泳技术检测DNA 的浓度、纯度和完整度。基于荧光定量PCR 技术测定16S rRNA 基因丰度(目的基因为16S ITS)。此外,将检测合格的DNA 样品于干冰上运送至上海美吉生物医药科技有限公司,由Illumina Miseq PE300 测序平台进行高通量测序。选择通用引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)/806R(5′ -GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA 的V3-V4 高变区。测序原始序列经质控、拼接、筛选、去除嵌合体等步骤获得的有效序列进行物种注释等后续信息学分析。而后使用FAPROTAX 程序预测了群落的功能潜力[14]。FAPROTAX 是一个人工构建的数据库,根据文献中的培养记录将原核生物物种(如属或种)映射到假定的功能。
1.5 数据处理
本文相关数据的整理及统计分析均通过R 语言(https://www.r-project.org/)完成。使用ggpubur 包(0.4)进行单因素方差分析以及Tukey 事后多重比较检验了组间土壤物化因子及细菌群落组成差异的显著性;使用vegan 包进行了mantel、PERMONOVA 检验。基于Bray-Curtis 距离的主坐标分析(PCoA),使用Vegan 包展示细菌群落结构的概况。通过Mantel 相关分析探究土壤环境因子和细菌群落的关系。
2 结果与分析
2.1 古稻原产区土壤物化性质分析
为更好地表征稻田土壤物化性质,测定分析了土壤粒度、养分以及重金属元素分布特征(表1)。结果发现,相较于其他研究区域,古稻原产区(PMW)稻田土壤富含更高含量的TN (2.41 g·kg-1)和更低含量的Zn (64.60 mg·kg-1)。此外,还发现PMW 的AN(289.57 mg·kg-1)和Cu (57.6 mg·kg-1)含量高于其他研究区域。对于威胁当地水稻安全种植的重要污染物Cd,含量最高的区域是普通稻产区[ZTN (0.27 mg·kg-1)和SFW (0.27 mg·kg-1)]。同时,土壤的其他参数(pH、CEC、OM、TP、AK、AP、Cr、Pb、Hg、Ni 和As)并未表现出明显的空间分布差异。
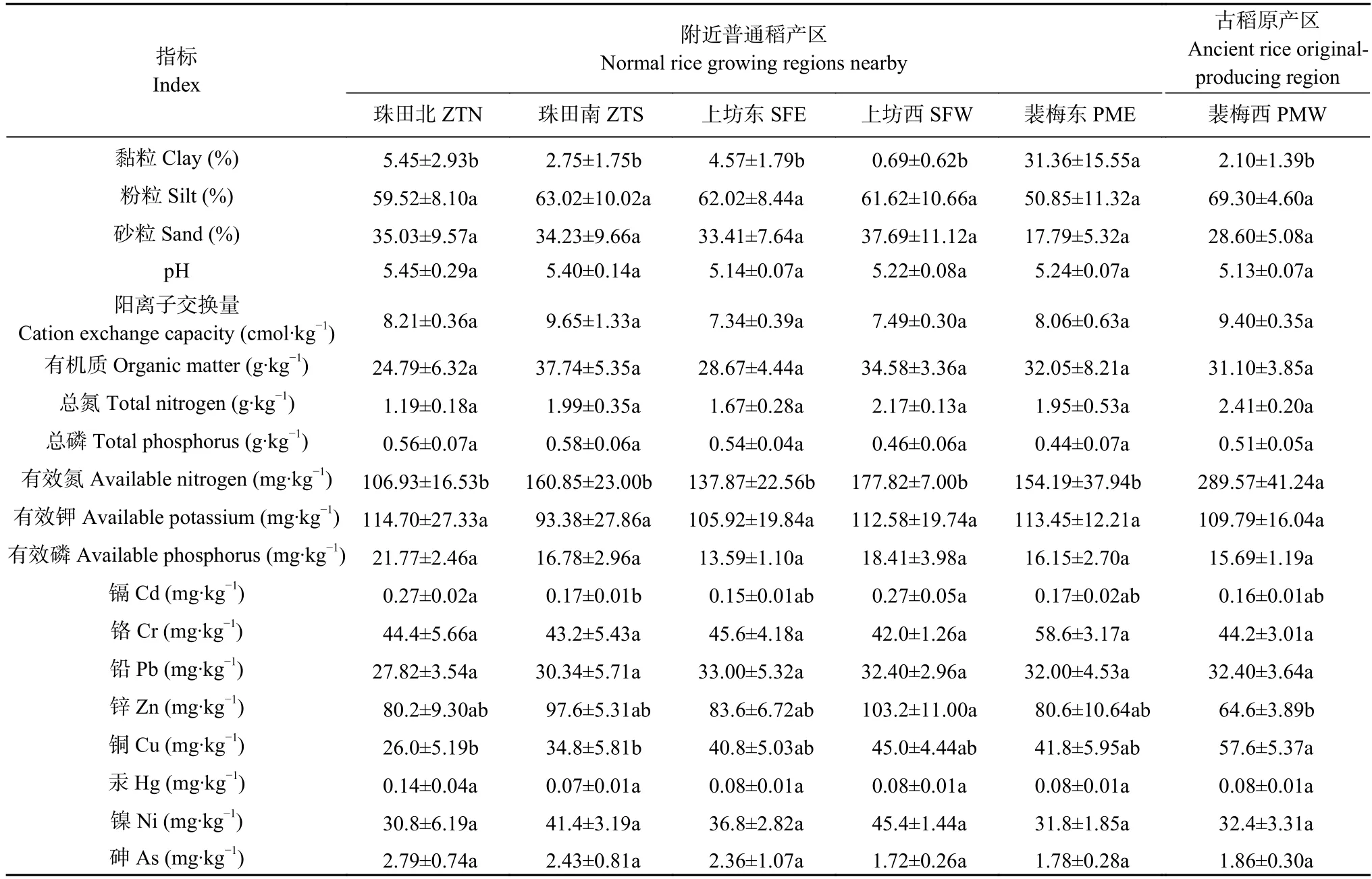
表1 不同研究区域土壤理化指标Table 1 Physicochemical parameters of soil samples from different regions
2.2 古稻原产区细菌群落结构特征
对研究区域30 个土壤DNA 样品进行扩增子测序分析,平均覆盖度高达95.25%,表明测序结果能够很好地表征细菌群落特征。经质量控制和聚类(97%相似性)分析,共划分出14 767 个操作类单元(OTU),注释获得51 个门(Phylum)、155 个纲(Class)、334 个目(Order)、506 个科(Family)和891 个属(Genus)。研究表明,细菌丰度(基于16S rDNA 基因拷贝数)及Alpha 多样性(包括ACE、Chao1、Shannon、Simpson 和PD_whole_tree)均未表现出明显的空间分布差异(表2)。
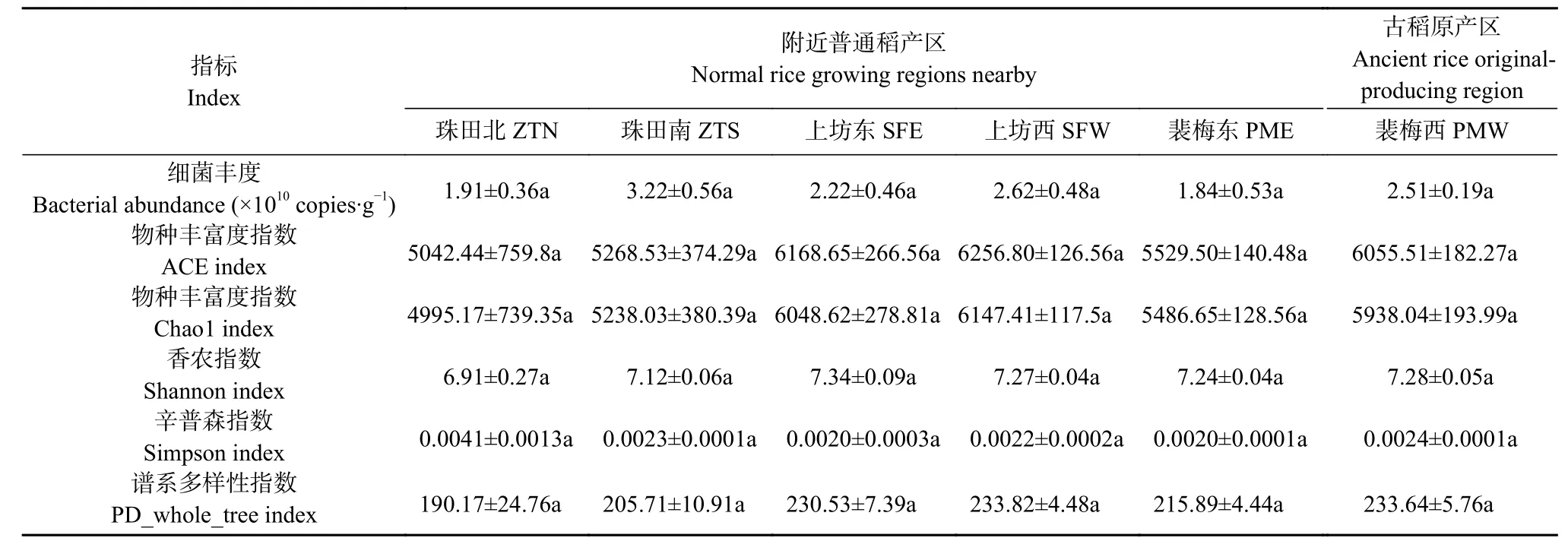
表2 不同研究区域细菌群落丰度及多样性Table 2 Bacterial community abundance and diversity of soil samples from different regions
基于OTU 水平对细菌群落进行主坐标分析(PCoA),发现古稻原产区(PMW)的5 个样点紧密地聚为一簇(图2a),与其邻近的是PME 和SFW 组,而ZTN、ZTS 和SFW 则较为分散,在第一轴上多分布于PMW 的左侧。组间差异分析(Adonis)发现(图2b),6 个区域内耕地土壤细菌群落组成存在显著差异(R2=0.243,P<0.001),同时PMW 细菌群落具有明显的特异性,不同于其他研究区域(P<0.05)。总体来看,PME (R2=0.173,P=0.006)和SFW (R2=0.159,P=0.007)与PMW 最为接近,其次是ZTS (R2=0.177,P=0.011),SFE (R2=0.228,P=0.017)和ZTN (R2=0.227,P=0.009)相差最大。组内差异分析(基于Bray-curtis 距离)发现(图2c),PMW 组内差异显著小于附近普通稻产区(P<0.05)。结合各研究区域的分布特征(图1),空间距离可能是影响细菌群落演替的重要因素。
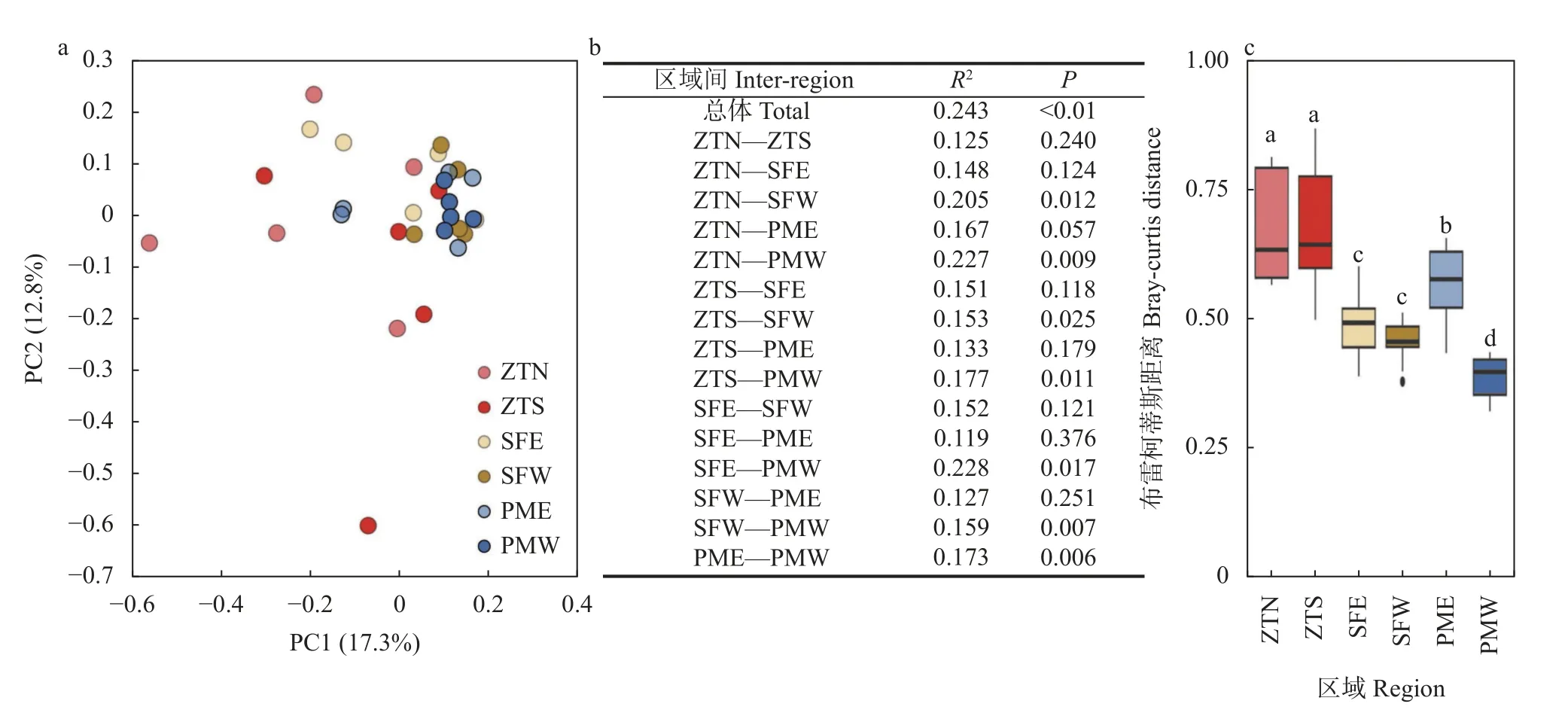
图2 不同研究区域水稻土细菌群落的基于OTU 水平的主坐标分析(a)、基于Adonis 的研究组间差异分析(b)和基于Bray-curtis 距离的组内差异分析(c)Fig.2 Ordination of paddy soil bacterial communities via principal coordinate analysis (PCoA) at the OTU level (a),analysis of inter-groups differences of paddy soil bacterial communities based on Adonis (b),and analysis of intra-groups differences of soil bacterial communities based on Bray-curtis distances (c) in different regions
研究区域内的优势细菌门(>1%)共有13 个(图3),包括变形菌门(Proteobacteria,22.17%)、绿弯菌门(Chloroflexi,19.31%)、酸杆菌 门(Acidobacteriota,16.95%)、放线菌门(Actinobacteriota,13.46%)、厚壁菌门(Firmicutes,4.60%)、粘菌门(Myxococcota,3.20%)、脱硫杆菌门(Desulfobacterota,2.95%)、硝化螺旋菌门(Nitrospirota,2.63%)、浮霉菌门(Planctomycetota,2.14%)、拟杆菌 门(Bacteroidota,2.13%)、芽单胞 菌门 (Gemmatimonadota,1.34%)、Methylomirabilota(1.14%)和蓝细菌门(Cyanobacteria,1.13%)。古稻原产区(PMW)富集了更多的厚壁菌门(5.80%)和拟杆菌门(2.98%);同时表现出更低相对丰度的酸杆菌门(13.83%)和硝化螺旋菌门(2.24%) (P<0.05)。此外,对于25 个优势细菌属(>1%),相较于其他研究区域,PMW 表现出更高相对丰度的黄色杆菌科未分类属(Xanthobacteraceae_unclassified,3.44%)、康奈斯氏杆菌属(Conexibacter,1.79%)和甲基孢囊菌属(Methylocystis,1.83%);以及更低丰度的酸杆菌目未分类属(Acidobacteriales_norank,3.09%)、Thermodesulfovibrionia_norank (1.37%)、Candidatus_Solibacter(0.08%)、Bryobacter(0.88%)和全噬菌纲未分类属(Holophagae_Subgroup_7_norank,0.88%),但差异性均不显著。
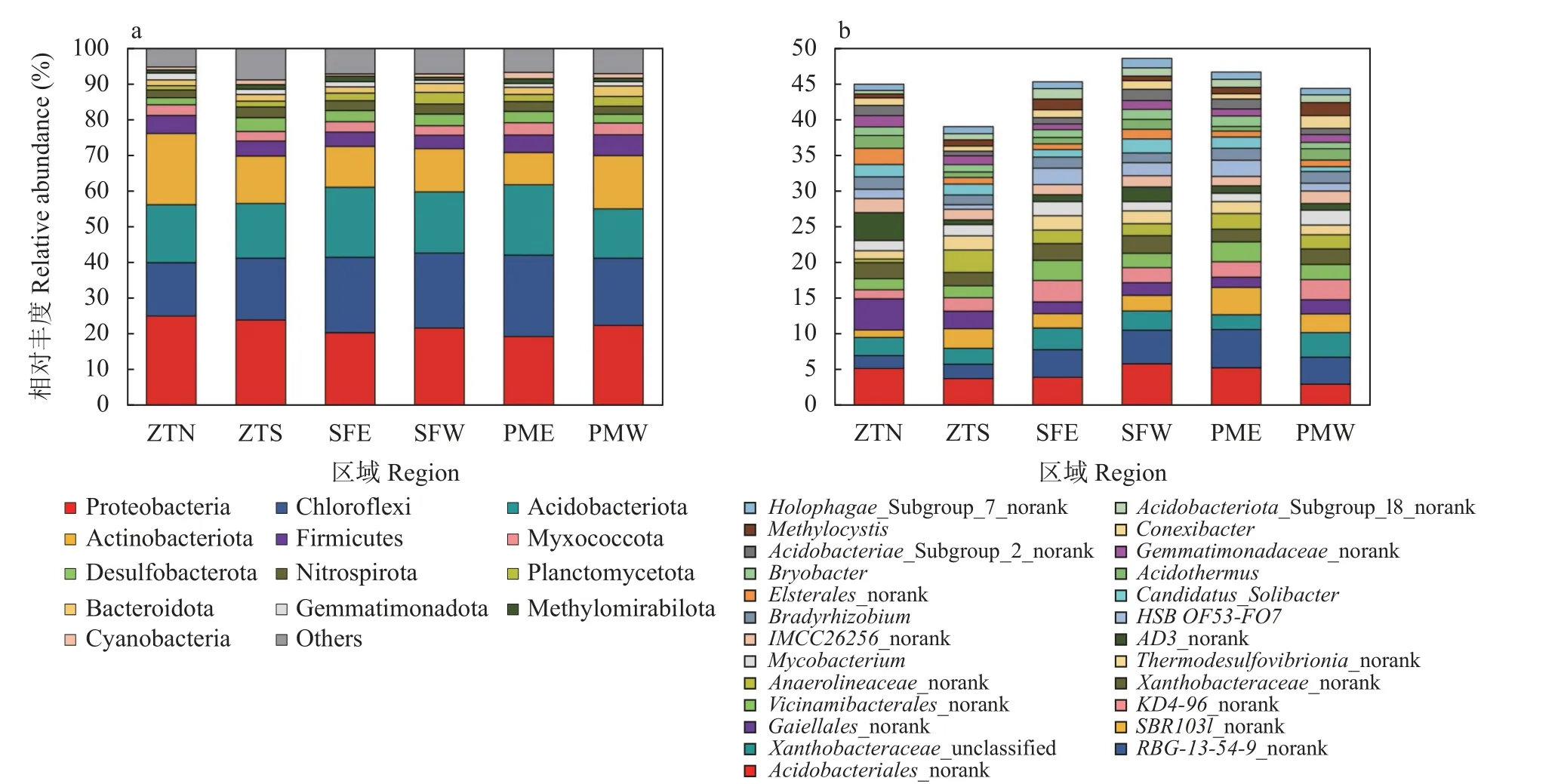
图3 不同研究区域水稻土壤优势(>1%)细菌门(a)和属(b)水平的相对丰度Fig.3 Relative abundances of soil bacterial communities of paddy in different regions at dominant (>1%) phylum (a) and genus (b)levels in different regions
2.3 古稻原产区细菌群落功能潜力分析
为进一步获取细菌群落的功能信息,通过FAPROTAX 对菌群进行功能预测(图4)。共获得61项功能分组,其中与化能异养、好氧化能异养和固氮作用相关基因信息占比最高,分别为26.23%、20.73%和7.58%。相较而言,古稻原产区(PMW)稻田土壤细菌类群表现出更强的碳(C)代谢潜力,包括甲醇氧化、发酵、纤维素分解(Cellulolysis)、甲烷营养、碳氢化合物降解和甲基营养代谢。同时,PMW 相较于其他研究区域还具有更低的N 和S 代谢潜力,包括反硝化作用、N2O 反硝化、亚硝酸盐脱氮、硝酸盐脱氮、亚硝酸盐呼吸、硝酸盐呼吸和氮呼吸,以及光合自养硫氧化和暗硫化物氧化作用。此外,PMW 稻田土壤细菌类群还表现出更低的延胡索酸呼吸和不产氧的光能自养能力。值得注意的是,关于人类疾病的微生物功能基因类群在PMW 也表现出极低的丰度,包括人类肠道炎症、人类腹泻、人类病原体肺炎和人类病原体。
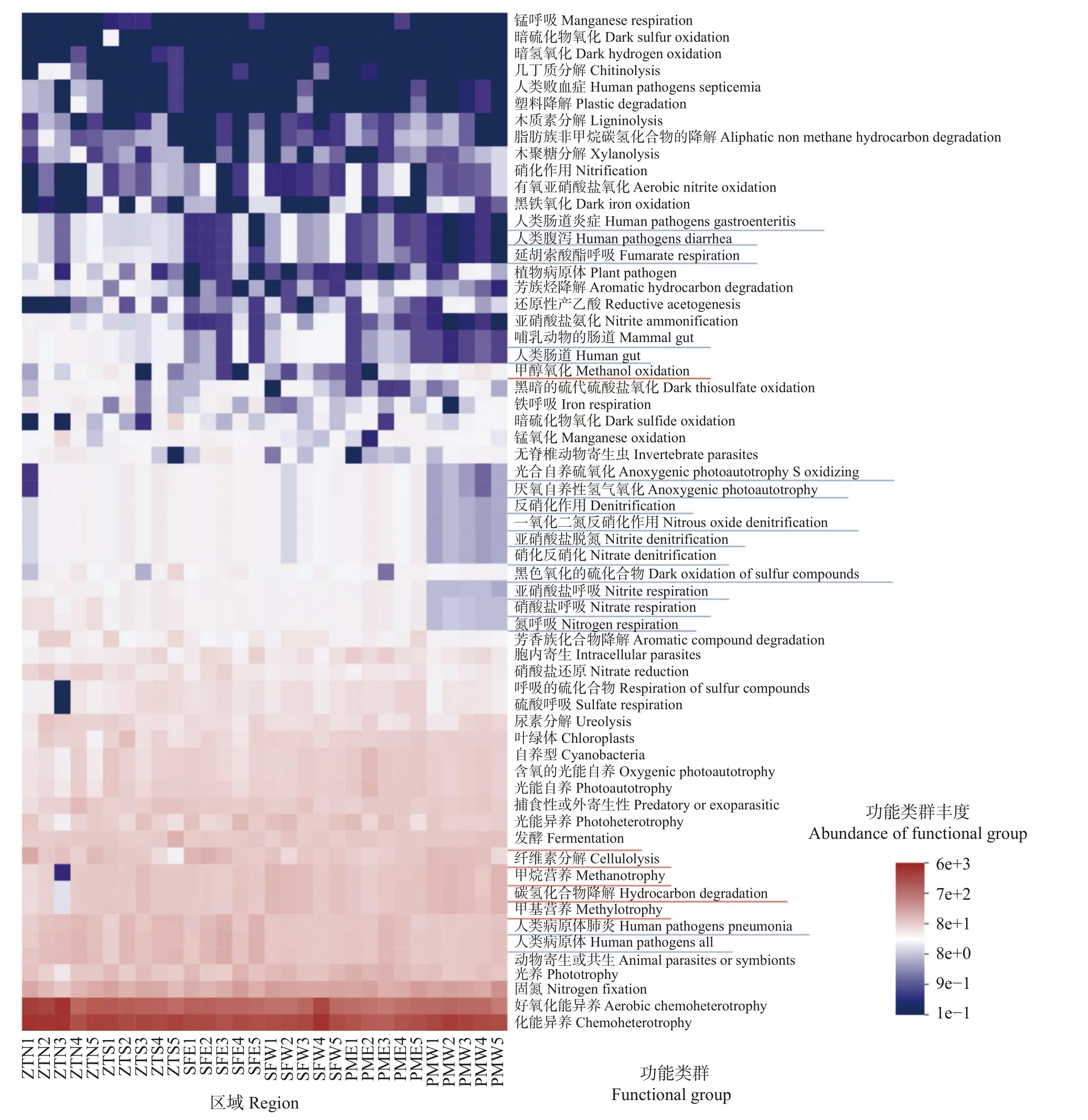
图4 不同研究区稻田土壤微生物菌群预测功能分组Fig.4 Functional prediction of the microbial flora in paddy soils of different regions
2.4 影响稻田土壤细菌群落的关键环境因素分析
Mantel 分析结果(图5)表明,细菌群落主要是受空间距离(r=0.18)、pH (r=0.35)、CEC (r=0.39)、OM(r=0.14)、TN (r=0.24)、TP (r=0.14)、AK (r=0.18)、AP (r=0.14)和金属Ni (r=0.21)的影响(P<0.01)。功能潜力主要与空间距离(r=0.35)、pH (r=0.14)、TN(r=0.17)、TP (r=0.21)、AK (r=0.19)、AP (r=0.14)、Cd (r=0.19)、Cu (r=0.24)、Hg (r=0.21)、Ni (r=0.25)有极显著相关性(P<0.01)。此外,细菌Alpha 多样性(Shannon指数)与空间距离(r=0.22)、TP (r=0.18)、AK (r=0.14)、AP (r=0.27)、Cd (r=0.23)、Cu (r=0.20)和Ni (r=0.27)呈极显著相关性(P<0.01);细菌丰度仅与OM (r=0.32)、TN (r=0.22)、TP (r=0.18)、AK (r=0.33)和Cu (r=-0.14)呈极显著相关(P<0.01)。
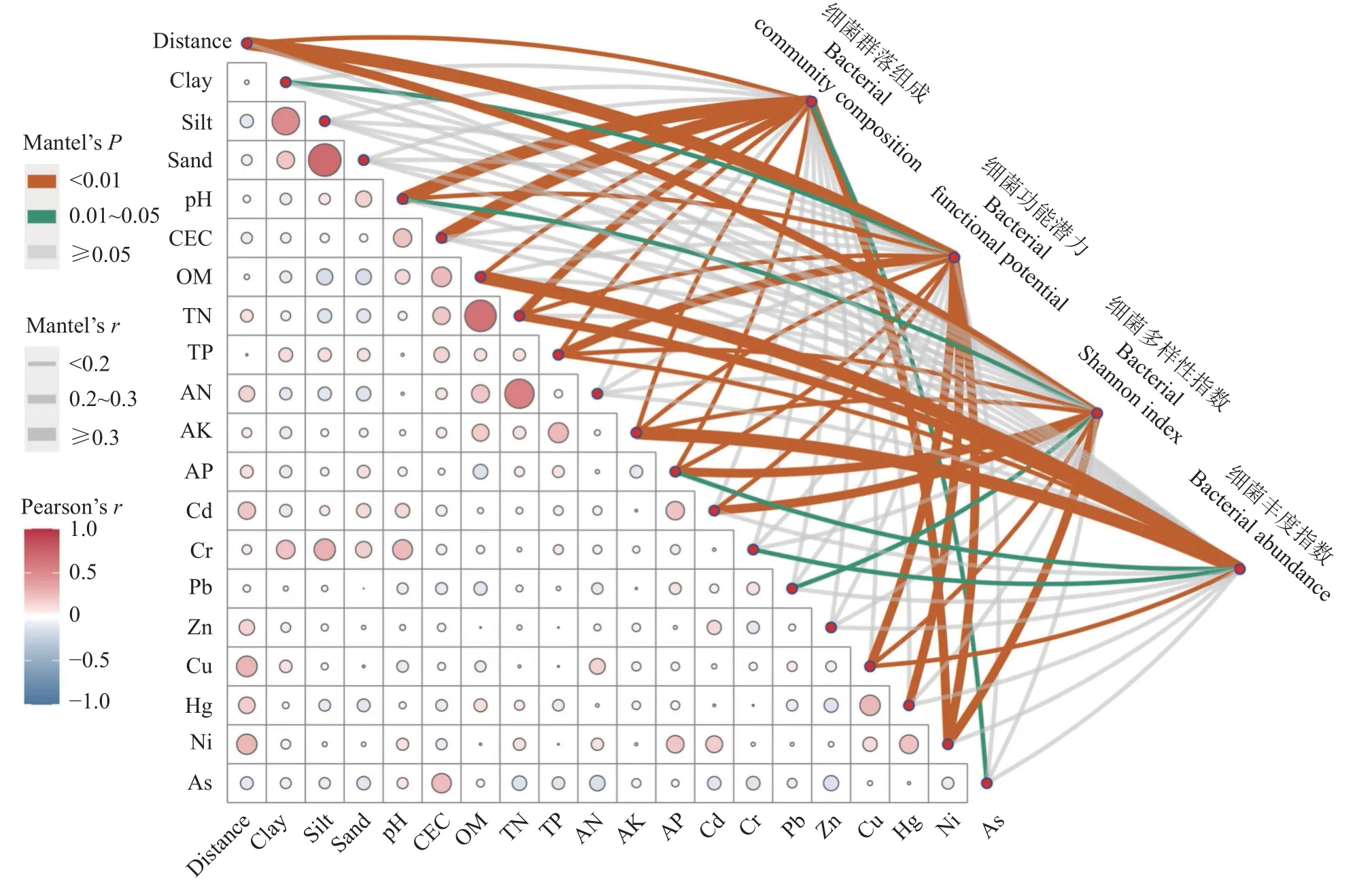
图5 稻田土壤细菌群落结构、功能与土壤性质的关系Fig.5 Relationship between bacterial communities,function and soil properties of paddy soil
3 讨论
3.1 稻田土壤基础物化性质
本研究所涉及的稻田土壤均位于万年县县城周边,隶属于珠溪河(乐安河一级支流)流域,周边山丘环绕,形成了一个相对独立的农田生态系统(图1)。调查发现,该区域稻田土壤总体理化性质较为接近,包括pH、CEC、OM、TN、TP、AK、AP、Cr、Pb、Hg、Ni 和As 含量均未表现出明显的空间分布差异(表1)。同时,本研究是在基肥施撒前进行的土壤样品采集,受速效肥施撒的影响较小。古稻原产区(PMW)稻田土壤AN 和Cu 的含量较其他区域更为丰富。AN 被认为是影响水稻生长的关键性营养元素,而施撒有机肥有利于保持土壤肥力,减少土壤N流失[15],更适合拥有较长生长周期的古稻生长。古稻原产区(PMW)土壤被认为富含各种矿质元素[3],本研究进一步发现Cu 元素在古稻生长区的广泛富集。Cu 同样是植物必需的微量元素,但过量的Cu 会对大多数生物产生毒性作用[16],因此关注Cu 对古稻生长的影响是未来的一个研究方向。此外,研究还表明,Cd 作为我国南方稻田土壤的一种重要重金属污染物[17],在珠田北(ZTN)和上坊西(SFW)地区含量较高,这可能与当地高背景值和矿物开采工作有关。施撒锌肥(主要成分是ZnSO4)被认为是降低水稻吸收Cd 的重要农业措施[18],这可能是导致SFW 稻田土壤含有更高含量Zn 的原因。
3.2 古稻原产区稻田土壤细菌群落和功能特征
微生物作为地下土壤物质循环过程的主要参与者,其生物量和多样性能够表征生态系统的多功能性[19]。本研究发现,细菌丰度及Alpha 多样性均未表现出明显的空间分布差异(表2),这可能意味着整个研究区内细菌驱动的物质循环速率并未表现出巨大差异。然而,与其邻近区域相比,古稻原产区(PMW)细菌群落组成表现出了一定的特异性,且组内空间异质性较低(图2),表明古稻原产区微生态环境较为独特。从细菌群落组成上来看,与邻近区域相比,古稻原产区包含更高丰度的厚壁菌门和拟杆菌门,而酸杆菌门和硝化螺旋菌门的相对丰度偏低。有研究发现,厚壁菌门和拟杆菌门在植物体分解中发挥核心作用,其中厚壁菌门主要参与木质纤维素和半纤维素的降解,而拟杆菌门则是纤维素和木质素降解的关键微生物类群[20]。因此,古稻原产区包含丰富的厚壁菌门和拟杆菌门意味着该区域微生物具有较强的有机质分解能力。同时,隶属于厚壁菌门的部分微生物类群还能够与水稻形成稳定的共生关系,促进水稻的生长发育[21]。而酸杆菌门[22]和硝化螺旋菌门被认为在营养循环(N)中发挥着重要作用,这意味着古稻原产区邻近区域可能也进行着较强的其他物化循环过程。此外,本研究还发现,一些属于变形菌门(如Xanthobacteraceae_unclassified、Methylocystis)和放线菌门(Conexibacter)的属也在古稻原产区大量富集。其中Methylocystis 被认为是参与甲烷代谢的关键类群[23],Conexibacter 可以利用林可霉素抗生素从而减少其对其他生物类群的抑制作用[24]。以上结果表明古稻原产区细菌群落结构的特异性主要体现在组成上,同时可能驱动着差异化的物质循环过程。
细菌群落的组成变化往往能够反映到功能特征上。基于FAPROTAX 进行的功能预测分析发现,古稻原产区稻田土壤细菌群落具有较强的C 代谢遗传潜力,例如有机质降解(发酵、纤维素分解等)和甲烷代谢等(图4),这可能是受古稻原产区特殊的微地形和种植模式的双重影响。有报道认为古稻生长在山垅之中,灌溉用的山泉中携带着大量的枯枝落叶及其分解物,为万年贡谷的生长提供充足的有机营养物质[25]。同时,古稻具有较长的生长周期(160~175 d),有机肥作为一种缓释肥能够很好地保障稻谷生长需求,这种健康的水肥管理措施能够激发微生物更加倾向于分解有机质为作物提供营养物质[26]。有研究发现,长期施用有机肥同样可显著提高土壤微生物量和酶活性,促进土壤有机碳和有机氮的协同利用,对提高土壤肥力具有重要作用[27-28]。而对于邻近的其他研究区域,则表现出较强的N 和S 代谢潜力。有研究发现,长期施肥在增加土壤肥力的同时往往会改变稻田土壤微生物的群落组成,如增加酸杆菌门和硝化螺旋菌门的丰度[29],与本研究类似,而这些菌群往往是参与N 和S 循环的重要微生物类群。此外,施撒的无机肥多是一些速效营养元素,这些元素含量在施肥时瞬时放大,水稻难以及时有效利用,这些营养底物会诱导微生物的矿化[30]。在本研究中,附近区域的各种氮呼吸途径(亚硝酸盐脱氮、硝酸盐脱氮、亚硝酸盐呼吸、硝酸盐呼吸和氮呼吸等)均会被增强。值得注意的是,古稻原产区稻田土壤中关于人类疾病的基因(如人类肠道炎症、人类腹泻、人类病原体肺炎和人类病原体)丰度较低,这进一步说明了该区域土壤更加健康,受人类污染影响较小。
3.3 驱动稻田土壤细菌群落变化的环境因子
细菌群落及其生物地理模式的研究可以深入了解其多样性和生态系统功能的深层生态过程和机制[31]。近期的研究发现,生物群落在组成上的相似性受空间距离的影响存在不确定性[32]。同时,在较小尺度上关于人为干扰较严重的农田土壤的研究更为匮乏。本研究发现,细菌群落组成、功能和多样性均受彼此空间距离的影响(图2 和图5),这除了当地受大生境的影响,还可能会受具体农田管理措施的影响。各样点稻田隶属于不同的耕作者,多处于不同的管理方式下,这在一定程度上也会影响细菌群落变化[33]。我们的研究表明,古稻原产区及其邻近区域稻田土壤细菌群落组成除了受OM、TN、TP、AK和AP 等养分的影响,还受到pH 的重要影响。pH 被认为是影响我国稻田土壤微生物大尺度上空间分布的重要土壤因子[34]。本研究进一步表明,即使在小尺度上(地方河流水系),pH 依然是影响细菌群落组成的重要因素。此外,土壤调酸作为我国南方稻田土壤改良的一种重要手段,其带来的生态环境变化未来还需要进一步的研究论证[35]。除了土壤pH 和各种养分,我们还发现重金属(如Cd、Cu、Hg、Ni)元素也是影响细菌群落(组成、功能、多样性或丰度)的重要土壤因子。一般认为,低浓度的重金属可以促进作物的生长,而过量对任何生命体则是有害且致命的。近期的研究发现,重金属含量的轻微变化都可能导致群落组成和微生物多样性的剧烈变化[36]。因此,未来还需要进一步了解重金属环境下的微生物的响应策略,探索特定功能微生物类群对重金属的抗性及其与植物的互作关系。
4 结论
本研究探索了万年古稻原产区土壤理化性质及细菌群落的特异性。结果表明,受当地地形、水系的影响,古稻原产区土壤仅AN 和Cu 较周边区域含量更高。细菌群落组成(而不是丰度和多样性)在古稻原产区表现出一定的特异性,相较于其他研究区域,表现出更高相对丰度的厚壁菌门和拟杆菌门,以及更低相对丰度的酸杆菌门和硝化螺旋菌门。此外,受古稻原产区长期健康水肥管理措施的影响,细菌群落表现出较强的C 代谢和较弱的N、S 代谢遗传潜力。总体而言,本研究初步解析了万年古稻原产区独特的土壤环境特征。未来应逐步推广施撒有机肥等缓释肥,同时关注重金属(如Cd、Cu、Hg、Ni)含量变化对当地土壤环境造成的潜在影响。
