半夏多糖的制备和表征及抗氧化和免疫增强活性研究
2024-03-25赵小亮郭正磊杨超福王海利王宝忠向紫骏张伟杰
赵小亮 ,郭正磊杨超福王海利王宝忠向紫骏张伟杰 *
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050; 2.甘肃省高校中藏药筛选评价及深加工重点实验室,甘肃 兰州 730050)
半夏来源于天南星科植物半夏Pinelliaternata(Thunb.) Breit.,又名地文、守田等,为传统中药[1]。半夏多糖是半夏中的重要活性成分之一,具有镇咳止吐[2]、抗氧化[3]、抗肿瘤[4]、免疫增强[5]等活性,具有毒副作用小、来源丰富的特点,逐渐成为当前的研究热点。
目前已有关于半夏多糖的纯化、结构和生物活性方面的研究报道,如Gonda 等[6]从半夏中分离出酸性多糖pinellian PA,具有增强补体活性。杨有林等[7]优化了半夏多糖提取工艺,发现其具有抗氧化活性。黄聪等[8]从清半夏中提取半夏多糖,发现其能够显著降低肺组织的MU5AC mRNA 表达来降低黏液分泌,减少痰液生成。Kim 等[9]发现半夏多糖具有抗肥胖活性。Tian 等[10]发现半夏多糖对HepG2 细胞具有一定的抑制作用。Li 等[4]提取了半夏多糖命名为PTPA,发现其可诱导Sk-ChA-1 细胞凋亡。Chen等[11]从半夏中分离的半夏脑苷可有效抑制白色假丝酵母菌生长。尽管已有对半夏多糖制备及活性方面的研究,但由于多糖结构的不均一性及组成的复杂性,对半夏多糖结构分析、抗氧化和免疫增强活性以及构效关系的研究相对较少。
本研究通过提取半夏多糖,并对其进行分离纯化,在对不同多糖组分结构分析的基础上,对抗氧化、免疫增强活性进行评价,以期为半夏多糖的结构及抗氧化、免疫增强活性的深入研究及应用提供参考。
1 材料
1.1 药材 半夏于2019 年10 月购自甘肃省兰州市黄河药材市场,经兰州理工大学杨林副教授鉴定为天南星科植物半夏Pinelliaternata(Thunb.) Breit.的干燥块茎。
1.2 试剂 单糖对照品鼠李糖(Rha)、甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)、木糖(Xyl)、阿拉伯糖(Ara)、岩藻糖(Fuc) 及1-苯基-3-甲基-5-吡唑啉酮(PMP) 购自西格玛奥德里奇(上海) 贸易有限公司; Folin-酚试剂购自上海安耐吉化学有限公司; 二甲亚砜(DMSO)、1,1-二苯基-2-三硝基苯肼(DPPH)、(4,5-二甲基噻唑-2) -2,5-二苯基四氮唑溴盐(MTT)、香菇多糖(LNT)、牛血清白蛋白(BSA) 购自阿拉丁试剂 (上海) 有限公司; 胎牛血清(FBS)、青霉素-链霉素、胰酶购自武汉赛维尔生物科技有限公司; Q-Sephodex Fast Flow (QFF) 阴离子交换填料购自美国Cyctiva 公司; 其他试剂均为国产分析纯。
1.3 仪器 BJ-800A 多功能粉碎机(德清拜杰电器有限公司); DHG-9030A 恒温电热鼓风干燥箱(上海精宏实验设备有限公司); B220 恒温水浴锅、RE53CS 旋转蒸发仪(上海亚荣生化仪器厂); AB104-N 分析天平(瑞士梅特勒-托利多仪器公司); Agilent 1260 高效液相色谱仪 (美国Agilent 公司); ZF-7 磁力搅拌器(江苏省金坛市医疗仪器厂); FD-1-55 冷冻干燥机(北京博医康实验仪器有限公司); TG16-WS 低速大容量离心机(长沙湘仪离心机仪器公司); SHB-IIIA 循环水式真空泵(郑州长城科工贸有限公司); UV-9200 紫外分光光度计(北京瑞利分析仪器公司); Spectrum Two 红外光谱仪(美国PerkinElmer 公司)。
2 方法
2.1 半夏多糖提取 参考文献[12] 方法对半夏进行处理。半夏块茎500 g 于50 ℃干燥箱烘干,粉碎后过40 目筛,加入5 L 80%乙醇80 ℃回流搅拌脱脂4 次,每次4 h,过滤,收集滤渣,干燥后备用。半夏脱脂粉中加入5 L 蒸馏水于室温提取6 次,每次2 h,过滤后合并提取液,真空减压浓缩后加入4 倍体积无水乙醇,4 ℃静置过夜,7 000 r/min 离心10 min,收集沉淀,沉淀复溶于蒸馏水,透析(截留分子量7 kDa) 3 d,透析液减压浓缩后冷冻干燥,得半夏多糖(PT)。
2.2 半夏多糖分离纯化 QFF 阴离子交换柱填料按文献[13] 方法预处理后,装填于55 mm×15 cm 柱中,蒸馏水冲洗3 个柱体积。取半夏多糖150 mg,以蒸馏水完全溶解,过0.22 μm 微孔滤膜后上样,依次用0、0.1、0.2、0.5 mol/L 的NaCl 溶液各洗脱3 个柱体积,自动部分收集器分步收集,苯酚-硫酸法检测,根据洗脱体积和吸光度绘制洗脱曲线。根据洗脱曲线合并收集不同组分,减压浓缩后分别透析(截留分子量7 kDa) 3 d,透析液减压浓缩后冷冻干燥得半夏多糖QFF 离子交换柱分离各组分。
2.3 总糖含量测定 使用苯酚-硫酸法[14]测定半夏多糖的总糖含量。取葡聚糖对照品溶于蒸馏水中,配制0.1 mg/mL 的对照品溶液,稀释得到0、0.01、0.02、0.04、0.06、0.08、0.1 mg/mL 的稀释液,取1 mL 于试管中,每支试管依次加入1 mL 6%苯酚、5 mL 浓硫酸,混匀后沸水浴加热10 min,冷却后使用紫外-可见分光光度计在490 nm 波长处测定吸光度,以对照品质量浓度为横坐标(X),以吸光度为纵坐标(Y) 进行回归,得回归方程。半夏多糖各纯化组分配制成0.1 mg/mL 的溶液,按上述方法处理并测定吸光度,根据回归方程计算总糖含量。
2.4 蛋白质含量测定 使用Lowry 法[15]测定蛋白质含量。使用BSA 配制0.1 mg/mL 的蛋白质对照品溶液,使用去离子水分别稀释至0、0.01、0.02、0.04、0.06、0.08、0.1 mg/mL,取1 mL 于试管中,每支试管加入5 mL 试剂甲,25 ℃水浴10 min,逐管加入0.5 mL 试剂乙混匀,25 ℃水浴30 min,使用紫外-可见分光光度计在700 nm 波长处测定吸光度,以蛋白质对照品质量浓度为横坐标(X),以吸光度为纵坐标(Y) 进行回归,得回归方程。同样方法配制0.1 mg/mL 各多糖样品溶液并测定吸光度,根据回归方程计算蛋白质含量。
2.5 半夏多糖单糖组成分析 使用PMP 柱前衍生高效液相色谱法对半夏多糖各组分进行单糖组成分析。参考文献[16] 方法对样品进行降解,取样品1 ~2 mg 于安瓿瓶中,加入200 μL H2O 完全溶解后加入200 μL 4 mol/L 三氟乙酸(TFA) 溶液,混匀后封口,105 ℃下水解6 h,水解液经氮吹仪吹干,加甲醇反复吹干3 次,除去TFA。参考文献[17] 方法对降解单糖进行衍生,降解样品用100 μL 蒸馏水溶解,加入100 μL 0.3 mol/L NaOH 溶液混匀,再加入120 μL 0.5 mol/L PMP 甲醇溶液,密封70 ℃水浴反应60 min,冷却后加入100 μL 0.3 mol/L HCl 溶液中和。反应液用氯仿萃取5 次,水相用0.22 μm 微孔滤膜过滤,备用,不同单糖对照品采用同样方法衍生和处理。
色谱条件为流动相0.1 mol/L 磷酸盐缓冲液 (pH 6.7) -乙腈(83 ∶17); 柱温30 ℃; DAD 检测器,检测波长245 nm; 体积流量1 mL/min; 进样量20 μL。单糖对照品和样品进样分析,根据出峰时间确定单糖组成,根据峰面积计算各单糖相对比例。
2.6 紫外-可见光谱分析 参考文献[18] 方法,将样品溶于适量蒸馏水,分别配制0.1 mg/mL 半夏多糖各组分溶液,用紫外-可见分光光度计在200 ~900 nm 范围内扫描,记录紫外-可见光谱图。
2.7 红外光谱扫描分析 参考文献[19] 方法,半夏多糖样品在放有P2O5的真空干燥箱中干燥48 h,分别取2~3 mg 样品用干燥KBr 压片,在4 000~400 cm-1范围内进行红外光谱扫描,记录红外光谱图。
2.8 抗氧化活性评价 对DPPH 自由基的清除活性: 按文献[20] 方法,分别配制39、78、156、313、625、1 250、2 500 μg/mL 半夏多糖各组分样品,取2 mL 于试管中,等体积蒸馏水为空白对照,分别加入2 mL 0.1 mmol/mL DPPH 乙醇溶液,混匀,避光静置30 min,维生素C 作为阳性对照。紫外分光光度计517 nm 波长处测定吸光度,计算DPPH 自由基清除率,公式如下:
式中A0为空白标准组吸光度,A为样品吸光度。
对超氧阴离子自由基的清除活性: 按文献[21] 方法,分别取39、78、156、313、625、1 250、2 500 μg/mL半夏多糖各组分样品1 mL 于试管中,等体积蒸馏水为空白对照,立即加入3 mL 0.05 mol/L Tris-HCl (pH 8.2) 溶液混匀,37 ℃水浴加热10 min 后,加入2 mL 30 mmol/L 邻苯三酚溶液反应5 min,加入1 mL 8 mol/L HCl 中止反应,维生素C 作为阳性对照。320 nm 波长处测定吸光度,计算样品超氧阴离子自由基清除率,公式如下:
式中A0为空白标准组吸光度,A为样品吸光度。
对羟基自由基的清除活性: 按文献[22] 方法,分别取39、78、156、313、625、1 250、2 500 μg/mL 半夏多糖各组分样品1 mL 于试管中,等体积蒸馏水为空白对照。依次加入1 mL 9 mmol/L Fe2SO4、1 mL 8.8 mmol/L H2O2和1 mL 9 mmol/L 水杨酸溶液混匀,37 ℃水浴恒温反应15 min,维生素C 作为阳性对照,在510 nm 波长处测定吸光度,计算羟基自由基清除率,公式如下:
式中A0为空白标准组吸光度,A为样品吸光度。
2.9 免疫增强活性评价
2.9.1 多糖溶液配制 将半夏多糖各组分分别溶于细胞培养液中,配制成800 μg/mL 的多糖溶液,0.22 μm 无菌针式过滤器过滤,备用。
2.9.2 细胞培养 RAW264.7 细胞,用含10% FBS 和1%青链霉素的高糖DMEM 培养液在5% CO2、37 ℃培养箱中培养。用适量胰酶将RAW264.7 细胞消化至脱离瓶壁,1 000 r/min 离心6 min,弃上清液,用培养液吹散细胞团制备细胞悬浮液,计数[23]。
2.9.3 免疫增强活性评价 采用MTT 法[10]测定半夏多糖对RAW264.7 细胞增殖的影响。将100 μL 密度为50 个/μL细胞的悬浮液接种于96 孔板中培养24 h,依次加入100 μL质量浓度分别为0、50、100、200、400、800 μg/mL 的半夏多糖样品孵育48 h。之后每孔加入10 μL 5 mg/mL MTT溶液,孵育4 h 后除去各孔中的培养液,加入100 μL DMSO,振荡10 min,充分溶解结晶物,在570 nm 波长处测吸光度,以LNT 为阳性对照,计算细胞活力,公式如下:
式中A0为空白标准组吸光度,A为样品吸光度。
2.10 统计学分析 所有样品均进行3 次重复,采用SPSS 19.0 软件进行处理,2 组间比较采用单因素方差分析,P<0.05 表示差异具有统计学意义,数据以(±s) 表示,使用Origin 8.0 和Graphpad prism 7.0 软件作图。
3 结果
3.1 提取与分离 通过水提-醇沉法从半夏中提取半夏多糖,得率为3.49%。通过QFF 阴离子交换柱分离,洗脱曲线见图1,依次在浓度为0、0.1、0.2、0.5 mol/L NaCl 溶液下洗脱,得到PTC0、PTC01、PTC02、PTC05。

图1 半夏多糖Q-Sepharose Fast Flow 阴离子交换柱分离洗脱曲线
3.2 基本化学性质分析 通过PMP 柱前衍生HPLC 法对半夏多糖各组分的单糖组成进行分析,见图2,不同组分多糖的总糖含量、蛋白质含量以及各单糖相对比例计算结果见表1。
表1 半夏多糖总糖含量、蛋白质含量、单糖组成及相对比例分析结果(±s)

表1 半夏多糖总糖含量、蛋白质含量、单糖组成及相对比例分析结果(±s)
注: —为未检测到。
样品总糖含量/%蛋白质含量/%单糖组成及相对比例RhaGlcGalManGlcNGlcAGalAAra PTC072.4±1.23.4±0.18.719.649.810.24.0——7.7 PTC0169.3±0.93.4±0.39.19.959.37.13.67.9—3.1 PTC0274.6±1.13.1±0.29.824.239.710.62.14.03.56.1 PTC0575.9±1.83.1±0.114.226.231.615.04.8—4.04.2

图2 半夏多糖各组分单糖组成HPLC 分析图
从图2 可知,半夏多糖各组分PTC0、PTC01、PTC02和PTC05 单糖组成较复杂,其中PTC0 由Gal、Glc、Man、Rha、Ara 和GlcN 6 种单糖组成,相对比例为49.8 ∶19.6 ∶10.2 ∶8.7 ∶7.7 ∶4.0; PTC01 由Gal、Glc、Rha、GlcA、Man、GlcN 和Ara 7 种单糖组成,相对比例为59.3 ∶9.9 ∶9.1 ∶ 7.9 ∶ 7.1 ∶ 3.6 ∶ 3.1; PTC02 由Gal、Glc、Man、Rha、Ara、GlcA、GalA 和GlcN 8 种单糖组成,相对比例为39.7 ∶24.2 ∶10.6 ∶9.8 ∶6.1 ∶4.0 ∶3.5 ∶2.1; 而PTC05由Gal、Glc、Man、Rha、GlcN、Ara 和GalA 7 种单糖组成,相对比例为31.6 ∶26.2 ∶15.0 ∶14.2 ∶4.8 ∶4.2 ∶4.0,说明半夏多糖是单糖组成极为复杂的杂多糖。
由表1 可知,半夏多糖各纯化组分蛋白含量均较低。
3.3 紫外-可见光谱分析 半夏多糖经QFF 纯化获得的4个组分的紫外-可见光谱见图3。可知,PTC0、PTC01、PTC02 和PTC05 在260、280 nm 附近仅有微弱吸收峰,说明半夏多糖各组分核酸和蛋白质含量较低,这与蛋白质含量测定结果一致,可用于后续进一步的研究。

图3 半夏多糖各组分紫外-可见光谱图
3.4 红外光谱分析 半夏多糖经QFF 纯化得到的各组分的红外光谱分析图见图4。可知,4 个多糖组分存在相似的多糖特征峰。4 个样品在3 395 cm-1附近均有强且宽大的吸收峰出现,说明多糖存在分子间和分子内氢键,为糖链中-OH伸缩振动引起[24]; 2 926 cm-1附近出现的吸收峰为糖类物质特征峰,为糖链上-CH 伸缩振动引起[25]。1 640 cm-1附近出现-OH 弯曲振动特征吸收峰[26],1 060 cm-1附近为糖链上糖苷键C-O-C 伸缩振动引起,1 034 cm-1附近的吸收峰为葡萄糖特征峰,说明4 个组分均含葡萄糖,这与单糖组成分析结果相符,可知PTC0、PTC01、PTC02 和PTC05 均为糖类化合物。

图4 半夏多糖各组分红外光谱图
3.5 半夏多糖不同组分的抗氧化活性 以多糖质量浓度的对数为横坐标(X),以不同自由基清除率为纵坐标(Y)进行回归,半夏多糖各组分对DPPH 自由基、超氧阴离子自由基和羟基自由基的清除活性结果见图5,其IC50值见表2。由图5A 可知,4 个组分对DPPH 自由基均有清除作用,且随着质量浓度升高,对DPPH 自由基清除作用增强,其中PTC0 作用最强。由图5B 可知,与维生素C 相比,4 个组分对超氧阴离子自由基均有清除作用,且随多糖质量浓度升高而升高,其中PTC0 作用最强。从图5C 可知,与维生素C 相比,4 个组分对羟基自由基的清除作用较弱,且随质量浓度升高而升高,其中PTC01 作用最强。说明4 个组分均具有较好的抗氧化活性且呈剂量依赖性,但不同多糖组分对不同自由基的清除活性存在一定差异,这可能与其细微结构的差异有关[27]。
表2 半夏多糖各组分抑制自由基的IC50值(±s,n=3)
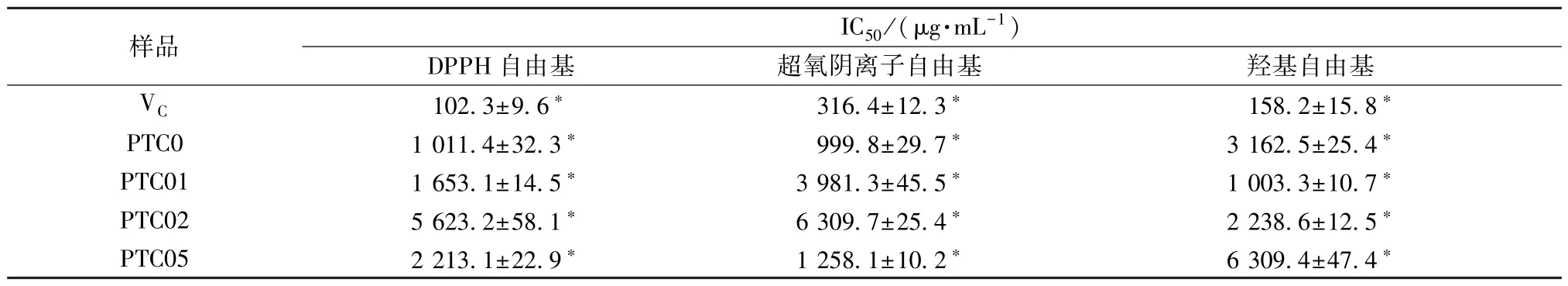
表2 半夏多糖各组分抑制自由基的IC50值(±s,n=3)
注:*P<0.05。
样品IC50/(μg·mL-1)DPPH 自由基超氧阴离子自由基羟基自由基VC102.3±9.6* 316.4±12.3* 158.2±15.8*PTC01 011.4±32.3*999.8±29.7*3 162.5±25.4*PTC011 653.1±14.5*3 981.3±45.5*1 003.3±10.7*PTC025 623.2±58.1*6 309.7±25.4*2 238.6±12.5*PTC052 213.1±22.9*1 258.1±10.2*6 309.4±47.4*
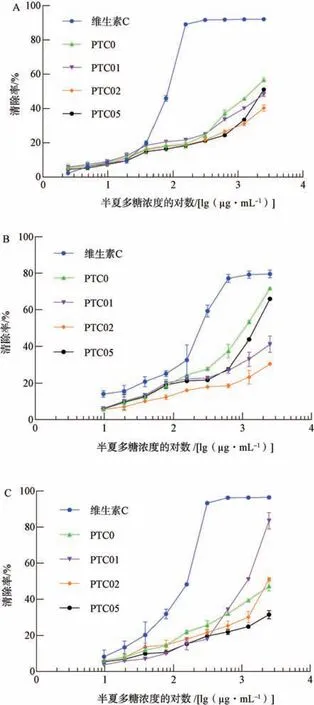
图5 半夏多糖对3 种自由基的清除活性
3.6 免疫增强活性 由图6 可知,4 个半夏多糖组分均有促进RAW264.7 细胞增殖的作用,PTC0 在100~400 μg/mL范围内能促进RAW264.7 细胞增殖,且细胞活力随多糖质量浓度增大而增大,在400 μg/mL 时促进RAW264.7 细胞增殖作用最强,细胞活力为118.8%; PTC01 在各质量浓度均有促增殖作用,在400 μg/mL 时细胞活力最大,为128.8%; PTC02 在各质量浓度均能促进RAW264.7 细胞增殖,且作用效果与质量浓度呈正相关,细胞活力在400 μg/mL时达到161.9%,与空白组比较,对RAW264.7 促增殖作用极显著(P<0.01),与阳性对照LNT 作用相当(LNT 在400 μg/mL 时细胞活力为163.1%); PTC05 在各质量浓度均有促增殖作用,但与空白组比较,促增殖作用不显著,在400 μg/mL 时细胞活力为最大值111.8%。表明PTC02 具有较强的免疫增强活性。

图6 半夏多糖对RAW264.7 细胞的作用
4 讨论
多糖是半夏的主要活性成分,本研究以半夏为原料,通过水提醇沉获得半夏多糖,并经过QFF 阴离子交换柱进行分离纯化,得到4 个组分。通过红外光谱分析发现,4 个组分均为糖类化合物; 紫外-可见光谱和化学分析发现其蛋白质和核酸含量较低,总糖含量高。半夏多糖各组分组成复杂,其中PTC0 由6 种单糖组成,PTC01 和PTC05 由7 种单糖组成,PTC02 由8 种单糖组成,并且不同组分单糖组成的相对比例也存在较大差异。多糖的活性与其结构密切相关,特别是决定一级结构的单糖残基组成及相对比例,半夏多糖不同组分结构的复杂性也预示不同组分可能具有不同的活性。
生物体内活性氧过量时会引起细胞器损伤、蛋白质变质和DNA 损伤等,导致病理损伤。对DPPH、超氧阴离子和羟基自由基清除活性的评价是常用的体外抗氧化活性评价方法,本研究结果表明半夏多糖各组分对3 种自由基的清除活性具有量效关系,不同组分的IC50差异较大,推测可能与4 个多糖的单糖组成和相对比例有关,可能还与分子量、空间结构等因素有关[28],其抗氧化活性与结构的关系还需进一步深入研究。
免疫调节药物常用于免疫失调,但研究发现有些免疫调节剂会产生有害作用[29]。天然多糖不仅具有免疫调节活性,且毒副作用小,这使其成为研究热点。本研究发现4个组分在25 ~400 μg/mL 范围内对RAW264.7 细胞增殖均有促进作用,其中PTC02 作用最强,与临床使用的免疫调节药物LNT 活性相当,并且呈明显的剂量依赖性。单糖组成及相对比例分析结果表明,和其他组分相比,PTC02 的单糖组成最复杂,这使其一级结构与空间结构变化更多样,可能是其高免疫增强活性的原因[30]。
综上所述,从半夏中制备的4 个组分均为杂多糖,具有较好的抗氧化活性和免疫增强活性,其中PTC02 作用最强,具有进一步开发为免疫调节药物的潜力。本研究为半夏多糖进一步的结构表征奠定了基础,并为其作为天然抗氧化剂和免疫增强药物的开发提供了参考。
