复方佛耳草合剂对慢性阻塞性肺疾病大鼠TLR4/MyD88/NF-κB 信号通路的影响
2024-03-25廖健杉李凤森石克华
廖健杉,折 哲,李凤森,石克华*
(1.上海中医药大学附属市中医医院,上海 200071; 2.上海中医药大学附属第七人民医院,上海 200137; 3.新疆维吾尔自治区中医医院,新疆 乌鲁木齐 830000)
慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD) 是以持续呼吸道症状与气流受限为特征的肺部咳喘疾病,通常与遗传因素及环境因素相关,其发病机制主要包括气道氧化应激、炎症反应及气道重塑[1]。流行病学调查显示,COPD 患者发病率和患病率呈逐年上升趋势,预计到2050 年,我国COPD 患病人数或将达到2.15亿[2]。中医药通过补肺纳肾健脾,祛邪利气,从而达到治疗COPD 的目的,具有治疗效果显著、不良反应少、能有效降低复发率等优势[3]。复方佛耳草合剂是上海中医药大学附属市中医医院使用三十余年的中药制剂,具有清热化痰、止咳平喘之效,临床主要应用于痰热郁肺型疾病。本团队前期临床研究发现该方可迅速缓解COPD 患者咳喘症状,不仅能减轻肺部炎症反应,而且对COPD 患者肺功能有保护作用[4-6],但其机制仍需进一步研究。因此,本实验采用烟草烟雾暴露联合脂多糖(lipopolysaccharide,LPS) 建立COPD 大鼠模型,并基于Toll 样受体4 (toll-like receptor 4,TLR4) /髓样分化因子88 (myeloiddifferentiationfactor88,MyD88) /核转录因子-κB (nuclear factor kappa-B,NF-κB) 信号通路探讨复方佛耳草合剂对COPD 大鼠潜在作用机制。
1 材料
1.1 动物 SPF 级Wistar 雄性大鼠60 只,6 周龄,体质量(180±20) g,购自上海斯莱克实验动物有限责任公司[实验动物生产许可证号SCXK(沪) 2017-0005],饲养于室温(23±3)℃的环境,自由摄食和饮水。本实验经上海中医药大学附属市中医医院医学伦理委员会批准 ( 伦理号dw2019015)。
1.2 药物 复方佛耳草合剂由佛耳草、鱼腥草、车前草、地龙、百部、陈皮、甘草等组成,由上海中医药大学附属市中医医院药剂科提供,批号20170923。醋酸地塞米松片购自上海上药信谊药厂有限公司,批号180313。
1.3 试剂 大前门香烟(上海烟草集团有限责任公司,批号20190115); 脂多糖(LPS)、DMSO (美国Sigma-Aldrich 公司,批号L2880、D5879); 肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白细胞介素-1β (interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、超氧化物歧化酶(superoxide dismutase,SOD )、丙 二 醛 ( malondialdehyde,MDA) 酶联免疫吸附测定法(ELISA) 试剂盒、苏木素伊红(HE) 染色试剂盒、辣根过氧化物酶标记二抗、DAB 显色试剂盒、RIPA 裂解液、BCA 蛋白浓度测定试剂盒、ECL 化学发光试剂盒(上海碧云天生物技术股份有限公司,批号PT518、PI305、PI330、S0101S、S0131S、C0105、A0208、P0203、P0013B、P0010、P0018S); TRIzol 试剂盒(美国英杰生命技术有限公司,批号14105);TLR4 抗体、MyD88 抗体、NF-κB 抗体、TNF-α 抗体、β-肌动蛋白(recombinant human beta-actin,βactin) 抗体 (英国Abcam 公司,批号ab22048、ab133739、ab283716、ab183218、ab8226)。
1.4 仪器 染毒箱(自制,大小约80 cm×50 cm×40 cm,上方中央有可开启的小口,周围有12 个小的透气孔); AniRes2005 动物肺功能分析系统(北京贝兰博科技有限公司); 低温高速离心机(美国Sigma-Aldrich 公司); 酶标仪(上海百基生物科技有限公司); 实时荧光定量PCR 仪、电泳仪(美国Bio-Rad 公司); 凝胶成像仪(上海天能生命科学有限公司)。
2 方法
2.2 一般情况观察 每天观察各组大鼠咳嗽、喘鸣、气促等情况,毛发、摄食饮水量、口鼻分泌物、精神状态及死亡情况。
2.3 肺功能检测 实验第36 周末 (给药结束后),各组大鼠腹腔注射10%水合氯醛(4 mL/kg)进行麻醉,切开颈部皮肤,暴露气管,将靠进环状软骨的气管以T 字形切开,插入软管并用手术线固定,放入仪器体描箱内,确保箱子密闭性,检测0.2 秒用力呼气容积(forced expiratory volume in 0.2 second,FEV0.2)、用力肺活量(forced vital capacity,FVC)、肺动态顺应性(dynamic compliance,Cydn)、肺总阻力(lung resistance,RL)、呼气相气道阻力(expiratory airway resistance,Re) 等参数,重复检测操作3 次。
2.4 标本采集 肺功能检测结束后,腹主动脉采血5 mL,3 000 r/min 离心15 min,吸取上清,于-80 ℃保存; 脱颈处死大鼠,切开胸腔,立即取出肺组织,液氮保存备用。
2.5 肺组织病理学检查 右肺下叶置于4% 多聚甲醛中固定,常规脱水,石蜡包埋,切片厚约4 μm,进行常规HE 染色,树脂封片,在光镜下观察支气管与肺泡病理改变。参照文献[11] 报道方法,对肺组织病理进行半定量评分。评分指标(1) 气道是否存在阻塞; (2) 气道上皮是否糜烂坏死; (3) 气道上皮杯状细胞化生; (4) 气道上皮鳞状细胞化生; (5) 管壁炎性细胞浸润; (6)管壁纤维结缔组织增生; (7) 气道管壁平滑肌增生,评分标准正常为0 分,轻度损伤为1 分,中度损伤为2 分,重度损伤为3 分。每项指标分值合计,即得到病理学评分。
2.6 ELISA 法检测血清炎症因子水平 取各组大鼠血清,严格按试剂盒说明书操作,检测血清TNF-α、IL-1β、IL-6、MDA 水平及SOD 活性。
2.7 RT-qPCR 法检测肺组织TLR4、MyD88、NFκB、caspase-3 mRNA 表达 以TRIzol 一步法提取大鼠肺组织总RNA,反转录成cDNA。由生工生物工程(上海) 股份有限公司设计并合成引物,引物序列见表1。PCR 反应程序为94 ℃ 10 min,94 ℃30 s,72 ℃30 s,40 个循环扩增; 最后72 ℃10 min 结束反应。以β-actin为内参,结果采用2-ΔΔCT法计算各目的基因的表达。

表1 引物序列Tab.1 Primer sequences
2.8 Western blot 法检测肺组织TLR4、MyD88、NF-κB、TNF-α 蛋白表达 称取肺组织60 mg 加入RIPA 裂解液中,置于冰上裂解,提取组织中总蛋白,使用BCA 法测定蛋白浓度。电泳分离相关蛋白,在低温环境下转膜,5%脱脂奶粉溶液封闭1 h后,加入一抗稀释液 (TLR4、MyD88、NF-κB、TNF-α、β-actin 分别按1 ∶500 稀释),4 ℃孵育过夜,TBST 充分洗涤后,加入二抗(1 ∶1 000) 室温孵育1 h,TBST 充分洗涤后,加入ECL 显色并扫描,以β-actin 为内参,采用Image J 软件分析目的蛋白条带光密度(OD) 值并计算目的蛋白表达量。
2.9 统计学分析 通过GraphPad Prism 7 软件进行处理,数据以(±s) 表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
3 结果
3.1 大鼠一般情况 空白组大鼠精神状态良好,毛色洁白有光泽,体型适中,活泼好动,反应灵敏,呼吸平稳,未见咳嗽、咯痰、打喷嚏等症状;与空白组比较,模型组大鼠精神萎靡,毛色枯黄少光泽,咳嗽、喷嚏频发,反应缓慢,鼻分泌物增加,喉间痰鸣声明显,摄食减少,饮水量增加; 与模型组比较,地塞米松组和复方佛耳草合剂各剂量组大鼠气喘、喉间痰鸣声有不同程度减轻,精神状态稍好转,摄食量、饮水量均有所增加。实验过程中无大鼠死亡情况发生。
伊拉克公司开发的米桑油田所在地是30多年前两伊战争的主战场,起初油田范围内随处可见地雷和未爆炸的炮弹、子弹。身处这样的环境,说不害怕是不可能的,尤其是头几个月,连睡觉都是一种奢求。但我们知道这片“滩涂”闯过去就是“坦途”。米桑油田群项目是中海油首次作为主合同方管理的海外整装油田,也是公司首次从无到有,全方位、全流程构建海外项目财务体系的一个绝佳时机。我们选择在这片“荒芜之地”暂时忘却恐惧,只为建起一套海外项目的财务管理体系,能够推广适用于公司今后的海外项目。
3.2 复方佛耳草合剂对COPD 大鼠肺功能的影响 与空白组比较,模型组大鼠FEV0.2/FVC 降低(P<0.01),Cdyn、RL 及Re 升高(P<0.01),提示模型组大鼠存在阻塞性通气功能障碍; 与模型组比较,地塞米松组和复方佛耳草合剂各剂量组FEV0.2/FVC 升高 (P<0.05,P<0.01),Cdyn、RL 及Re 降低(P<0.05,P<0.01),表明复方佛耳草合剂能延缓FEV0.2/FVC 下降趋势,减轻气道阻力,以高剂量组效果较佳,见表2。
表2 复方佛耳草合剂对COPD 大鼠肺功能的影响(±s,n=6)Tab.2 Effects of Compound Fo’ercao Mixture on pulmonary function of COPD rats (±s,n=6)

表2 复方佛耳草合剂对COPD 大鼠肺功能的影响(±s,n=6)Tab.2 Effects of Compound Fo’ercao Mixture on pulmonary function of COPD rats (±s,n=6)
注: 与空白组比较,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
组别(FEV0.2/FVC)/%Cdyn/(mL·cm H2O-1)RL/(H2O·s·mL-1)Re/(H2O·s·mL-1)空白组93.02±7.610.341±0.3510.357±0.0400.234±0.010模型组60.36±5.01##0.817±0.073##0.801±0.080##0.414±0.030##地塞米松组86.20±4.91**0.468±0.050**0.446±0.065**0.309±0.021**复方佛耳草合剂低剂量组73.52±9.79*0.665±0.020*0.615±0.070**0.341±0.015**复方佛耳草合剂中剂量组80.71±6.65**0.498±0.124**0.522±0.064**0.324±0.045**复方佛耳草合剂高剂量组85.59±2.44**0.445±0.068**0.465±0.055**0.313±0.017**
3.3 复方佛耳草合剂对COPD 大鼠肺组织病理学的影响 空白组大鼠肺组织结构正常,支气管管壁与肺泡形态完整,细胞排列结构有序,未见炎症细胞弥漫浸润; 模型组大鼠肺泡壁增厚,肺间质炎性分泌物大量增加,部分肺泡间隔断裂融合形成较大含气囊腔,部分黏膜上皮杯状细胞变形、坏死; 地塞米松组和复方佛耳草合剂各剂量组大鼠肺组织气道管壁与肺泡壁增厚、黏膜上皮变形及坏死、炎症细胞浸润及管腔狭窄均得到不同程度改善,其中复方佛耳草合剂低剂量组变化程度居于空白组与模型组之间,地塞米松组及复方佛耳草合剂高剂量组变化程度相似,均优于复方佛耳草合剂中剂量组,见图1。与空白组比较,模型组大鼠肺组织病理评分升高(P<0.01); 与模型组比较,地塞米松组和复方佛耳草合剂各剂量组大鼠肺组织病理评分降低(P<0.01),且复方佛耳草合剂的作用呈剂量依赖性,见表3。

图1 各组大鼠肺组织病理图(HE,×100)Fig.1 Pathology of rat lung tissue of each group (HE,×100)
表3 复方佛耳草合剂对COPD 大鼠肺组织病理评分的影响(±s,n=6)Tab.3 Effects of Compound Fo’ercao Mixture on pathological score of rat lung tissue (±s,n=6)

表3 复方佛耳草合剂对COPD 大鼠肺组织病理评分的影响(±s,n=6)Tab.3 Effects of Compound Fo’ercao Mixture on pathological score of rat lung tissue (±s,n=6)
注: 与空白组比较,##P<0.01; 与模型组比较,**P<0.01。
组别评分/分空白组1.20±0.83模型组12.40±1.14##地塞米松组6.20±0.83**复方佛耳草合剂低剂量组9.20±0.83**复方佛耳草合剂中剂量组8.00±0.70**复方佛耳草合剂高剂量组6.80±0.83**
3.4 复方佛耳草合剂对COPD 大鼠血清TNF-α、IL-1β、IL-6、MDA 水平及SOD 活性的影响 与空白组比较,模型组大鼠血清SOD 活性降低(P<0.01),TNF-α、IL-1β、IL-6、MDA 水平升高(P<0.01); 与模型组比较,地塞米松组和复方佛耳草合剂各剂量组血清TNF-α、IL-1β、IL-6、MDA 水平降低(P<0.05,P<0.01),地塞米松组和复方佛耳草合剂中、高剂量组血清SOD 活性升高(P<0.01),提示复方佛耳草合剂可以恢复机体SOD 活性,调节COPD 大鼠血清中炎症因子水平,且高剂量组效果较佳,见表4。
表4 复方佛耳草合剂对COPD 大鼠血清TNF-α、IL-1β、IL-6、MDA 水平及SOD 活性的影响(±s,n=6)Tab.4 Effects of Compound Fo’ercao Mixture on serum TNF-α,IL-1β,IL-6 and MDA levels and SOD activity in COPD rats (±s,n=6)

表4 复方佛耳草合剂对COPD 大鼠血清TNF-α、IL-1β、IL-6、MDA 水平及SOD 活性的影响(±s,n=6)Tab.4 Effects of Compound Fo’ercao Mixture on serum TNF-α,IL-1β,IL-6 and MDA levels and SOD activity in COPD rats (±s,n=6)
注: 与空白组比较,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
组别TNF-α/(ng·L-1)IL-1β/(ng·L-1)IL-6/(ng·L-1)SOD/(U·mg-1)MDA/(U·mg-1)空白组38.57±8.5431.67±9.5934.24±8.0870.73±6.6212.41±2.64模型组158.73±9.96##155.73±15.54##151.75±9.96##33.07±5.01##28.40±3.01##地塞米松组97.76±12.88**106.30±12.60**118.81±14.04**63.70±8.67**15.20±2.19**复方佛耳草合剂低剂量组126.42±6.53**132.12±8.45**127.08±14.06*45.68±4.9422.90±2.72*复方佛耳草合剂中剂量组104.67±10.20**111.68±10.45**124.30±5.83**50.92±6.37**17.24±1.48**复方佛耳草合剂高剂量组92.86±9.55**98.37±12.24**107.29±10.40**59.57±9.00**14.73±2.08**
3.5 复方佛耳草合剂对COPD 大鼠肺组织TLR4、MyD88、NF-κB、caspase-3 mRNA 表达的影响 与空白组比较,模型组大鼠肺组织TLR4、MyD88、NF-κB、caspase-3 mRNA 表达升高(P<0.01); 与模型组比较,地塞米松组和复方佛耳草合剂各剂量组大鼠肺组织TLR4、MyD88、NF-κB、caspase-3 mRNA 表达降低(P<0.05,P<0.01),且高剂量组效果较佳,见表5。
表5 复方佛耳草合剂对COPD 大鼠肺组织TLR4、MyD88、NF-κB、caspase-3 mRNA 表达的影响(±s,n=6)Tab.5 Effects of Compound Fo’ercao Mixture on pulmonary mRNA expressions of TLR4,MyD88,NF-κB and caspase-3 of COPD rats (±s,n=6)

表5 复方佛耳草合剂对COPD 大鼠肺组织TLR4、MyD88、NF-κB、caspase-3 mRNA 表达的影响(±s,n=6)Tab.5 Effects of Compound Fo’ercao Mixture on pulmonary mRNA expressions of TLR4,MyD88,NF-κB and caspase-3 of COPD rats (±s,n=6)
注: 与空白组比较,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
组别TLR4MyD88NF-κBcaspase-3空白组1.24±0.381.66±0.291.15±0.141.31±0.04模型组6.32±0.41##4.33±0.21##4.75±0.90##4.62±0.39##地塞米松组2.61±0.41**2.85±0.51**1.75±0.44**2.64±0.37**复方佛耳草合剂低剂量组4.05±0.83**3.64±0.12*2.15±0.47**3.10±1.10**复方佛耳草合剂中剂量组2.77±0.53**3.08±0.39**1.70±0.27**2.86±0.67**复方佛耳草合剂高剂量组1.70±0.50**2.38±0.43**1.58±0.51**2.23±0.66**
3.6 复方佛耳草合剂对COPD 大鼠肺组织TLR4、MyD88、NF-κB、TNF-α 蛋白表达的影响 与空白组比较,模型组大鼠肺组织TLR4、MyD88、NFκB、TNF-α 蛋白表达升高(P<0.01); 与模型组比较,地塞米松组和复方佛耳草合剂各剂量组大鼠肺组织TLR4、MyD88、NF-κB、TNF-α 蛋白表达降低(P<0.01),且高剂量组效果较佳,见图2、表6。

图2 各组大鼠肺组织TLR4、MyD88、NF-κB、TNF-α 蛋白条带图Fig.2 Protein bands of TLR4,MyD88,NF-κB and TNF-α in rat lung tissue of each group
表6 复方佛耳草合剂对COPD 大鼠肺组织TLR4、MyD88、NF-κB、TNF-α 蛋白表达的影响(±s,n=6)Tab.6 Effects of Compound Fo’ercao Mixture on pulmonary protein expressions of TLR4,MyD88,NF-κB and TNF-α of COPD rats (±s,n=6)
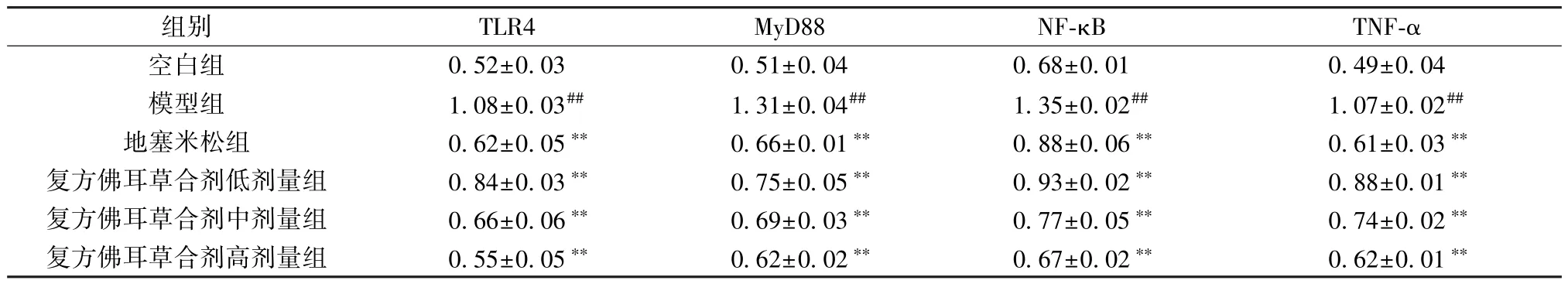
表6 复方佛耳草合剂对COPD 大鼠肺组织TLR4、MyD88、NF-κB、TNF-α 蛋白表达的影响(±s,n=6)Tab.6 Effects of Compound Fo’ercao Mixture on pulmonary protein expressions of TLR4,MyD88,NF-κB and TNF-α of COPD rats (±s,n=6)
注: 与空白组比较,##P<0.01; 与模型组比较,**P<0.01。
组别TLR4MyD88NF-κBTNF-α空白组0.52±0.030.51±0.040.68±0.010.49±0.04模型组1.08±0.03##1.31±0.04##1.35±0.02##1.07±0.02##地塞米松组0.62±0.05**0.66±0.01**0.88±0.06**0.61±0.03**复方佛耳草合剂低剂量组0.84±0.03**0.75±0.05**0.93±0.02**0.88±0.01**复方佛耳草合剂中剂量组0.66±0.06**0.69±0.03**0.77±0.05**0.74±0.02**复方佛耳草合剂高剂量组0.55±0.05**0.62±0.02**0.67±0.02**0.62±0.01**
4 讨论
COPD 在中医学中属于“喘证” “咳嗽” “肺胀” “痰饮” 等范畴,病机以肺脾肾气俱虚为本,六淫实邪入侵为标,治疗上应以清泻肺热、宣肺止咳、化痰平喘为治疗法则[12]。复方佛耳草合剂组方中,重用佛耳草以清化肃肺而镇咳平喘为君药;鱼腥草清热消痈,清解肺中邪热郁毒,车前草清热祛痰,共为臣药; 久病入络,佐以地龙清热、通络、平喘,百部温润肺气止咳,陈皮燥湿化痰兼理气; 甘草止咳祛痰,调和众药为使。全方标本同治,润燥相济,共奏清热化痰,宣肺平喘之效。
本研究通过烟草烟雾暴露联合气道注射LPS建立COPD 大鼠模型,发现COPD 大鼠肺通气功能下降,存在气道阻力,肺组织存在大量炎性浸润,支气管管壁增厚及管腔不规则狭窄,提示COPD 模型构建成功。给予复方佛耳草合剂干预后,大鼠肺组织炎性细胞浸润明显减少,有效延缓肺功能下降趋势,改善气道气流受限症状,其中以高剂量组疗效显著,但其机制需进一步验证。
大量研究证实,吸烟是COPD 最核心致病因素之一,可诱发气道炎症反应、激活氧化应激,进一步损伤气道及肺部组织[13]。炎症细胞活化将产生大量活性氧,引起肺部脂质过氧化增加,诱导细胞脂质受损[14-15]。当机体内氧化与抗氧化作用失衡,将引起异常细胞凋亡反应[16]。caspase 家族蛋白酶能够直接导致凋亡细胞解体,其中caspase-3 被认为是凋亡的关键蛋白酶[17]。本研究结果显示,与模型组比较,复方佛耳草合剂各剂量组血清SOD活性增加,MDA 水平及炎症因子TNF-α、IL-1β、IL-6 水平降低,caspase-3 mRNA 表达下调,提示复方佛耳草合剂能够减轻细胞膜过氧化损伤,抑制炎性细胞募集,减少肺泡上皮细胞凋亡相关基因的表达,从而发挥对COPD 大鼠肺组织保护的作用。
Toll 样受体(TLR) 作为非特异性免疫系统识别病原体相关蛋白的一类受体蛋白[18],在炎症反应过程中发挥重要作用。TLR4 被认为是参与炎症反应的主要Toll 样受体,能够与病原体细胞壁上的脂多糖发生特异性结合,激活其下游MyD88 依赖性或非依赖性途径[19],进一步诱导NF-κB 活化,刺激TNF-α、IL-6、IL-1β 及IL-18 等促炎因子表达[20]。研究表明,TLR4/MyD88/NF-κB 信号通路参与了COPD 的炎症反应和肺损伤过程[21],控制COPD 炎症反应与抑制TLR4/MyD88/NF-κB 信号通路相关蛋白有关[22]。本研究发现,模型组大鼠肺组织TLR4、MyD88、NF-κB 基因和蛋白表达均升高,复方佛耳草合剂干预后,肺组织TLR4、MyD88、NF-κB 基因和蛋白表达降低,且作用呈剂量依赖性,提示复方佛耳草合剂可能通过抑制TLR4/MyD88/NF-κB 信号通路,进一步阻止细胞凋亡发生,减轻组织炎症反应。
综上所述,复方佛耳草合剂可改善COPD 大鼠的肺功能,对支气管-肺组织损伤有保护作用,减少肺脏局部及全身性炎症发生,纠正机体氧化/抗氧化失衡状态,其作用机制可能与抑制TLR4/MyD88/NF-κB 信号通路激活密切相关。然而,本研究仅进行体内实验,后续需从细胞层面进一步阐述复方佛耳草合剂对TLR4/MyD88/NF-κB 信号通路调控作用。
