早期胚胎发育合子基因组激活调控*
2024-03-23邢吉祥李寒霜李海成左永春
邢吉祥 李寒霜 李海成 左永春**
(1)内蒙古大学生命科学学院,呼和浩特 010070;2)内蒙古大学省部共建草原家畜生殖调控与繁育国家重点实验室,呼和浩特 010070)
受精后雌雄配子相互结合形成一个全新的有机体,在受精卵刚刚形成的一段时间内,合子基因组的转录活性处于相对静止状态,受精卵会重新编程为全能性细胞[1]。卵母细胞在逐渐成熟的过程中会积累大量的母源性物质(RNA 和蛋白质)[2-3],细胞重编程过程依赖于这些母源性物质来调控。而随着发育的不断进行,母源物质会经历分阶段的降解[4-7],合子或胚胎基因组被激活(zygotic/embryonic genome activation,ZGA/EGA),母源性调控会逐渐转变为合子基因组调控[8-10],这一过程被称为母源-合子转换(maternal-zygotic transition,MZT)[7,11-12]。其包含两个主要的分子事件,母源物质的降解以及合子基因组激活[12-13]。合子基因组的转录激活和母源物质降解是协调互作的。母源性物质在卵母细胞成熟以及早期胚胎发育过程中起着巨大的作用,但过量积累不利于胚胎后续的发育[2]。合子基因组激活作为植入前胚胎发育最重要的转折点之一,其能否正确激活决定着早期胚胎能否继续发育完全,对于胚胎的进一步形成和分化具有深远的影响[14]。
1 母源物质的降解
启动母源-合子转换并实现合子基因组激活的重要一步就是以高度协调的方式完成母源物质的降解。主要通过两种连续的途径完成,第一种是完全由成熟卵母细胞中积累的母源基因产物主导的阶段特异性降解途径,称为母源降解(maternal decay,M-decay)。主要发生在减数分裂期间,在生发泡破裂后启动,并持续到MⅠⅠ时期。第二种是依赖于合子基因组激活后新表达的转录产物介导完成,称为合子降解(zygotic decay,Z-decay)[5,15]。约90%的母源物质在小鼠ZGA的2细胞阶段结束时被降解[6,16]。
当M-decay途径受损无法正常进行时,小鼠受精卵会停滞在2 细胞时期。同样,Z-decay 途径相关调控因子的缺失,也会造成小鼠ZGA 失败以及合子转录产物严重减少[5,16]。M-decay 和Z-decay途径的规模、动态变化和调控因子在不同物种的不同发育阶段上略有差异。微RNA(microRNA,miRNA)被认为是果蝇、斑马鱼和非洲爪蟾Z-decay途径的重要促进因子。然而,在小鼠中miRNA 是否参与Z-decay途径仍不太清楚[6,17]。许多研究表明,多种母源因子及其调控途径在小鼠和人类中是保守的。例如,BTG4和CCR4-NOT介导的M-decay途径以及TEAD4 和母源辅助因子YAP1 共同介导末端尿苷基转移酶4/7(terminal uridylyl transferase 4/7,TUT4/7)的合子表达所启动的Z-decay 途径[18-21]。小鼠和人类之间母源物质降解的差异主要体现在Z-decay 途径的起点和持续时间上。由于对合子基因产物的依赖,Z-decay 途径主要发生在ZGA附近,但小鼠和人类的ZGA时期不同。此外,相比于小鼠,合子基因产物在人类Z-decay 途径中起着更重要的作用。当合子转录被抑制时,影响了人类超过90%的母源物质降解[5,15-16,22]。
2 合子基因组的激活
在同一物种内,合子基因组激活(ZGA)是相对保守的,但由于物种形成和基因组进化上时间的不同步,ZGA 的发生时间以及持续进行的过程机制,在不同物种中差异显著[9,14]。人和小鼠等哺乳动物植入前胚胎细胞分裂速度较慢,ZGA 一般在1~3个细胞周期内开始发生,而果蝇和斑马鱼等其他动物的细胞分裂通常伴随着快速的细胞周期,分裂速度相对较快且转录产物较少,ZGA 的发生更倾向于在5~10 个细胞周期之后[9,14,23]。小鼠受精卵完成第一次细胞分裂时,果蝇和斑马鱼等其他动物的胚胎发育已经远超出了原肠胚阶段[24]。合子基因组的这种延迟转录激活被认为有助于雌雄配子基因组的结合以及重编程为全能性细胞,其中可能受到不同的机制调节[2,9,14,23,25]。
合子基因组激活并不是一个瞬时发生的事件,基因的转录是以一种波的形式逐渐被激活。主要包括发生在早期的小规模合子基因组激活,次波ZGA(minor ZGA)[26],以及发生在晚期的大规模合子基因组激活,主波ZGA(major ZGA)[7,12]。major ZGA的基因表达对胚胎的持续发育具有全局性的影响。小鼠大约在受精后24 h 经历major ZGA,主要发生在2细胞阶段。而果蝇和斑马鱼分别在受精后2.5 h的第14个细胞周期和受精后3 h的第10 个细胞周期经历major ZGA,相比之下小鼠major ZGA的发生时间要晚得多[2,27](表1,图1)。

Table 1 Periods of ZGA activation in different species表1 不同物种合子基因组激活时期
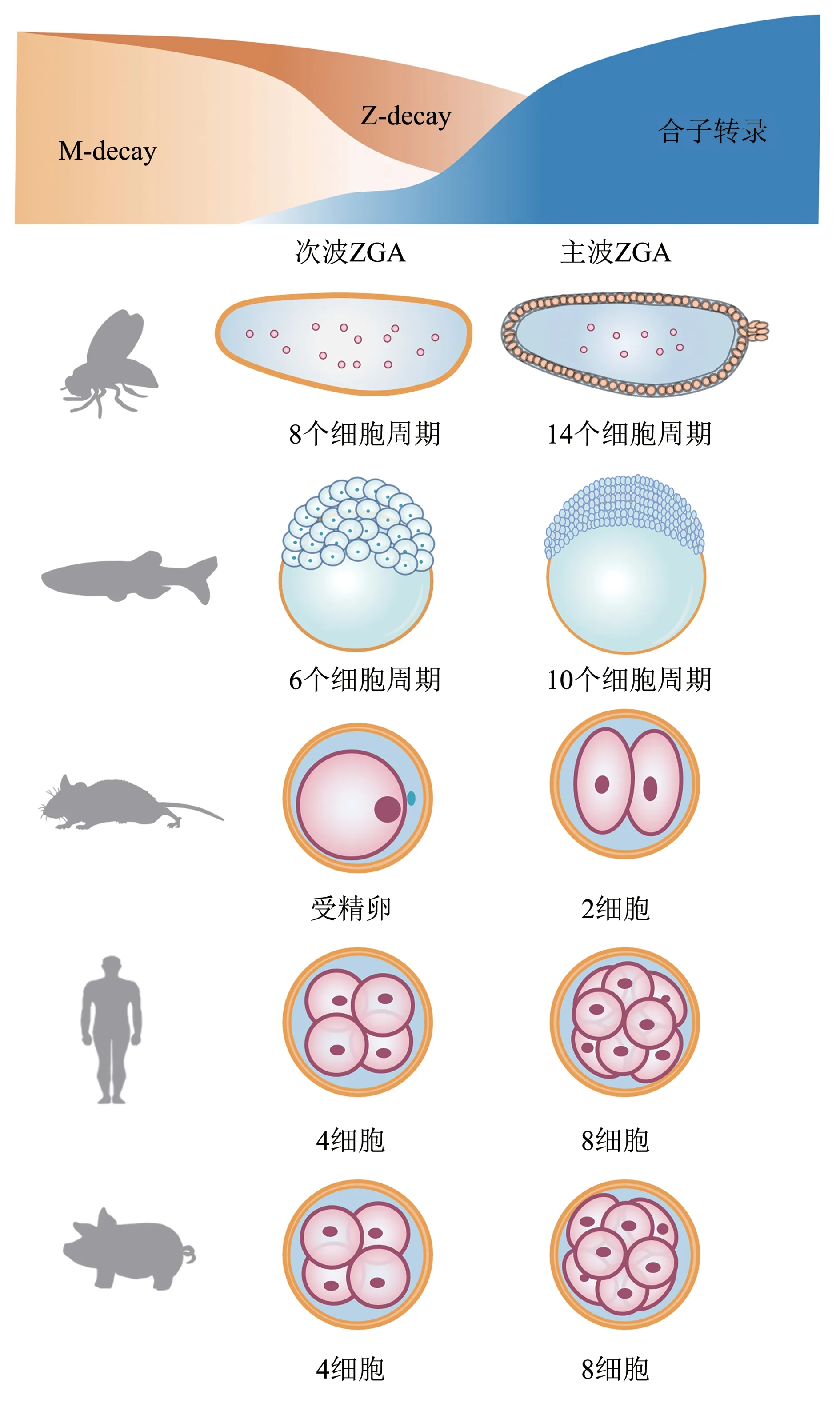
Fig. 1 Periods of minor ZGA and major ZGA in different species图1 不同物种次波ZGA和主波ZGA时期
3 ZGA相关调控因子
3.1 ZGA调控因子的物种特异性
3.1.1哺乳动物
合子基因组的转录是动物早期胚胎能够正常发育和分化所必需的,ZGA 相关因子对合子基因组的转录调控至关重要。尽管在一些物种间,ZGA调控因子触发合子基因组激活的机制,在进化上可能存在着保守性,但就以往的研究结果来看,已经被证明的ZGA 相关因子都表现出明显的物种特异性。
小鼠合子基因组激活期间受到Yap1和OTX2等多种相关因子的调控。其中Yap1在卵母细胞中高度表达,Yap1敲低的卵母细胞虽然能够正常成熟和受精,但囊胚形成受阻,ZGA 基因表达失调[47]。而OTX2 会在Dux基因座处与辅助抑制因子结合用于转录抑制,OTX2的缺失会刺激小鼠胚胎干细胞中ZGA基因的表达[48]。同时,细胞周期蛋白T2(CyclinT2)也是小鼠ZGA 的调控因子。CyclinT2 是由Ccnt2基因编码,Ccnt2的缺失和翻译的阻断都会导致小鼠胚胎在2细胞或4细胞阶段停滞,并且Ccnt2的敲低会造成接近13%的ZGA基因显著下调[3]。此外,胰岛素样生长因子2 mRNA结合蛋白2 (insulin like growth factor 2 mRNA binding protein 2,ⅠGF2BP2)对小鼠ZGA 基因的调控和激活同样至关重要。ⅠGF2BP2的缺失导致小鼠合子基因组激活过程中转录的广泛下调,破坏2细胞胚胎中的转录和翻译活性机制,最终导致早期胚胎发育停滞[49]。
陈子江团队[50]利用孤雌生殖(PG)和雄核发育(AG)胚胎证实了人类ZGA 始于父本基因组,这种现象仅在人类中被发现,在小鼠中并没有。同时又鉴定出父本激活的ZNF675,一个仅在灵长类动物中发现的新基因,对人类ZGA 至关重要。ZNF675敲低导致母源mRNA降解失败,ZGA基因激活数量显著下降。之前的研究也发现,OCT4对人类ZGA基因的表达也产生一定影响,敲低OCT4造成25%的ZGA 基因在8 细胞胚胎中显著下调。相反,小鼠2细胞阶段并没有检测到Oct4结合位点的富集,Oct4缺失几乎对小鼠ZGA 基因无影响[51]。
小鼠和人类早期胚胎发育过程中共同表达一个转录因子家族Dux/DUX4[52-56]。许多团队已经分别报道了Dux/DUX4可能是激活小鼠和人类ZGA 的关键因子,但最近的研究表明,它们在ZGA 过程中的作用其实并不突出[57]。张毅团队[58]发现,Dux在小鼠major ZGA中并不关键,并且它在小鼠胚胎发育过程中也并非必需。同年高绍荣团队[59]实验证明,Dux只是起到增强ZGA 的作用而不是启动ZGA。
ZSCAN4是哺乳动物ZGA期间特异性表达的基因,对ZGA的启动发挥作用[60]。小鼠早期胚胎中Zscan4的表达仅限于2细胞晚期。仅仅降低Zscan4的转录就会造成2细胞~4细胞阶段的胚胎发育水平延迟,囊胚形成异常无法正常植入[61]。ZSCAN4在人类胚胎的8 细胞期前后高度表达,同时伴随着major ZGA 的发生[62]。相比之下,在牛早期胚胎发育中,ZSCAN4的表达水平从卵母细胞到4 细胞时期一直相对较低,在8细胞时开始从头合成,16细胞时处于较高水平,但在桑椹胚阶段开始逐渐下降至较低水平。敲低ZSCAN4会造成牛16 细胞胚胎的发育能力降低,胚胎发育受到严重抑制[35]。
3.1.2其他动物
在果蝇中,最早被发现的ZGA 调控因子是Zelda,其会与数千个顺式调控区域进行结合,影响着基因组的染色质可及性并增强了其他ZGA 相关因子对DNA的占据。Zelda的缺失会严重导致果蝇胚胎ZGA激活失败并最终致死[63-64]。Zelda优先调控最早转录基因的表达,而在major ZGA期间激活的基因则主要依赖于GAGA 因子(GAGA factor,GAF)。GAF 可与Zelda 协同作用驱动ZGA发生,同时也具有独立于Zelda 的额外功能。GAF调控着ZGA 期间数百个位点的染色质可及性,缺乏GAF 的启动子,可及性区域严重减少[65]。此外,CLAMP也是果蝇ZGA过程中的主要参与者之一。CLAMP 既可以直接激活靶基因的合子转录,又会与GAF 和Zelda 发生相互影响,调控彼此对DNA的占据,促进合子基因组激活[66]。这进一步表明,Zelda、GAF 和CLAMP 在果蝇合子基因组激活中的协同调控作用。
Nanog、SoxB1 和Pou5f3 是斑马鱼中尤为关键的ZGA 激活因子,增强了超过74%的minor ZGA基因的转录激活,这些因子的缺失会导致合子基因表达的全局抑制,原肠胚形成和发育的完全阻断[67]。研究表明,斑马鱼中Nanog、SoxB1 和Pou5f3 能够调控染色质可及性以促进ZGA 基因转录。三者可以独立打开染色质区域,但受浓度依赖性影响,因子的浓度越高,开放染色质区域的数量就越多。三者也可以冗余地进行调控,两种或三种因子共同影响区域的染色质可及性[67-68]。Nanog、SoxB1和Pou5f3会重塑高核小体亲和力区域(high nucleosome affinity regions,HNARs)的染色质状态。ZGA 之前,Pou5f3 和Nanog 会非特异性破坏HNARs 中心核小体的稳定性减少核小体占据。ZGA 后期Nanog 会结合到HNARs 的中心,Pou5f3稳定侧翼。三者特异性协同作用维持HNARs 上开放染色质状态[69]。
尽管在许多物种中已经识别出一些ZGA 相关的调控因子,有助于深入探索合子基因组激活的潜在机制,但目前所发现的ZGA 调控因子很少能在其他物种中找到或发现其同源物,物种特异性明显。对于同一因子调控ZGA 的机制,是否在不同物种中均具有普适性,也需要进一步研究。
3.2 ZGA调控因子结合位点的序列特征
许多研究结果表明,ZGA 基因可能受到多种相关因子的调节。而这些调控因子通过靶向结合特定的DNA 序列发挥作用。近年来关于合子基因组激活的研究中,国内外的很多研究者都认为ZGA转录因子的模体(motif)可能存在于ZGA 基因的远端顺式调控区域上且对ZGA影响极大。
有研究发现,在斑马鱼中囊胚转换期(midblastula transition,MBT) 的胚胎中,Pou5f1 和SoxB1 结合位点倾向于共定位,相邻的Sox(CATTGTA)和Pou(ATGCAAAT)组成Sox-Pou复合位点,并被证明与ZGA密切相关。在ZGA前期,Pou5f1会优先结合到Sox-Pou复合位点,招募RNA Pol ⅠⅠ。在ZGA后期,SoxB1也共同结合Sox-Pou位点,进而确保ZGA的稳定激活和转录的精确调控[70-72]。在果蝇中也发现在许多早期转录基因的上游顺式调控区域上,都富集了与CAGGTAG 相关的motif序列,被称为TAGteam位点。Zelda特异性结合TAGteam 位点,促进染色质开放和其他转录因子的结合,对调控早期合子基因表达至关重要[73-75]。
在人类ZGA 时期的早期胚胎中,许多major ZGA 基因附近的远端顺式调控区域上都富集了TAATCC 序列(PRD-like motif)。且motif 的数量直接影响着ZGA基因的表达情况。通过实验发现,类PRD 转录因子TPRX1/2/L 是人类ZGA 激活的关键调控因子,共同影响着人类ZGA 的发生。同时敲低TPRX1/2/L将导致约31%的ZGA 基因下调,胚胎发育和ZGA的显著缺陷[76]。同样,在小鼠中也发现一个包含6 个motif 的共有序列出现在许多ZGA 基因的上游,这个序列与SINE B1/Alu有非常高的相似性。Nr5a2的motif包含在其中,Nr5a2会结合远端增强子样区域并优先结合2细胞特异性增强子,促进染色质可及性。Nr5a2 可激活高达72%的major ZGA 基因,短暂抑制Nr5a2 会导致上千个ZGA 基因下调,2 细胞发育停滞[77]。除此之外,小鼠2细胞基因启动子上也富集了大量的Nfya特异性结合的CCAAT序列,Nfya作为一种先锋转录因子结合并打开局部染色质。实验证实,Nfya 是激活约15%的2细胞基因所必需的,Nfya的耗尽会导致染色质可及性降低和ZGA基因激活缺陷[78]。
综上,ZGA 调控因子与特定motif 的结合,从而调节靠近该motif的ZGA基因的转录。这也进一步说明,ZGA 基因在一定程度上可能存在着序列调控机制,且在不同物种中可能是保守的,但这种猜想仍需要进一步的研究证明。转录因子motif 是基因表达调控的关键影响因素,是分析和预测基因调控元件的基础。因此若能成功揭示不同物种中ZGA 调控因子结合位点的序列特征,对于进一步理解ZGA基因的激活机制同样意义重大(图2)。
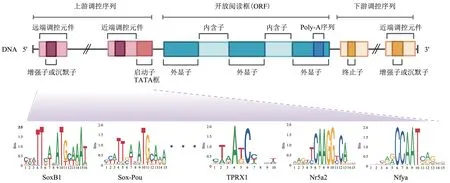
Fig. 2 Sequence specificity of ZGA-related transcription factor binding sites图2 ZGA相关转录因子结合位点的序列特征
4 ZGA的表观遗传修饰调控
4.1 DNA甲基化和去甲基化修饰
DNA 甲基化被广泛认为是哺乳动物细胞异染色质特征的抑制性标记,主要分为从头DNA 甲基化和维持DNA 甲基化。从头DNA 甲基化是在DNA 甲基转移酶3A (DNA methyltransferase 3 alpha,DNMT3A)、DNMT3B 和DNMT3L 三种酶的催化下,使未发生甲基化的DNA 双链均形成DNA 甲基化;维持DNA 甲基化则是在DNMT1 的辅助下,在复制过程中将模板链上的DNA 甲基化复制到新链上从而维持甲基化状态[79-82]。DNA 甲基化主要参与到基因组印迹、转座元件沉默、X染色体失活等多种生理过程来抑制基因的表达。甲基化的建立在配子发生和受精后发育中尤为重要[83-84]。
在小鼠中,雄性生殖细胞从头DNA 甲基化是在有丝分裂停止的精原细胞中开始形成,且在出生前完全建立。相反,雌性生殖细胞中从头甲基化直到出生后才开始。在卵母细胞中,DNA 甲基化的建立与卵泡生长期接近同步发生,并在生发泡期基本完成[79]。此外,DNA甲基化在小鼠精子和卵母细胞之间的分布差异较大,卵母细胞是高甲基化和低甲基化交替出现,而在精子中DNA 甲基化或多或少的均匀分布在整个基因组中[85-87]。
受精后到植入前,哺乳动物基因组会经历全局DNA 去甲基化,尽管在不同物种中去甲基化程度和动态变化略有差异,但这一过程仍是相对保守的。受精后父本基因组会经历一个全局范围内迅速的主动去甲基化[88-89],而母本基因组更倾向于通过在DNA 复制过程中保持新链的未甲基化状态,使甲基化DNA 不断被稀释直至去除的方式,进行被动去甲基化[90-91]。
小鼠基因组的显著去甲基过程发生在minor ZGA 阶段且父本基因组的去甲基化速度比母本基因组快得多。异常的DNA 甲基化状态会导致胚胎全能性建立的失败[91-92]。在人类中则显著表现在受精~2 细胞阶段,同样父本基因组的去甲基化快于母本基因组,但在4细胞~8细胞阶段甲基化水平发生微小的变化,表现为DNA 甲基化短暂的重新建立[92]。最近有研究表明,在猪和牛的卵母细胞中都发现了双峰形式的甲基化区域,并且高甲基化区域较多,这种情况与人类相似而与小鼠相反[93]。但总体上来看,人、鼠、牛和猪的胚胎发育到2细胞~4 细胞阶段时,DNA 甲基化均呈现不同程度的降低。不同的是,随着ZGA的进程斑马鱼中DNA甲基化却呈现很小的变化,在基因体和转座子上的变化也非常有限[94]。因此,不同物种中DNA甲基化的动态变化与ZGA 之间是否存在潜在的调控关系仍需要进一步实验证明[95](图3)。
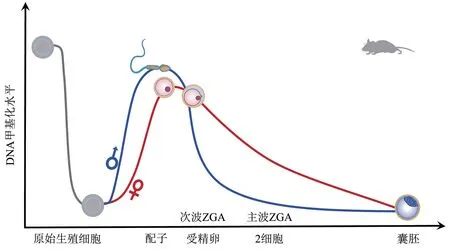
Fig. 3 DNA methylation changes during mouse development图3 小鼠发育过程中DNA甲基化变化
4.2 组蛋白修饰
H2A、H2B、H3 和H4 各一对构成组蛋白八聚体,DNA 缠绕在八聚体上构成染色质的基本组成单位核小体,核小体再进一步螺旋形成更高级的结构。多种修饰酶会与核心组蛋白的末端残基发生共价修饰,形成组蛋白乙酰化、甲基化、磷酸化、泛素化等翻译后修饰[96]。其主要改变了组蛋白内部的电荷情况,使DNA 的可结合程度受到影响,进而调控基因的表达[83,97]。组蛋白甲基化和乙酰化在影响ZGA发生的表观遗传调控中被广泛研究。
4.2.1组蛋白甲基化修饰
组蛋白甲基转移酶催化介导组蛋白甲基化的发生。主要在H3K4、H3K27、H3K9、H3K36等赖氨酸甲基化修饰位点。H3K4me3 主要富集于基因的启动子上,促进基因的表达[98]。在许多哺乳动物的体细胞中H3K4me3 主要以“窄峰”的经典模式富集,但却以“宽峰”的非经典模式(noncanonical H3K4me3,ncH3K4me3)分布在成熟卵母细胞中,且ncH3K4me3 是被逐渐建立起来。与经典H3K4me3 的作用相反,ncH3K4me3 可能与卵母细胞的基因沉默相关[98-99]。在人类卵母细胞中并没有发现ncH3K4me3,而在其他哺乳动中则是相对保守的,并且ZGA 后会转变为经典模式。这种H3K4me3 的非经典到经典模式的正确转换,对于合子基因组激活和早期胚胎发育必不可少[100-102]。
小鼠中H3K4me3 是高度动态变化的,并且与基因表达水平呈正相关[101]。受精后,父本基因组中的H3K4me3 会迅速耗尽,并在major ZGA 期间重新建立。相比之下,母本基因组中ncH3K4me3主要存在于部分甲基化结构域中(partially methylated domains, PMDs)。受精后ncH3K4me3会被暂时保留,在2 细胞晚期ZGA 之后,被迅速擦除,并转换为经典的H3K4me3[101,103-104]。牛的早期胚胎中也有类似的发现,一直到8 细胞阶段ncH3K4me3 都呈现明显分布,并且ncH3K4me3 与DNA 甲基化呈现负相关,几乎只发生在PMDs中[102,105]。此外,在猪卵母细胞ZGA 基因启动子上也发现了H3K4me3 的经典模式,在受精后转变为“宽峰”的非经典模式,4 细胞期后又转回为“窄峰”。在猪的受精卵中同时敲低赖氨酸去甲基化酶 5B (lysine demethylase 5B, KDM5B) 和KDM5C, 会导致ZGA 基因启动子上保留ncH3K4me3,ZGA 基因表达受阻,影响胚胎的进一步发育[106]。进一步说明了组蛋白甲基化对于哺乳动物ZGA调控的重要影响(图4)。
H3K27me3被广泛认为是一种抑制性组蛋白标记并与多梳抑制复合体2 (polycomb repressive complex,PRC2)相关[98,107]。在小鼠的卵母细胞中也发现了非经典的H3K27me3结构域,主要存在于远端的基因间区域,而在受精后的发育基因启动子上几乎不富集。精子上的经典H3K27me3在受精后会被全局擦除。总体上,小鼠早期胚胎中H3K27me3 与H3K4me3 的富集水平呈现负相关态势[103]。与小鼠不同,H3K27me3 沉积在人类卵母细胞发育基因启动子上和PMDs 中。在人类ZGA之前,H3K27me3会经历全局耗尽,父本等位基因组可能显示出更快的耗尽速度,但在桑椹胚期会重新建立[98,108]。非经典的H3K27me3 结构域在猪的早期胚胎中也被观察到,且受精后被完全去除,随后在桑椹胚中重新建立H3K4me3/H3K27me3 二价结构域。实验表明,阻断H3K27me3的重建会导致ZGA 基因在猪囊胚期的表达异常升高,这表明启动子的二价性标记有助于猪胚胎ZGA的退出[106]。
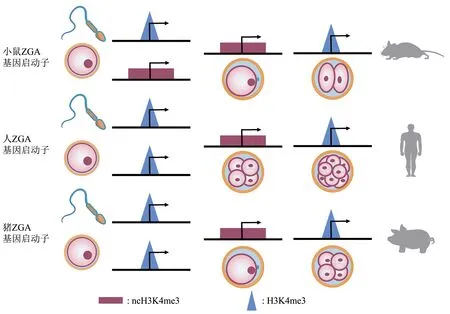
Fig. 4 H3K4me3 changes around the ZGA gene promoter in mice,humans and pigs图4 小鼠、人和猪ZGA基因启动子附近H3K4me3变化
H3K9me3 在小鼠胚胎中是第一个被证明阻止MZT 发生的表观遗传修饰障碍。H3K9me3 水平在小鼠ZGA过程中逐渐降低且在2细胞期达到最低,之后恢复升高[100,103]。H3K9me2/3的高水平甲基化状态会严重阻碍ZGA 和早期胚胎发育。过表达H3K9去甲基化酶,能够有效促进小鼠体细胞核移植胚胎的ZGA发生并提高囊胚率[109]。同时,人类和小鼠中都发现H3K9me3 在重复序列上特异性沉积,H3K9me3 通过调控长末端重复序列(long terminal repeats,LTRs) 的正确表达进而影响ZGA。H3K9me3水平的增加与相应区域中LTRs的沉默密切相关[110-112]。此外,在斑马鱼中H3K9me3和浓缩的异染色质结构的全局建立发生在MZT 之后,需要母源物质降解和ZGA的配合[113],这也进一步证明H3K9me3与ZGA之间的密切关联。
从小鼠亲本到早期胚胎的发育过程中,H3K36me3 的动态分布在很大程度上与ZGA 的发生一致。在MⅠⅠ卵母细胞和精子中,H3K36me3 都具有很高的富集程度,但这种现象在受精卵中发生了改变。受精卵中母本H3K36me3的富集程度明显高于父本,出现了等位基因失衡。但母本H3K36me3 在2 细胞晚期发生明显减弱,8 细胞阶段丢失。相比之下,精子中的大部分H3K36me3并没有出现在受精卵中。伴随着小鼠major ZGA 发生,全局H3K36me3 在2 细胞晚期开始重新建立,并在8细胞阶段达到顶峰[86,114-115]。小鼠H3K36me3的丢失,会导致卵母细胞数量减少和DNA 甲基化异常,受精卵发育受阻以及DNA复制和ZGA发生失败[114]。
4.2.2组蛋白乙酰化修饰
组蛋白乙酰化主要在增加染色质可及性和转录激活上起作用,H3K27ac已经被广泛认为是活性增强子和启动子的标志物,与ZGA 基因的激活密切相关。在组蛋白乙酰基转移酶的作用下,组蛋白乙酰化可以使紧实的DNA 染色质结构变得疏松,促进相关转录因子的特异性结合[116]。
在小鼠卵母细胞~2 细胞之间,组蛋白乙酰化主要经历了3 个转变:GV 卵母细胞中的高乙酰化到MⅠⅠ卵母细胞中的低乙酰化,再转变到受精卵中的高乙酰化,最终在2细胞早期呈现经典乙酰化模式[117]。在小鼠中活跃的CBP/p300乙酰基转移酶对于minor ZGA 期间从头建立高乙酰化状态必不可少,并且是major ZGA基因在假定增强子处打开染色质可及性所必需的[117]。同时Brd4/p300 也通过调节斑马鱼中合子基因的组蛋白乙酰化来促进全基因组的转录能力,进而调节ZGA。这种机制对于启动合子发育具有重要意义[118]。
组蛋白乙酰化还可以与细胞代谢相互作用协同调控ZGA 发生,代谢辅助因子烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)和去乙酰化酶相互结合可以擦除受精卵中的H3K27ac,进而精确调控小鼠minor ZGA,受精卵中H3K27ac的擦除失败可能会导致RNA Pol ⅠⅠ的持续启动,并诱导minor ZGA基因的延长表达。最近有研究表明,在果蝇中H4K16ac 广泛存在于成熟卵母细胞中,并且持续传递给下一代。在major ZGA之前,H4K16ac富集在基因的启动子和雄性X染色体上,促进染色质开放,从而调控ZGA 和剂量补偿效应[119]。
4.2.3组蛋白二价性修饰
单独的组蛋白修饰影响基因的表达,二价性修饰的存在也起着至关重要的作用。小鼠中,H3K4me3/H3K27me3 会共同出现在胚胎干细胞中低表达的转录因子启动子处,使基因处于一种静息(poise) 状态,并且当同时存在H3K4me1 与H3K27ac 时,基因转录活性较高,而H3K4me1 与H3K27me3共存时,基因转录活性明显降低[120-124]。同时,在人类囊胚中也观察到H3K4me3/H3K9me3和H3K4me3/H3K27me3 的二价结构域,为谱系分化做准备。这种二价性修饰在其他动物中也普遍存在,如在鸟类、斑马鱼和牛中都发现了二价性启动子[107]。 赖氨酸甲基转移酶 2B (lysine methyltransferase 2B,KMT2B)是活跃于二价启动子上的主要甲基转移酶。它主要负责二价基因上的H3K4me3沉积。PRC2可以单甲基化、二甲基化和三甲基化H3K27。PRC2 也会与PRC1 密切合作,PRC1 介导H2AK119ub1 沉积和PRC2 介导H3K27me3沉积,共同形成基因抑制区域。许多二价结构域都与H2AK119ub1共同标记,高达约40%的二价结构域与PRC1结合[124-125]。H2AK119ub1的缺失会导致ZGA 基因的过早激活和早期胚胎发育停滞[126]。
4.3 组蛋白变体
组蛋白变体及其修饰一般通过改变核小体的动态变化来参与染色质事件的特定调节[127-128],它们通过不同的分子伴侣组装成核小体并与各种染色质重塑复合物相互作用,从而在发育和细胞分化过程中取代经典组蛋白或在各种变体之间进行替代[129]。由于组蛋白变体的引入而产生的结构性差异,可以影响组蛋白之间的相互作用,导致核小体稳定性和染色质可及性异常[130-131]。
组蛋白变体H1 通过调控染色质结构来改变H3K27me3 和H3K36me2 的富集程度,从而影响基因表达的机制[132-133]。组蛋白变体H3.3也被认为是早期胚胎发育所必需的,其在受精后会立即富集到父本基因组中[134-135]。同时在小鼠胚胎干细胞中H2A.X 的缺失会导致ZGA 基因的显著上调和转座子的错误调节。当ZGA 基因和转座子都处于活跃状态时,人类早期胚胎中的H2A.X 则会高度富集[136]。
组蛋白变体H2A.Z 是最古老的组蛋白之一,从酵母到哺乳动物中都存在[131,137]。有研究表明,高达65%的活性ZGA基因与H2A.Z相关。小鼠中,H2A.Z在母本基因组上无明显的积累,而父本基因组上富集的H2A.Z 也会在受精后被显著擦除,随后在ZGA 期间的亲本基因组上无偏向性的积累。小鼠发育基因启动子上的H2A.Z 呈现出不同峰的类型。具有双H2A.Z 峰的启动子会与H3K4me3 结合促进转录激活;单H2A.Z 峰更有可能结合二价标记(H3K4me3/H3K27me3)并抑制发育基因表达;无H2A.Z 积累的启动子则表现出持续的基因沉默。有趣的是,其他研究发现,H2A.Z 在ZGA期间的人、猪、牛、大鼠、猴和山羊的胚胎中也具有相似的转录激活特征。这强烈表明H2A.Z 在哺乳动物早期胚胎中的保守作用[131](图5,6)。
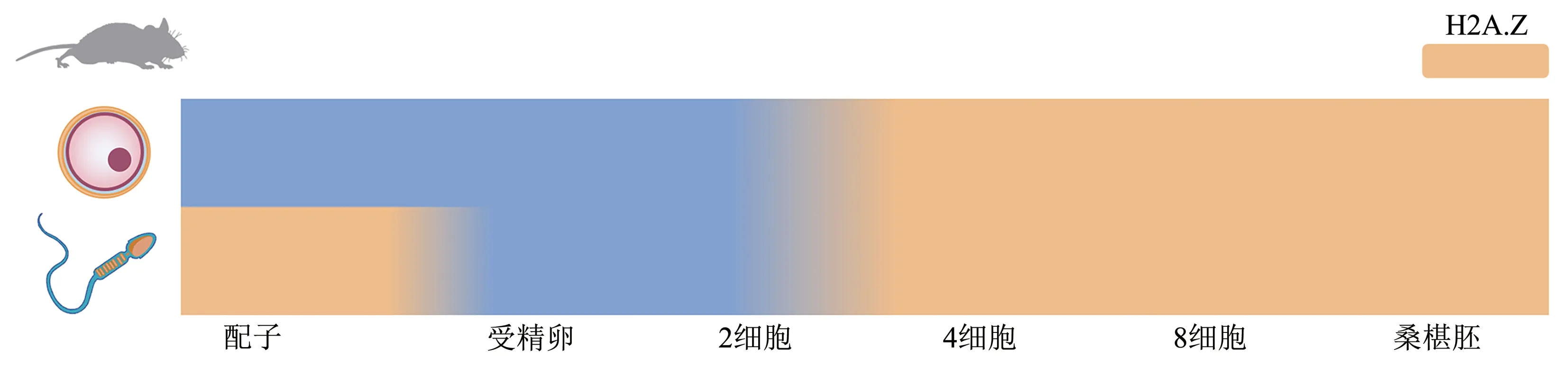
Fig. 5 Accumulation of H2A.Z in mouse gametes and early embryos图5 小鼠配子和早期胚胎中H2A.Z的积累

Fig. 6 Effects of accumulation of different types of H2A.Z peaks on gene expression图6 不同类型的H2A.Z积累对基因表达的影响
5 ZGA与染色质重塑
5.1 染色质高级结构
染色质经过高度复杂的折叠,形成染色质高级结构分布于细胞核的不同区域。染色质高级结构主要包括拓扑关联结构域(topologically associating domains,TADs)、A/B 区室(A/B compartment)和染色质环(chromatin loops)等[27,138]。其在调控增强子-启动子互作和基因表达上起着重要作用。
染色质高级结构在成熟精子中可能具有高度的物种特异性。例如,存在于小鼠精子中的TADs,在非洲爪蟾、斑马鱼和人类精子中并没有被发现[139-142]。A/B 区室可以在斑马鱼、小鼠和人类精子中被检测到,但在非洲爪蟾中却没有被发现[140-142]。同样,卵母细胞中存在的染色质高级结构,不同发育时期也各不相同。在小鼠完全生长的初级卵母细胞中(full-grown oocytes,FGOs),TADs 和染色质环都存在,却没有发现传统的染色质区室,取而代之的是一种polycomb 关联结构域(polycomb-associating domains,PADs)[143-144]。随着FGOs 发育到MⅠⅠ卵母细胞时,TADs、PADs 以及A/B区室却都发生了消失[142,145]。
与配子阶段表现的差异相反,染色质高级结构在不同物种的早期胚胎发育过程中,似乎呈现一种保守状态,即染色质高级结构的重新建立。小鼠受精后,TADs 和A/B 区室信号都呈现高度弱化[143],父本等位基因比母本显示出更强的区室信号,且这种情况一直持续到8 细胞阶段[145]。而在人类和猪ZGA发生前的胚胎中,TADs和A/B区室都没有被发现,直到桑椹胚时期才检测到清晰的信号[141,146]。类似的,许多研究表明果蝇、斑马鱼和非洲爪蟾也在ZGA时期重新建立了TADs和A/B区室[139-140,147]。以上结果暗示着染色质高级结构的动态变化与ZGA 之间可能存在着潜在的调控关系[27]。但有趣的是,在小鼠、果蝇和非洲爪蟾中,ZGA被证明对全局建立TADs和染色质区室并不是必需的[139-140,142,147]。因此,染色质高级结构与ZGA 之间是否存在关联以及可能的调控机制仍需要进一步研究证明。
5.2 染色质可及性和转座子
染色质可及性在建立和维持细胞身份方面起着至关重要的作用,它与增强子、启动子和染色质结合因子等形成一个相互作用网络来协同调控基因表达。哺乳动物早期胚胎发育过程中,染色质可及性呈现高度动态变化[148]。在人类中,精子的开放染色质区域数量相对较高,而卵母细胞的染色质几乎不开放或开放程度很低。受精卵时期出现了染色质的短暂开放,可及性的正式建立从2 细胞逐渐开始,且在8 细胞和桑椹胚时期(人major ZGA 附近)达到顶峰[149-150]。牛卵母细胞和早期胚胎的染色质可及性呈现出与人类相似的动态模式。大体可表现为4 个方面:a. 卵母细胞、2 细胞~4 细胞阶段的低染色质可及性;b. 8 细胞~桑椹胚阶段(牛major ZGA附近)的高染色质可及性;c. 囊胚时期的低染色质可及性;d. 囊胚期之后更高的染色质可及性[36]。人类和牛的染色质可及性存在许多共同特征,如ZGA 时期的染色质可及性和基因表达之间显著相关,而DNA 甲基化与启动子上的染色质可及性则呈现负相关[36,78,149-150]。这可能暗示着,人类和牛ZGA 期间染色质可及性转变存在着保守机制,染色质可及性的建立为ZGA 的发生奠定了基础。
许多研究表明,染色质可及性与转座子密切相关,多种类型的转座子在植入前胚胎的开放染色质区域显著富集且高度转录。转座子可以为转录因子提供结合位点,在一定程上起到增强子和启动子的作用,并有助于构建染色质三维结构[151-153]。在人类中,LTRs 和短散在核元件(short interspersed nuclear elements,SⅠNEs)尤其是灵长类动物特有的Alu,在8细胞ZGA时期的远端开放染色质区域高度富集,内源性逆转录病毒(endogenous retroviruses,ERVs)K 和SVA(SⅠNE-VNTR-Alu,一种人类特有的ERV和Alu复合转座子)也在8细胞和ⅠCM 阶段得到富集且后续的表达量较高[150]。与人类相似的,LTRs、SⅠNEs 和长散在核元件(long interspersed nuclear elements,LⅠNEs)也在牛8细胞ZGA时期富集于开放染色质区域[36]。同样,小鼠2细胞时期相比于其他早期发育阶段也含有数量最多的转座子,且小鼠内源性逆转录病毒L(murine endogenous retrovirus-L,MERVL)附近具有范围最大的开放染色质区域(高达117 kb)[153-155]。
从以上3个物种的研究中不难发现,转座子的富集与表达、染色质可及性的转变和ZGA 的发生时期存在一个明显的重叠,这可能表明三者之间潜在的调控关系。最近的研究发现,MERVL 对小鼠ZGA和早期胚胎发育可能存在着重要影响[153]。敲低MERVL 导致2 细胞时期大量基因显著下调,开放染色质区域明显减少,造成ZGA 缺陷,并在囊胚形成前出现发育迟缓或停止发育的情况[28]。同样,小鼠2细胞中LⅠNE1的表达也起到了促进染色质可及性增加的作用,并且LⅠNE1 在ZGA 后的耗尽也是胚胎发育的先决条件。但值得注意的是,LⅠNE1的转录激活似乎主要影响染色质结构,合子基因表达并没有发生明显变化[156]。因此,转座子对合子基因组激活的影响仍需要进一步研究。
6 ZGA与非编码RNA
有研究发现,在发生转录的基因中,仅有1.5%的碱基序列具有编码蛋白质的能力。这是由于DNA 转录过程中产生了大量的非编码RNA(noncoding RNA,ncRNA)。近年来许多证据表明,ncRNA 在生殖细胞形成和胚胎发育过程中作用重大。
6.1 微RNA
微RNA(microRNA,miRNA)是一种小型的非编码RNA,只有大概19~22个核苷酸的长度,占所有脊椎动物基因组的1%~3%,但它的功能和作用机制依然有很大空白。miRNA 主要在母源物质的合子降解途径中发挥作用。在斑马鱼的ZGA 期间,miR-430初级转录本大量表达。miR-430是斑马鱼中第一个已知的表达基因,也是早期发育过程中表达最丰富的miRNA 家族,调控着斑马鱼中许多母源因子转录[157],miR-430基因的激活需要Pou5f3、SoxB1 和Nanog 的参与,这些因子通过激活miR-430的表达进一步清除母源物质并调节ZGA发生。miR-430的缺失会导致斑马鱼中数以百计的母源mRNA无法及时降解[68,158],合子基因组不能完全激活,这表明miR-430不仅是母源RNA 清除所必需的,而且对于ZGA至关重要[159-161]。但有研究发现,斑马鱼中miR-430的转录本并不是所有minor ZGA基因激活所必需的[161]。
6.2 长链非编码RNA
长链非编码RNA (long non-coding RNA,lncRNA)是一种长度在200~500 个核苷酸范围内的非编码转录本。因缺少有效的开放阅读框,所以很少编码或不能编码蛋白质[162-163]。许多lncRNA比蛋白质编码基因序列进化得更快,具有细胞类型特异性。一些lncRNA会与组蛋白修饰复合物互作影响发育基因的表达[162,164]。
在人类早期胚胎中,lncRNA 比蛋白质编码基因表现出更强的时间特异性,并且这种差异在小鼠中更为明显。一些关键的lncRNA 会参与到人类ZGA当中,起着核小体组装和染色质组装的作用。有研究发现,人类和小鼠major ZGA 时期富集的lncRNA 呈现显著重叠,这也说明了参与ZGA 的lncRNA 网络在人类和小鼠早期胚胎之间的保守性[162,165]。在猪的4 细胞~8 细胞期间也发现了lncRNAXLOC_126976的富集,其可能发挥着调控因子的作用,介导着MZT的发生,lncRNAXLOC_126976的敲低造成了囊胚形成率显着降低[164,166]。同样,lncRNA与山羊早期胚胎的发育也密切相关。lnc_137敲低的胚胎,在8 细胞阶段发现许多山羊ZGA 期间表达的基因发生了显著下调,同时部分母源基因表达却有所升高,最终导致胚胎发育停滞[167]。这也进一步表明ncRNA 对于哺乳动物ZGA的发生至关重要。
7 ZGA发生的时间模型
斑马鱼和果蝇等非哺乳动物早期胚胎发育经历快速的细胞分裂,在此期间细胞周期被重塑。随着逐渐减慢并进入暂停的细胞周期,中囊胚转换发生[168]。许多研究认为,细胞周期与DNA 含量有关,即核质比(nucleocytoplasmic ratio,N∶C)[11,169]。虽然核DNA 含量在每个周期都精确地翻倍,且细胞质保持不变,但N∶C的比例是逐步增加的,这使得母源转录抑制因子浓度逐渐被稀释,在达到一个阈值后,N∶C比可能会触发ZGA以及后续的发育事件[2,9,14]。在非洲爪蟾和斑马鱼中,实验诱导N∶C比的变化导致中囊胚转换时间相应的提前或延迟[170]。ZGA的发生是细胞周期重塑和中囊胚转换的关键影响因素,ZGA 与细胞周期之间可能存在着协调互作的影响。
转录本积累量的多少取决于转录窗口的持续时间,细胞周期的改变会导致爪蟾、斑马鱼和果蝇ZGA时间发生相应的变化[171-172]。研究表明,如果细胞周期被人为暂停,大多数果蝇的ZGA 基因可以提前一个或两个细胞周期被激活[173]。另一方面,ZGA 被认为是细胞周期减慢的上游因素。在果蝇中,过早激活转录会导致细胞周期减慢提前发生[174-175]。同时,N∶C 比会影响细胞周期长度和转录窗口的长度,导致果蝇中某些基因的激活提前或延迟。但目前仍不清楚细胞周期的改变是如何影响转录起始的。已被证实的是,细胞周期长度以及N∶C比会影响胚胎中产生的转录本的长度、数量和速率[169]。
除了细胞周期以及N∶C以外,另一种“母系时钟”模型也可能调控着ZGA 的发生[2,14]。在斑马鱼早期胚胎发育的过程中,会发生一系列的生物化学级联反应,这使得母源存在的转录激活因子可以不断地被积累,当积累到一定的阈值时会激活下游的ZGA。同时也进一步说明了,为什么在受精后,ZGA 不会立刻被激活,而是需要经过一定的发育时期。但目前这种模型机制是否适用于所有物种 当 中 , 仍 需 要 进 一 步 的 实 验 研究[7,9,176-177](图7)。
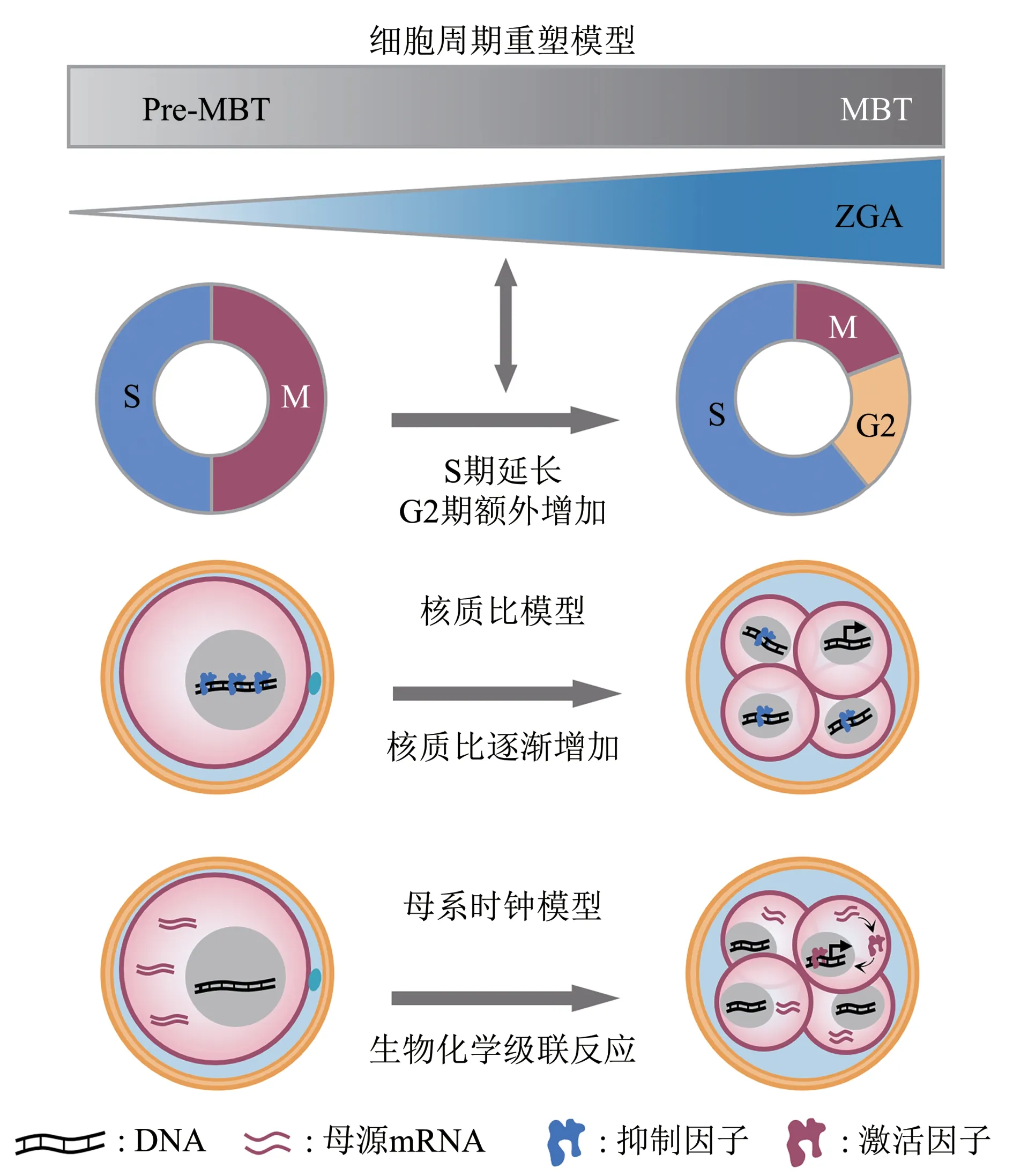
Fig. 7 Mechanisms of ZGA occurrence in different timing models图7 不同时间模型中ZGA发生的机制
8 展望
受精后的转录沉默过程中,表观遗传发生了剧烈的变化,基因组被重新编程,这为早期胚胎的进一步定向分化做了准备。从转录沉默到广泛的基因表达的转变需要精确的调控。ZGA 则是启动所有多细胞生物合子基因组调控的关键一步。表观遗传修饰和ZGA 相关因子对合子基因组激活的影响尤为重要。随着高通量和单细胞等技术的飞速发展,研究者们对植入前胚胎发育过程中合子基因组激活有了更加深层次的理解,但仍有很多问题尚未解决。特别是在不同物种中,表观遗传因素与ZGA之间的相关性和具体的调控机制方面,且MZT、ZGA 和细胞周期调控还没有统一的模型阐述。另外,不同物种中主要的ZGA 激活因子和抑制因子仍知之甚少,其中的差异性和物种特异性也不太清楚。ZGA 相关因子结合位点的序列特征也影响着基因的表达,这也暗示着ZGA 基因潜在的序列调控机制。同时,染色质重塑和转座子与ZGA 之间的关联也存在着大部分的空白,需要进一步的实验探究。因此,深入研究表观遗传修饰、ZGA 相关因子等调控因素与ZGA 基因之间的关系,探索ZGA 基因中的序列调控机制,将有助于更深一步揭示早期胚胎合子基因组激活的奥秘。这也将为研究细胞命运转变和早期胚胎调控机制提供更加坚实的理论依据。
