邻苯二甲酸二(2-乙基己基)酯对睾丸的毒性作用及机制*
2024-03-23冯安妮孙任任肖玉波曾昭明莫中成1谢远杰1
冯安妮 孙任任 肖玉波 曾昭明 莫中成1, 谢远杰1,**
(1)桂林医学院基础医学院组织学与胚胎学教研室,桂林 541199;2)湖南医药学院公共卫生与检验医学院,怀化 418000;3)桂林医学院-明舜制药慢性病防治研究联合实验室,邵东 422800)
邻苯二甲酸二(2-乙基己基)酯(di-(2-ethylhexyl)phthalate,DEHP),又名邻苯二甲酸双(2-乙基己基)酯,属于邻苯二甲酸酯类化合物,其分子式为C24H38O4,是一种无色有轻微气味的油状液体,具有较强的疏水性和脂溶性。DEHP常作为聚氯乙烯等塑料制品的增塑剂,广泛存在于各类生活物品中,如儿童玩具、电子医疗设备、化妆品和食品包装材料等,同时还被添加到瓷砖、墙纸、电缆保护剂等建筑装修材料中,是常见的环境污染物之一[1]。DEHP与塑料基质之间以不牢固的氢键和范德华力连接,在日常生活中,塑料制品常被反复使用、加热和/或清洗,使得DEHP极易从产品渗出,从而暴露于环境中。除了生活接触塑料制品外,自然环境中还存在着许多塑料垃圾,长期污染着河流、海洋、土壤等,导致DEHP无处不在。
DEHP可通过呼吸道、消化道、皮肤接触等多种方式被人体吸收,进入机体后水解为邻苯二甲酸单(2-乙基己基)酯(mono-(2-ethylhexyl)phthalate,MEHP),并在人体长期积蓄,导致多系统性毒性效应[2]。DEHP可作为内分泌干扰物直接影响生殖系统,还可穿透胎盘屏障或进入母乳,对子代生殖系统造成损伤,有毒理学研究表明,宫内暴露DEHP可能导致男性后代生殖障碍,引起生殖系统畸形[3]。鉴于DEHP 对生殖功能和生殖发育的毒性,欧洲化学品管理局已将其归类为生殖毒性物质。随着塑料制品的广泛使用,环境塑料垃圾的不断增加,越来越多研究者开始聚焦于DEHP对男性生殖毒性的研究,发现睾丸是DEHP产生生殖毒性作用的重要靶器官。近年来国内外相关研究较多,但有关DEHP的睾丸毒性作用的分子机制仍未阐述清楚,本文从睾丸病理损伤、生殖细胞毒性以及表观遗传效应三个方面,综述目前DEHP对睾丸生精细胞、间质细胞以及支持细胞的损害及其分子机制的相关进展,拟为男性生殖障碍的防治研究提供新思路。
1 DEHP对睾丸的病理损伤
DEHP暴露所引起的睾丸病理损伤,常表现为睾丸组织中凋亡标志物和自噬蛋白增加、精子质量下降以及睾丸结构异常[4],且受不同时期、不同浓度DEHP 暴露的影响。Yang 等[5]研究表明,在性成熟关键时期将雄性SD 大鼠连续暴露于不同剂量的DEHP,可引起睾丸生精上皮结构紊乱,且随着DEHP暴露时间和剂量的增加而更加明显。
妊娠期子宫内暴露于DEHP可显著增加子代雄性小鼠生精小管形态异常,延长生精小管间距,并导致内质网超微结构异常。Pan等[6]研究发现,子宫内暴露DEHP可以激活子代小鼠的未折叠蛋白反应,引起内质网应激,下调N钙黏蛋白在睾丸中的表达,从而导致生精小管萎缩和生殖细胞脱落。青春期大鼠暴露于DEHP 可导致未成熟睾丸损伤,Han 等[7]通过体视学分析显示,大部分睾丸体积缩小,特别是生精小管和生精上皮体积显著减小,生精细胞大量减少,结构损伤明显,病理损伤表现为生殖细胞破裂、细胞质空泡化、塌陷、多核巨细胞形成、染色质溶解,细胞核固缩等。成年大鼠暴露于DEHP,对睾丸重量、生精小管管腔平均横截面积、生精细胞数、间质细胞数、输精管直径、输精管上皮细胞高度等均有显著影响[8]。
DEHP对睾丸的病理损伤还表现在与不同增塑剂的联合效应,当DEHP与双酚A同时暴露,会引起雄性大鼠睾丸结构病理损伤加重[9]。当然DEHP还可以通过氧化应激、增加氧自由基的形成等,导致雄性小鼠睾丸的严重组织病理损伤[10]。由此可见,DEHP诱导的睾丸病理损伤作用明显,探究其毒性及作用机制已成为男性生殖障碍防治的关键。
2 DEHP对生精细胞的毒性与作用机制
根据毒理学和流行病学调查发现,DEHP具有类似雌激素作用[11],在动物体内可充当雌激素参与内分泌代谢,导致生精障碍。精子发生是精原细胞经过增殖分化,最后形成精子的过程,包括精原细胞的更新分化、精母细胞的成熟分裂和精子形成三个阶段。生精细胞包括精原细胞、初级精母细胞、次级精母细胞、精子细胞和精子。由DEHP暴露引起的生精细胞毒性作用,会伴随暴露剂量的增加,毒性效应也越强,常表现为生精细胞数量减少、精子活力和前向运动能力的降低以及精子DNA损伤等[12]。
2.1 诱导氧化应激、调控细胞自噬,促进生精细胞凋亡
氧化应激是诱导生精细胞损伤的核心机制,生精细胞与其他体细胞相比,由于特殊的结构和组成成分更易受到氧化应激的影响。在氧化应激条件下,过量的活性氧(reactive oxygen species,ROS)会破坏细胞蛋白质、脂质和DNA,导致细胞损伤[13]。Bahrami 等[14]通过实验证实,DEHP 降低了精原细胞、初级精母细胞的数量以及精子活力和前向运动能力,并通过促进雄性小鼠睾丸的氧化/亚硝化应激和炎症反应导致睾丸损伤。细胞凋亡也是诱导生精细胞损伤的重要机制,精子发生是一个复杂的细胞增殖分化过程,有赖于细胞增殖、凋亡的平衡,而大量生精细胞凋亡阻止了精子的发生。研究发现DEHP暴露导致小鼠睾丸增殖细胞核抗原(PCNA)表达下降,并呈剂量依赖性抑制小鼠精原细胞系和小鼠精母细胞系的增殖[15],这可能与以Bax/Bcl-2 和p53 上调为特征的细胞凋亡有关(图1a)。
Gan 等[16]证实,DEHP 能显著抑制小鼠精原细胞系存活并诱导细胞凋亡,但同时发现自噬蛋白LC3-ⅠⅠ、Beclin1 和ATG5 的水平及LC3-ⅠⅠ/Ⅰ的比值增加,经抗氧化剂和自噬抑制剂处理后,可以提高细胞存活率,挽救DEHP诱导的细胞凋亡。这表明DEHP可以通过氧化应激诱导小鼠生精细胞的凋亡和自噬,而且自噬可能促进细胞的凋亡。自噬在男性生殖过程中起重要作用,是维持生精细胞内环境稳态、保障精子发生的关键,其主要功能是蛋白质、细胞器的降解和再循环。Fu等[17]发现,低浓度DEHP 可通过抑制PⅠ3K-AKT-mTOR 信号通路,激活自噬,保护青春期大鼠睾丸免受DEHP 的损伤,而高浓度DEHP 导致氧化应激过度,诱导STAT3/p53调控线粒体凋亡,抑制自噬,从而导致睾丸损伤和生殖功能障碍。Hong 等[18]发现,DEHP不仅增强氧化应激,还通过下调自噬,诱导NLRP3 炎症小体的激活,在体内和体外触发细胞焦亡(图1b)。可见自噬是把双刃剑,适度自噬促进细胞生存,过度自噬导致细胞死亡。
此外,氧化应激可以激活自噬,自噬可以清除氧化应激造成的损伤,延缓细胞死亡,但是氧化应激引起的过度自噬会促进细胞死亡。因此,在未来关于环境内分泌干扰物引起男性生殖障碍的研究中,可以重点关注氧化应激相关的细胞凋亡和自噬,研究两者之间的调控机制,以寻找可能的预防和治疗方法。
2.2 诱导内质网应激促进生精细胞凋亡
内质网是细胞内蛋白质加工的主要细胞器,环境毒物可以破坏细胞内质网的动态平衡,引起内质网应激,导致生殖毒性。Zhu 等[19]研究报道,将青春期小鼠暴露于DEHP,出现睾丸重量下降,精子数量减少,生精管内大量生精细胞凋亡,内质网分子伴侣GRP78 表达下调,内质网应激标志物p-ⅠRE1α、p-JNK和CHOP在睾丸组织中表达上调,这表明内质网应激参与DEHP 诱导生精细胞凋亡(图1c)。
2.3 阻滞生精细胞的细胞周期
DEHP可导致生精细胞发生细胞周期紊乱,研究发现,DEHP暴露可导致生精细胞的细胞周期检查点激酶1(checkpoint kinase 1,Chk1)、细胞分裂周期基因2(cell division cycle gene 2,Cdc2)、周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)表达水平下调[20]。Chk1 是调控细胞周期的重要激酶,抑制Chk1 会导致细胞周期停滞和凋亡,而抑制Cdc2、CDK2 也会导致细胞周期停滞(图1d)。
2.4 损伤精子活性
精子活力降低及DNA 损伤,也是影响雄性生殖的重要原因之一(图1e)。Liu等[15]对雄性小鼠进行DEHP灌胃35 d,发现精子数量、运动参数下降,顶体反应率、精子-卵子结合能力和囊胚形成减少,精子生育力下降,将DEHP与精子体外共孵育,发现获能精子的酪氨酸磷酸化和前向运动能力降低,p-AKT表达降低。体外暴露DEHP,其代谢物MEHP 会通过诱导精子细胞内游离钙离子浓度升高和酪氨酸磷酸化增加来影响精子功能[21]。Zhang 等[22]研究发现,DEHP 灌胃60 d 可引起雄性小鼠精子DNA损伤,精子染色质结构分析表明,精子DNA断裂指数显著增加。

Fig. 1 Mechanism of spermatogenic cytotoxicity induced by DEHP/MEHP图1 DEHP/MEHP诱导生精细胞毒性的相关机制
3 DEHP对睾丸间质细胞的毒性与作用机制
男性体内95%的雄激素来自睾丸间质细胞(leydig cell)。雄激素可以促进精子的发生和生殖器官的发育,并维持第二性征和雄性生殖功能。睾丸间质细胞膜上有黄体生成素受体,与黄体生成素结合后可以促进睾酮的合成和分泌。此外,睾丸间质细胞还可分泌雌激素、非甾体类激素和生长因子,对精子发生起调节作用。DEHP可通过干扰睾丸间质细胞类固醇激素合成,诱导氧化应激并促进睾丸间质细胞凋亡等产生生殖毒性。
3.1 干扰类固醇激素合成阻碍精子发生
睾酮是男性生殖系统中最为重要的类固醇激素,DEHP主要以干扰睾丸间质细胞合成睾酮的方式来阻碍精子发生。雄性大鼠出生后长期暴露于DEHP可引起睾酮显著降低[23]。Zhao等[24]通过体内、外实验也证实,DEHP可导致睾丸间质细胞睾酮生物合成减少,干扰精子发生过程中的睾酮与雄激素受体通路,导致生精障碍。
睾酮的合成以胆固醇为原料,而胆固醇在睾丸间质细胞中需要跨线粒体膜转运,因此类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein, STAR)在调节胆固醇从线粒体外膜转运至线粒体内膜的过程中起关键作用。Enangue Njembele 等[25]研究发现,MEHP 抑制cAMP 诱导的STAR启动子活性,并降低类固醇形成过程中电子传递所必需的铁氧还蛋白还原酶水平,通过影响胆固醇的运输和转化来抑制类固醇的生成(图2a)。当胆固醇进入线粒体后,在类固醇生成因子1(steroidogenic factor 1,SF-1)的调节下,经细胞色素P450 家族和羟基类固醇脱氢酶逐步转化为睾酮,但类固醇生成酶的表达水平受DEHP影响。研究表明,DEHP 引起睾丸间质细胞类固醇生成酶(STAR、P450scc、P45017α、3β-HSD 和17β-HSD)和核受体(SF-1、DAX1、SHP、TR4 和NUR77)水平改变[24]。Sun 等[26]经动物实验证实,DEHP处理可以诱导雄性小鼠睾丸间质细胞Cyp11a1 和Hsd3b蛋白表达水平的降低,从而影响睾酮的合成(图2b)。
甲基化是维持正常生物功能的重要机制之一,DEHP可诱导类固醇激素相关基因或调节因子的甲基化修饰,引起睾丸损伤。Yang 等[27]给予大鼠DEHP连续灌胃35 d,发现睾丸组织中Sod2、Gpx1和Igf-1的基因表达水平显著降低,且甲基化水平变化与mRNA 水平变化相似。其中胰岛素样生长因子1(insulin-like growth factor-1,ⅠGF-1)是类固醇激素的重要调节因子,睾丸间质细胞可表达高水平的ⅠGF-1 mRNA,而DEHP 通过基因甲基化修饰降低ⅠGF-1 mRNA 水平,导致生殖障碍。可见,DEHP可经多途径干扰类固醇激素的合成,引发生殖毒性。
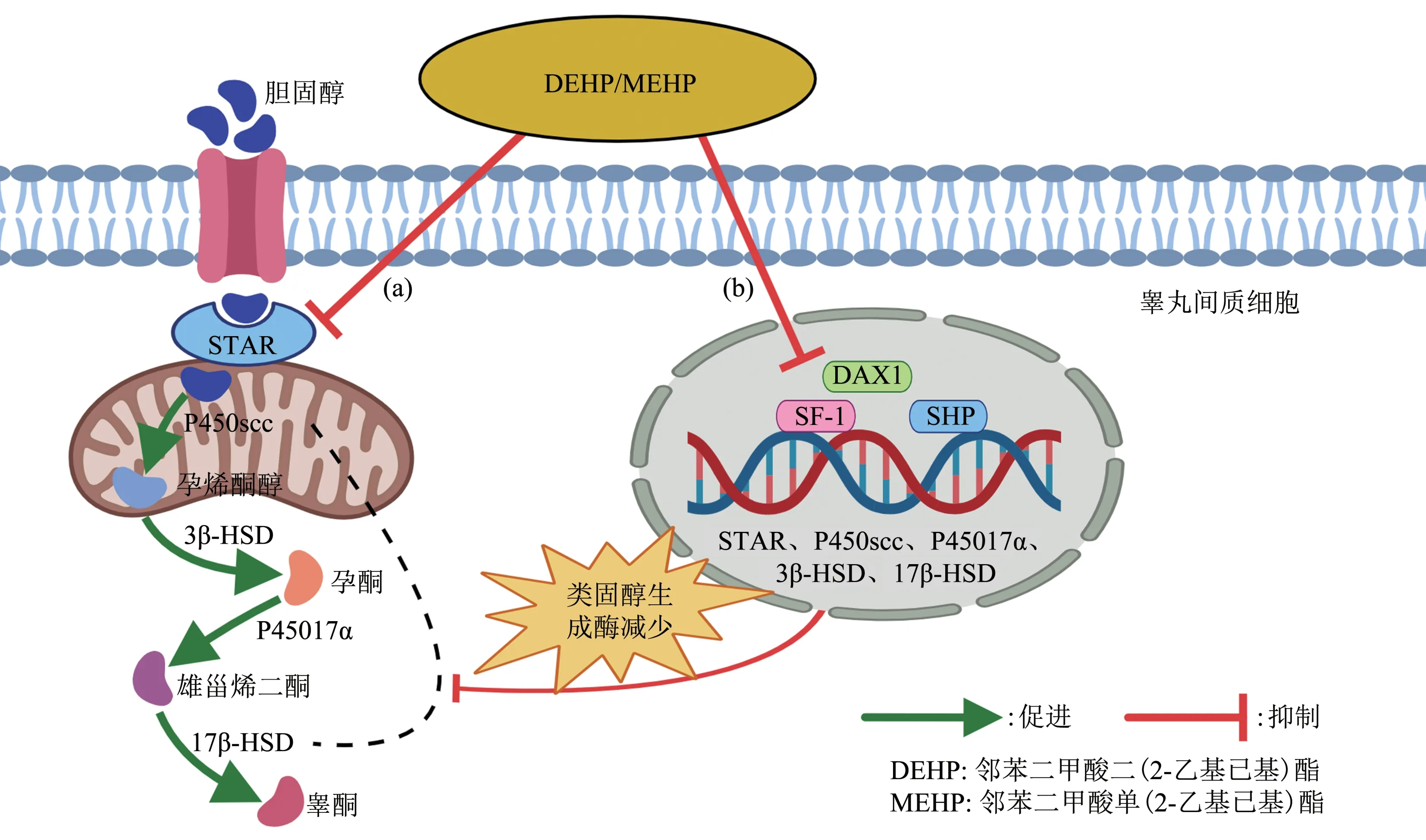
Fig. 2 DEHP/MEHP interferes with testosterone synthesis in testicular Leydig cells图2 DEHP/MEHP干扰睾丸间质细胞的睾酮合成
3.2 诱导氧化应激并促进睾丸间质细胞凋亡
核因子红细胞2 相关因子2(nuclear factorerythroid 2 related factor 2,Nrf2)是外源性有毒有害物质和氧化应激的感受器,在睾丸间质细胞中高表达,氧化应激可诱导其下游血红素加氧酶1(heme oxygenase-1,HO-1)的表达,以抵抗氧化应激并恢复细胞氧化还原平衡。对出生22~35 d 的青春前期SD 大鼠进行DEHP 灌胃处理,可显著下调其睾丸组织中Nrf2、HO-1 的表达,导致睾丸氧化损伤[28]。众所周知,Nrf2/HO-1信号通路是机体对抗氧化应激的防御机制,当Nrf2/HO-1表达被抑制,机体不能有效对抗氧化应激,易引起氧化应激相关损伤。但是Tang 等[29]实验发现,DEHP 引起睾丸氧化应激损伤,出现Nrf2 表达上调,作者认为氧化应激可能是DEHP 引起睾丸毒性的始动因素,在ROS 刺激下,Nrf2 从Keap1 中分离出来,释放到细胞质中,从而影响Nrf2 检测。当然,关于Nrf2/HO-1信号通路在环境内分泌干扰物诱导的男性生殖障碍中的作用机制还有待明确。
除了氧化应激外,DEHP/MEHP在体内、外都能诱导TM3 睾丸间质细胞的细胞周期停滞,增加细胞凋亡,同时激活p53 信号通路[30]。Yahyavy等[31]研究证实,DEHP 通过升高Bax/Bcl-2 比值,增强Caspase-3、Caspase-9活性,促进TM3细胞凋亡,而且在增强其超氧化物歧化酶和过氧化氢酶活性的同时,还提高了丙二醛含量和ROS 水平。在睾丸间质细胞中,自噬也发挥其细胞毒性作用,Sun等[32]用DEHP处理TM3细胞48 h,发现DEHP可显著抑制细胞活力,并诱导TM3 细胞凋亡和自噬。
4 DEHP对睾丸支持细胞的毒性与作用机制
睾丸支持细胞(sertoli cell)是生精小管内唯一与生精细胞直接接触的体细胞,是各级生精细胞的支架。支持细胞的主要功能是参与血-睾屏障(blood-testis barrier,BTB)形成、提供生精细胞结构支持、供给生殖细胞营养物质和吞噬作用,此外支持细胞还能合成和分泌多种物质,如雄激素结合蛋白、抑制素等。DEHP可通过破坏BTB,诱导睾丸支持细胞铁死亡而产生生殖毒性。
4.1 破坏BTB
BTB 是精子发生正常进行的物理保障,为生精细胞的发育提供一个稳定的微环境,以保证生精细胞减数分裂、变形分化过程的正常进行,以及保持遗传基因的稳定;此外,BTB 可以选择性透过生物分子,调节营养物质和水分的进出,同时还参与构造免疫屏障。睾丸支持细胞是DEHP致睾丸生殖损伤的靶细胞之一,通过抑制睾丸支持细胞增殖,破坏其结构,影响细胞间的信息传递,导致生精细胞排列紊乱,进而影响BTB 的完整性,最终导致精子发生障碍。Zhao等[33]对小鼠DEHP灌胃4周,在BTB处可见囊泡形成,周围肌动蛋白束崩解、断裂、消失,且AJ 蛋白(整合素β1、N 钙黏蛋白、E 钙黏蛋白、α 连环素、β 连环素、γ 连环素)、GJ 蛋白(Cx43)、TJ 蛋白等水平均下降,睾丸支持细胞连接出现异常,BTB 完整性被破坏,进而影响生精过程。
4.2 诱导睾丸支持细胞铁死亡
铁死亡是一种铁依赖性的、非细胞凋亡性的细胞程序性死亡方式,是由细胞内脂质ROS 生成与降解的平衡失调所致,当细胞抗氧化能力降低时,易引起脂质ROS 堆积,诱导细胞发生铁死亡[34]。通过降低抗氧化能力来积累脂质ROS,是细胞铁死亡的经典途径,但是高水平ROS也可以通过p53介导的非经典途径来促进细胞铁死亡。Yang 等[35]在动物实验中发现,MEHP 上调了p38、p-p38α、p53、p-P53、SAT1、ALOX15 的表达,经铁死亡抑制剂处理TM4 支持细胞系,发现p53、p-p53、SAT1 和ALOX15 的表达均被抑制,这表明MEHP参与了p53 介导的细胞铁死亡。MEHP 诱导p38 磷酸化,并促进p53 磷酸化,进而增强SAT1 的转录活性激活p53-SAT1-ALOX15 信号通路,最终通过脂质过氧化诱发细胞铁死亡[35],而脂质ROS 的产生反过来又可促进p38α 的表达,形成恶性循环(图3a)。
谷胱甘肽过氧化物酶(glutathione peroxidase 4,GPX4)能降解小分子过氧化物和某些脂质过氧化物,是铁死亡的核心调控蛋白,抑制GPX4的表达也是铁死亡的经典途径之一。DEHP 可通过抑制GPX4途径,导致妊娠小鼠肝功能紊乱和肝细胞铁死亡[36],因此我们推测DEHP暴露也可通过GPX4途径,引起生殖细胞铁死亡,诱导生精障碍。脂质、ROS 和铁是铁死亡涉及的三种核心代谢物,铁的代谢失调可诱发铁死亡。转铁蛋白受体(transferrin receptor,TFRC)通过与转铁蛋白相互作用,将铁从细胞外转运至细胞内,形成细胞铁池,铁池中的游离Fe2+参与Fenton 反应,生成ROS,从而诱发铁死亡[37](图3b)。DEHP可通过引起线粒体形态改变和脂质过氧化来诱导睾丸支持细胞铁死亡,当TFRC基因敲除后可通过降低线粒体和细胞内Fe2+水平来阻断铁死亡[33](图3c)。Wu等[38]研究发现,MEHP 可引起睾丸支持细胞HⅠF-1α 的积聚,并破坏其稳定性,导致HⅠF-1α 移位到细胞核内,诱导HⅠF-1α/Hmox1 结合,通过HⅠF-1α/HO-1信号通路加剧氧化应激,诱发细胞铁死亡(图3d)。通过上调GPX4 或抑制TFRC 可阻止铁死亡的发生,这为DEHP等环境内分泌干扰物诱导的男性生殖障碍提供了一种潜在的治疗策略。
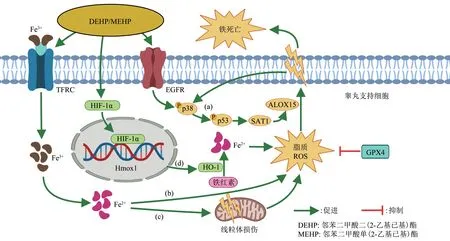
Fig. 3 Mechanism of DEHP/MEHP regulating iron metabolism and inducing ferroptosis in testicular Sertoli cells图 3 DEHP/MEHP调控睾丸支持细胞铁代谢诱导铁死亡的作用机制
5 DEHP的毒性作用具有跨代表观遗传效应
越来越多的数据表明,环境暴露可以影响精子的表观遗传学,如DNA 甲基化、组蛋白修饰、染色质结构和非编码RNA 表达的变化,影响生殖和后代的健康[39]。Hsu 等[40]在孕鼠从妊娠第0 天至出生,给予不同剂量DEHP 灌胃,经基因分析发现,DEHP (5 mg·kg-1·d-1) 组出现差异甲基化基因15 个、差异低甲基化基因130 个,DEHP(500 mg·kg-1·d-1)组出现差异甲基化基因45个、差异低甲基化基6个,这表明产前接触DEHP会引起跨代表观遗传效应。
妊娠期是精子发育的敏感窗口,此时环境毒物暴露对男性生殖细胞的表观遗传重新编程尤为敏感[39]。Oluwayiose等[41]将8周龄C57BL/6J雄性小鼠暴露于DEHP中67 d(约2个生精周期),并与未暴露的雌性小鼠交配,结果表明,暴露于DEHP的精子出现DNA甲基化,且改变了胚胎中的DNA甲基化和基因表达。DEHP毒性的表观遗传效应与氧化应激失衡有关,Zhao 等[42]研究发现,DEHP 增强了氧化应激,抑制Nrf2 介导的抗氧化途径,诱导睾丸细胞凋亡,并增加m6A RNA 修饰水平,改变RNA甲基化调节基因FTO和YTHDC2的表达。
DEHP 还会引起尿道下裂、隐睾症等发育问题,这与孕期环境暴露所引起的胚胎期睾丸发育异常有关[43]。基因表达紊乱与尿道下裂的发生有关,根据基因表达谱分析,Fos原癌基因、AP-1转录因子亚单位(c-Fos)在尿道下裂中表达上调,而这可能与DEHP 暴露有关。Xiang 等[43]在孕鼠12~19 d经口给予DEHP后,发现雄性尿道下裂仔鼠中c-Fos 表达增加。这与Yu 等[44]在文献分析中的结论一致,即接触DEHP会增加隐睾症和尿道下裂的风险。宫内和哺乳期接触DEHP可破坏睾酮和雌激素的平衡,增加前列腺癌的易感性,Xia 等[45]研究发现,DEHP 暴露引起前列腺癌相关基因GSTP1、PSCA和PTGS2转录水平的改变。宫内暴露于DEHP 也会扰乱雄性子代大鼠的下丘脑-垂体-睾丸轴功能,且会增加子代动物在成年后患甲状腺功能障碍的易感性[46]。
6 总结与展望
DEHP作为一种环境内分泌干扰物,可对啮齿类动物的雄性生殖系统造成不同程度的损伤,其中氧化应激损伤是DEHP 导致生精障碍的核心机制,DEHP暴露可引起不同类型生殖细胞的氧化应激或ROS 增多,并在此基础上促进细胞凋亡或引起细胞过度自噬等。DEHP对睾丸间质细胞类固醇激素合成的影响是其重要的生殖毒性作用机制之一,而铁死亡是睾丸支持细胞中常见的作用机制。DEHP导致基因甲基化除了影响生精过程外,也会对后代产生表观遗传效应。总之,DEHP 可通过氧化应激、干扰睾酮合成及诱发铁死亡等多种途径分别对睾丸生精细胞、间质细胞和支持细胞产生不可逆转的损伤,最终导致雄性生殖障碍,并可通过表观遗传效应影响子代生殖。
目前DEHP暴露对雄性生殖毒性的研究多局限于动物实验,人群研究和流行病学调查相对较少,鉴于DEHP在生活中广泛存在,尤其是在环境和食品中残留严重,人群不可避免会暴露其中,因此在动物实验研究的基础上开展人群研究及流行病学调查很有必要,阐明DEHP对人类睾丸的毒性作用及机制,可为避免长期接触塑料制品进而预防和减少男性生殖障碍提供理论依据。此外,生物体在DEHP暴露后,其机体的清除机制和治疗方案还有待研究,关于DEHP是否会损伤肌样细胞的功能也尚未见报道,可作为今后的探讨方向。
