研究CT不同直径测量方法对T1期肺癌大小评估中的价值
2024-03-23白维娴贾荣荣高燕军薛永杰苏林强冀笑笑
白维娴 贾荣荣 金 薇 高燕军 薛永杰 苏林强 冀笑笑
西北大学附属医院·西安市第三医院医学影像科 (陕西 西安 710018)
对于直径≤5cm的肺癌,每1cm的大小差异其预后都截然不同[1],在AJCC第八版肺癌T分期中较大幅度地更新了T分期的定义,T1期肺癌分为T1a(≤1cm),T1b(>1~≤2cm),T1c(>2cm~≤3cm),T2期肺癌分为T2a(>3cm~≤4cm),T2b(>4cm~≤5cm)[2]。由此可见,准确测量肺癌大小非常重要。
既往有多篇研究报道了如何准确测量肺癌大小,如应该在肺窗上而不是纵隔窗上测量[3];对于≤30mm的实性肺腺癌,轴位长径能够比长短径平均值更准确地反映T分期[4];基于第七版肺癌分期系统,联合冠/矢状位和轴位测量能够比单纯轴位测量提高20%肺癌的T分期[5];以及不同的CT扫描几重建方法对结节大小测量的影响[6-8];另外,基于第八版肺癌分期系统,Ahn等[9]报道MPR测量比轴位测量更准确,然而,作者的研究对象只纳入了T1期亚实性结节。
由于病理上T分期是根据肺癌标本最大直径的测量结果划分的,所以理论上肿瘤的三维最大直径能够最真实反映病理大小。然而,考虑到观察者间一致性不足的问题,Fleischner协会并没有建议斜轴位/冠状位/矢状位重建以测量肿瘤三维空间最大直径,而是强调了除轴位测量肿瘤大小外,冠状位和矢状位测量同样重要[10]。
相较于轴位直径测量,肿瘤直径的MPR测量和3D测量均需要额外的时间与精力,因此,就需要小心求证这些测量方法能否比轴位测量带来更多的获益。另外,随着胸部CT体检的普及,大多数肺癌得以早期(T1期以前)发现,因此,本次研究以病理上肺癌大小为金标准,研究T1期肺癌术前CT上最佳的测量方法。
1 资料与方法
1.1 一般资料回顾性搜集我院2019年1月至2021年12月经手术病理证实的肺癌患者。
纳入标准包括:有我院术前CT,且CT与手术间时间间隔小于2周;胸部CT表现为实性结节;病理分期不超过T1期;排除标准包括:合并肺不张而又未行增强扫描,难以确定肿瘤边界;CT图像质量差(如运动伪影等);病灶在CT上显示不清。最终有72例患者中的72例肺癌纳入本次研究,其中男性32例,女性40例,患者平均年龄58.6±12.3岁。72例肺癌中腺癌49例,鳞癌14例,类癌5例,小细胞肺癌4例。
1.2 CT扫描方法所有的患者均采用西门子Somatom Definition Flash进行数据采集,仰卧位深吸气时扫描,扫描范围从胸廓入口至肺底,管电压120kV,管电流自动毫安秒,软组织算法重建,重建层厚和层间距均为1mm。按1.2mL/Kg注射造影剂,30s及50s后获得动脉期及静脉期图像。
1.3 CT直径测量由两位具有15年及8年诊断经验的放射科医师(分别记为Radiologist1〔R1〕和Radiologist2〔R2〕)在肺窗(窗宽:-500HU,窗位:1500HU)上对肿瘤大小进行独立测量,两位医师均不知道病理结果,测量单位mm,保留至小数点后1位。53例患者术前行CT增强扫描,直径测量在静脉期图像上进行,余19例在平扫图像上进行。同时测量轴位/冠状位/矢状位病灶最大层面的长径,轴位直径为轴位病灶最大层面长径,MPR直径为轴位/冠状位/矢状位病灶最大层面长径中的最大者,在MPR直径测量层面,转动十字定位线寻找最大直径,即3D直径。
1.4 病理分析所有病理标本均在福尔马林液中固定,并沿肿瘤最大层面切开,然后测量肿瘤最大径作为此次研究的金标准,根据最大直径报告T分期。
1.5 统计分析轴位直径,MPR直径,3D直径和病理直径之间的差异用配对样本t检验或Wilcoxon's检验检测。不同测量方法所得结果在观察者1和2之间的一致性,以及同一观察者用不同测量方法所得结果跟病理大小一致性之间用同类相关系数(intraclass correlation coefficients,ICC)和Βlant-Altman指数(Β-A index)比较,ICC值小于0.5,0.5~0.75,0.75~0.9,大于0.9提示一致性较差,中等,良好,优秀[11]。为了进一步检验三种测量方法在预测T分期上的准确性,本次研究将T1a归为组A,T2b及T2c合并为组Β,CT测量所得分期大于T2c的病例亦归为组Β,不同测量方法获得的临床T分期在区分组A和组Β上准确性的差异用McNemar's检验来比较。
2 结 果
2.1 病理及CT肿瘤大小测量结果72例肺癌病理上肿瘤的平均大小为14.4±7.0mm,R1测量轴位直径,MPR直径及3D直径的大小分别为11.8±6.3mm,12.7±6.4mm,17.6±7.1mm,R2的测量值依次为11.6±6.4mm,13.4±7.1mm,18.8±7.1mm。R1和R2所测轴位直径均小于病理直径,且差异有统计学意义(P=0.023,0.017);R1和R2所测MPR直径亦小于病理直径,但差异没有统计学意义(P=0.129,0.418);R1和R2所测3D直径均大于病理直径,且差异有统计学意义(P=0.008,<0.001)。另外,R1和R2测量轴位直径,MPR直径和3D直径的差异没有统计学意义(表1)。
2.2 不同测量方法间的观察者间一致性分析轴位直径和MPR直径的观察者间一致性均达到了“优秀”(0.993 〔0.989-0.996〕和 0.992〔0.964-0.967〕),而3D直径观察者间一致性则为“良好”(0.863〔0.176-0.943〕),Β-A index提示轴位直径和MPR直径的观察者间变异程度要低于3D直径(0.2〔-1.9至2.2〕和-0.8〔-2.6至1.1〕vs 1.3〔-6.5至4.0〕)。两位观察者轴位直径和MPR直径与病理直径之间的观察者间一致性亦均达到“优秀”(R1:0.951〔0.134-0.987〕,0.967〔0.771-0.989〕;R2:0.940 〔0.207-0.983〕,0.981〔0.953-0.991〕),而3D直径与病理直径之间的一致性则为“良好”(R1:0.825〔0.002-0.875〕;R2:0.851 〔0.007-0.953〕),Β-A index提示轴位直径和MPR直径与病理直径之间的变异程度要低于3D直径与病理直径之间的变异程度(R1:2.5〔-0.5至5.6〕和1.7〔-1.7至5.1〕 vs -3.2〔-7.6至1.2〕;R2:2.7〔-1.0至6.5〕和1.0〔-2.3至4.2〕vs -4.5〔-11.0至2.1〕)。(详见表2及图1)。

图1A-图1I Bland-Altman分析显示不同测量直径在不同观察者间的关系及不同测量直径与病理直径的关系。图1A-图1C 不 同测量直径(轴位,MPR,3D)在R1(Radiologist 1)和R2(Radiologist 2)之间的关系;图1D-图1F R1使用不同 直径测量(轴位,MPR,3D)与病理直径的关系;图1G-图1I R2使用不同直径测量(轴位,MPR,3D)与病理直径的 关系。

表2 不同测量层面观察者间一致性及与病理大小一致性的比较
2.3 不同直径测量在预测T分期准确性中的比较不同直径测量所得T分期见表3。R1使用轴位直径,MPR直径和3D直径区分组A与组Β的准确性依次为69.4 %(50/72),86.1%(62/72)和58.3 %(44/72),R2的依次为62.5%(46/72),84.7%(61/72)和61.1%(44/72)。MPR直径的准确性显著大于轴位直径和3D直径(R1:P=0.023和0.001;R2:P=0.003和0.005)(见表4及图2)。轴位直径和3D直径的准确性的差异没有统计学意义(R1:P=0.243;R2:P=0.875)。
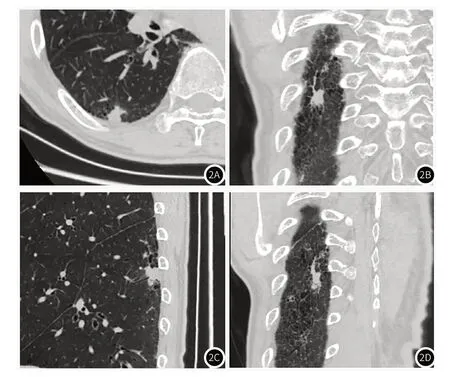
图2A-图2D 右肺下叶一实性结节。R1(Radiologist 1)测量轴位(2A)直径为 9.3mm,冠状位(2B)直径为17.6mm,矢状位(2C)直径为18.6mm,3D 直径(2D)为27.3mm,因此根据轴位直径分期为T1a,MPR直径为T1b,3D直径为T1c。手术病理直径为19.1mm,癌组织未侵犯胸膜,病理分 期T1b。

表3 不同测量方法所得T分期
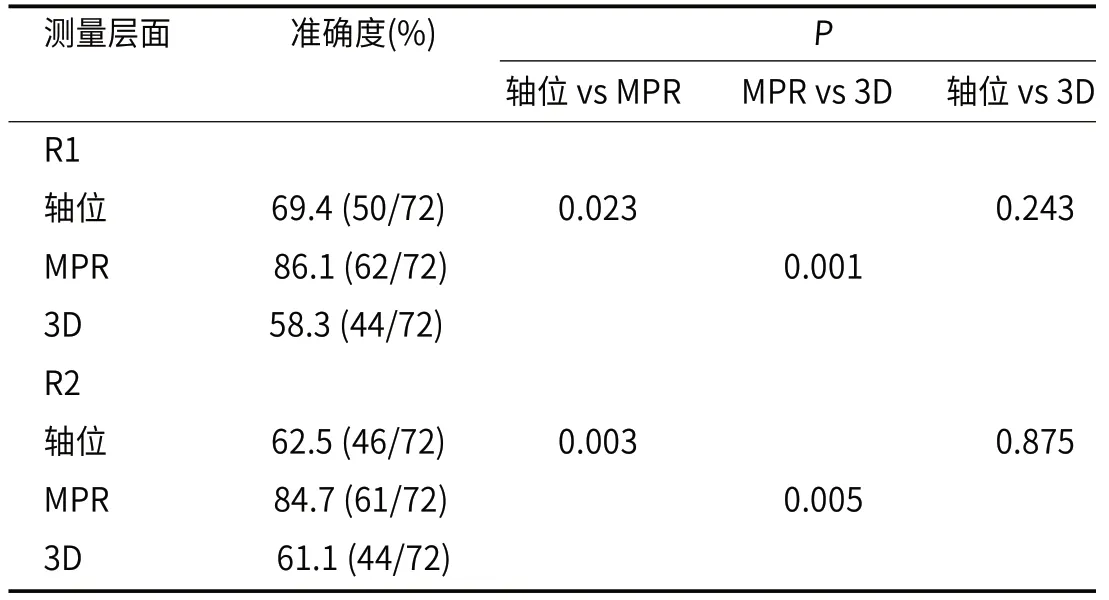
表4 不同测量方法区分组A和组Β准确性比较
3 讨 论
本次研究中我们以病理直径为金标准,比较了术前CT中轴位直径,MPR直径及3D直径这三种测量方法的诊断效能,结果显示MPR直径是最佳的测量方法,3D直径并没有表现出足够的稳定性与准确性。
相较于轴位直径,MPR直径需要额外在量结节的冠状位及矢状位上测量,因此可能会带来观察者间一致性的下降,然而,本次研究中MPR测量的观察间一致性较高,达到了“优秀”水平,与轴位直径不相上下(ICC=0.992 vs 0.993)。Park S等[12]的研究亦发现MPR直径的观察者间一致性与轴位直径相当(ICC=0.98 vs 0.98)。Ahn H等[9]以亚实性结节为研究对象,发现MPR直径和轴位直径的观察者间一致性均达到“良好”水平(ICC=0.83 vs 0.82),低于本次研究,这可能是由于亚实性结节的“瘤-肺”界面相对没有那么清楚,导致观察者间一致性下降。
手动3D直径测量需要花费额外时间与精力转动定位十字线寻找结节的最大直径,不同观察者转动的角度可能不一样,所以测量的结果也可能大不一样,导致测量结果不稳定[10]。本次研究中3D直径测量的观察者间一致性(ICC=0.863)和与病理直径之间的观察者间一致性(R1:ICC=0.825,R2:ICC=0.851)均达到了“良好”水平,但明显低于轴位直径和MPR直径,同时Β-A index显示3D直径测量的观察者间变异程度大于轴位直径和MPR直径,这些不足严重限制了3D直径测量在临床中的运用。
理论上讲,肿瘤的病理直径是在标本固定后沿最大面切开测量的,因此3D直径应该是最接近病理直径的测量方法,然而现实情况却是3D直径明显高估了肿瘤大小,导致高估其临床分期。这可能有以下几方面原因,首先,CT不能像病理那样准确地区分肿瘤与周围肺不张,炎症,血管等,导致过高地估计肿瘤大小[13-14]。其次,CT上肺癌被周围充气的肺组织包裹且一般都有丰富的血供,而肿瘤切除后周围肺组织塌陷,肿瘤本身的血供排空,导致体积减小。再者,手术过程对肿瘤也可能会造成一定程度损伤。
MPR直径比轴位直径和3D直径更接近病理大小,并且其T分期也更加准确,这具有重大的临床意义。如前所述,小于5cm的肺癌,在第八版AJCC分期中每增加1cm分期都会随之提高[2],而且本次研究中根据MPR直径所得T分期在预测病理分期上显著高于轴位直径和3D直径,进一步说明MPR直径在测量肺癌大小中的重要地位。
本次研究有以下不足:首先,本次研究仅纳入了T1期实性肺癌,所得结论能否运用于T2期及其以上还有磨玻璃结节肺癌还需要进一步研究,然而,随着胸部CT体检的广泛运用,大部分的肺癌得以早期发现,另外,肺癌的分期是根据实性部分的大小决定的,磨玻璃成分的大小不能决定预后,准确测量磨玻璃成分大小在肺癌分期中并不重要。其次,本次研究为回顾性单中心研究,样本量较小,需要未来的多中心大样本研究进一步验证。最后,所有的测量都是手动进行的,随着人工智能的发展,会逐步实现半自动或者自动获得结节轴位直径,MPR直径及3D直径,结节测量的观察者间一致性也会进一步提高[15]。
总之,相对于轴位直径和3D直径,MPR直径具有优秀的观察者间一致性及更高的分期准确性,应该被用于肺癌的临床分期测量。
