敲低CD73 的表达对人肺腺癌H1975 细胞增殖、迁移、侵袭能力的影响及其机制△
2024-03-22肖文华黄真刘凤娟张弘苏红孙荣丽
肖文华,黄真,刘凤娟,张弘,苏红,孙荣丽
1 青岛大学青岛医学院,山东 青岛 266042 康复大学青岛中心医院(青岛市中心医院)2 院长办公室,3 药物临床试验中心一期病房,4 呼吸与危重症医学科,5 基层医疗科,山东 青岛 266042
中国国家癌症中心统计报告显示,肺癌是中国发病率和病死率最高的恶性肿瘤[1]。肺癌的常见病理类型为非小细胞肺癌(non-small cell lung cancer,NSCLC),NSCLC 中又以肺腺癌最为多见,占所有NSCLC 病理类型的50%以上,且呈持续上升趋势[2]。肺腺癌患者的病死率一直处于较高水平,中晚期肺腺癌患者的5 年生存率不足20%[3]。CT 等影像学检查的普及明显提高了早期肺癌的诊断率,降低了病死率,但对于中晚期肺癌患者无明显受益[4]。近年来,随着免疫检查点的发现及免疫检查点抑制剂的应用,患者的预后和生活质量得到了明显改善,且不良反应发生风险较低,表明免疫治疗具有良好的发展前景[5-6]。尽管如此,仍然有一部分患者不能从现有的免疫治疗中获益。因此,积极探索新的潜在治疗靶点至关重要。胞外5’-核苷酸酶(5’-nucleotidase ecto,NT5E),又称为CD73,是一种多功能跨膜糖蛋白,参与细胞外腺苷的生成,与免疫、炎症和肿瘤等多种病理、生理反应相关[7]。有研究表明,CD73 在多种肿瘤中高表达,且患者大多预后不良[8-11],但其促进肿瘤发生、发展的具体作用机制尚未完全清楚,特别是CD73 促进肺腺癌发生发展的机制鲜有报道。本研究探讨敲低CD73的表达对人肺腺癌H1975 细胞增殖、迁移、侵袭能力的影响,并进一步探索其可能的机制,以期为肺腺癌的发生、发展机制和治疗方法的研究提供理论依据,现报道如下。
1 资料与方法
1.1 细胞和试剂
人肺腺癌H1975 细胞购自武汉普诺赛生命科技有限公司。慢病毒HBLV-ZsGreen-PURO 购自上海汉恒科技公司。胎牛血清购自以色列Biological Industries 公司,Matrigel 基质胶、RPMI 1640 培养基、Transwell 细胞培养小室均购自美国Corning公司,CD73、磷脂酰肌醇3 激酶(phosphoinositide 3-kinase,PI3K)p85a 抗体均购自英国Abcam 公司,磷酸化PI3K(phosphorylated PI3K,p-PI3K)、蛋白激酶B(protein kinase B,PKB,又称AKT)抗体均购自美国ImmunoWay 公司,磷酸化AKT(phosphorylated AKT,p-AKT)抗体购自美国Cell Signaling Technology 公司,E-上皮钙黏素(E-cadherin)、波形蛋白(vimentin)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、辣根过氧化物酶(horseradish peroxidase,HRP)、羊抗兔免疫球蛋白G(immunoglobulin G,IgG)抗体均购自武汉爱博泰克生物科技有限公司。本研究经过青岛市中心医院医学伦理委员会审批通过(KY202217502)。
1.2 人肺腺癌H1975 细胞培养与转染
将人肺腺癌H1975 细胞培养在含10%胎牛血清、1%青霉素/链霉素双抗的RPMI 1640 完全培养基中,置于37 ℃、5% CO2的恒温箱中常规培养。细胞消化离心后置入完全培养基重悬,配制1.5×105/ml 的细胞悬液,并加入6 孔板中(每孔接种1 ml)。待细胞密度生长至50%左右,将原培养基弃去,每孔加入5 µg/ml 聚凝胺混合培养基1 ml。然后每孔加转染慢病毒60µl[感染复数(multiplicity of infection,MOI)=40],4 h 后将混合培养基补齐至2 ml。转染24 h 后弃去含病毒的培养基,换为新鲜完全培养基,置于培养箱中继续培养。转染72 h 后置于荧光显微镜下观察绿色荧光蛋白表达情况,若细胞状态稳定,换上浓度适当的含嘌呤霉素(本研究嘌呤霉素浓度为3 µg/ml)的新鲜完全培养基进行筛选培养,待无明显细胞死亡后视为未转染的正常细胞已全部杀死,此时更换新的完全培养基继续培养,定期重复筛选。将转染慢病毒HBLV-ZsGreen-PURO NC 的人肺腺癌H1975细胞作为H1975-NC 组,将转染3 种不同位点敲低CD73表达的慢病毒HBLV-h-CD73短发夹RNA(short hairpin RNA,shRNA)-ZsGreen-PURO 的人肺腺癌H1975 细胞分别作为H1975-shCD73-1 组、H1975-shCD73-2 组、H1975-shCD73-3 组,以未转染人肺腺癌H1975 细胞作为空白对照组。
1.3 蛋白质印迹法(Western blot)筛选敲低效果最明显的转染细胞
分别收集空白对照组、H1975-NC 组、H1975-shCD73-1 组、H1975-shCD73-2 组、H1975-shCD73-3组细胞至1.5 ml 离心管中,加入适量的放射免疫沉淀(radio-immunoprecipitation assay,RIPA)裂解液和苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)混合液(100∶1)于冰上裂解30 min 后低温离心,取上清液,加入适量蛋白上样缓冲液置于100 ℃金属浴锅中加热10 min,提取总蛋白后进行电泳,然后转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,封闭后加入适量抗体溶液进行孵育(抗体溶液根据说明书进行稀释),然后将配制的发光液滴加在PVDF 膜条带上,于暗室内进行曝光处理。曝光结束后采用ImageJ 软件分析蛋白条带相对灰度。选取敲低效果最明显的转染细胞进行后续实验,作为H1975-sh 组。
1.4 CCK8 法检测细胞增殖能力
选取H1975-NC、H1975-sh 组细胞,制备浓度为5×104/ml 的细胞悬液。接种至6 孔板中,每孔中加入100µl 细胞悬液,加入100µl 完全培养基培养4、24、48、72 h 后,每孔加入10 µl CCK8 溶液,置于培养箱中静置培养2 h,采用酶标仪检测H1975-NC、H1975-sh 组细胞450 nm 处的吸光度(optical density,OD)值,酶标仪以H1975-NC 组为对照调零。
1.5 细胞划痕实验检测细胞迁移能力
选取H1975-NC 组、H1975-sh 组细胞加入至6孔板中,并接种等量细胞(H1975-sh 组细胞可适当增加接种量)置于培养箱中培养,显微镜下观察到6 孔板内长满细胞后消毒,用200 µl 枪头沿直尺垂直底部横线从顶部向底部划线。然后每孔加入2 ml 含1%胎牛血清的RPMI 1640 培养基后于镜下拍照,拍照完毕后继续于培养箱中培养,分别在培养24、48 h 时再次于镜下拍照,观察细胞迁移情况。
1.6 Transwell 实验检测细胞侵袭能力
将Matrigel 胶加入RPMI 1640 培养基按照1∶40 稀释,每个细胞培养小室中加入100 µl 稀释好的Matrigel 胶,置于培养箱中静置4 h 后取出,吸走小室内未凝固的培养液,每个小室下方加入600 µl 完全培养基。收集H1975-NC 组、H1975-sh组细胞,用不含血清的RPMI 1640 培养基制备浓度为2.5×105/ml 的细胞悬液,每个小室内加入200 µl 细胞悬液,每个实验组设置3 个复孔,然后将孔板继续置于培养箱中培养。培养16 h 后将孔板拿出,将小室浸入甲醇溶液中固定细胞,然后用磷酸盐缓冲液(phosphate buffered solution,PBS)清洗风干后将小室浸入0.1%结晶紫溶液中染色,染色完成后用PBS 冲洗2 次,再将小室倒置晾干。最后将小室放在载玻片上置于显微镜下观察,随机选择5 个视野进行拍照并计算侵袭细胞数目。
1.7 Western blot 检测上皮-间充质转化(epithelial-mesenchymal transition,EMT)、PI3K/AKT 信号通路标志蛋白的表达水平
Western blot 检测方法同1.3 部分,检测H1975-NC 组、H1975-sh 组EMT 通路标志蛋白E-cadherin、vimentin 的表达水平以及PI3K/AKT 信号通路标志蛋白p-PI3K、PI3K、p-AKT、AKT 的表达水平,计算p-PI3K/PI3K、p-AKT/AKT。
1.8 统计学方法
采用GraphPad Prism 8.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验;以P﹤0.05 为差异有统计学意义。
2 结果
2.1 Western blot 检测细胞CD73 表达情况
慢病毒CD73shRNA 分别转染人肺腺癌H1975 细胞后,荧光显微镜下观察到稳定表达绿色荧光即表示转染成功,通过嘌呤霉素筛选转染成功细胞并杀死未转染细胞,稳定传代进行后续实验(图1)。采用Western blot 检测空白对照组、H1975-NC 组、H1975-shCD73-1 组、H1975-shCD73-2 组、H1975-shCD73-3 组的CD73 表达情况,结果显示,5 组细胞的CD73 表达情况比较,差异有统计学意义(P﹤0.01),其中H1975-shCD73-2 组细胞CD73敲低效果最明显,选取该组(即H1975-sh 组)细胞进行后续实验。(图1、图2、表1)
图1 荧光显微镜显示慢病毒CD73 shRNA转染人肺腺癌H1975细胞

图2 Western blot检测各组人肺腺癌H1975细胞CD73表达情况
表1 各组人肺腺癌H1975 细胞CD73 蛋白表达水平的比较(±s)

表1 各组人肺腺癌H1975 细胞CD73 蛋白表达水平的比较(±s)
组别空白对照组H1975-NC组H1975-shCD73-1组H1975-shCD73-2组H1975-shCD73-3组F值P值CD73蛋白表达水平0.942±0.053 0.887±0.047 0.446±0.063 0.312±0.049 0.513±0.145 36.23<0.01
2.2 敲低CD73 的表达对人肺腺癌H1975 细胞增殖能力的影响
采用CCK8 实验检测H1975-NC 组、H1975-sh组细胞的增殖能力,结果显示,转染4 h,H1975-NC组细胞与H1975-sh 组细胞OD 值比较,差异无统计学意义(P﹥0.05);转染24、48、72 h,H1975-sh 组细胞OD 值均明显低于H1975-NC 组细胞,差异均有统计学意义(P﹤0.01)。(表2)
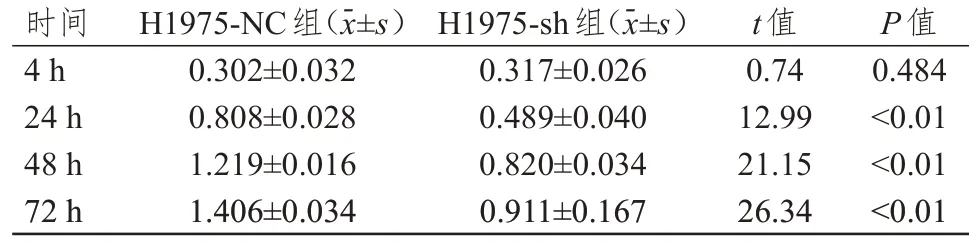
表2 转染不同时间H1975-NC组、H1975-sh组细胞OD值的比较
2.3 敲低CD73 的表达对人肺腺癌H1975 细胞迁移能力的影响
采用细胞划痕实验检测H1975-NC、H1975-sh组细胞迁移能力,结果显示,培养24、48 h,H1975-sh组细胞的划痕面积愈合率分别低于H1975-NC 组细胞,差异均有统计学意义(P﹤0.05)。(表3、图3)

图3 转染不同时间H1975-NC组、H1975-sh组细胞迁移情况

表3 转染不同时间H1975-NC 组、H1975-sh 组细胞划痕面积愈合率的比较
2.4 敲低CD73 的表达对人肺腺癌H1975 细胞侵袭能力的影响
采用Transwell 侵袭实验检测H1975-NC 组、H1975-sh 组细胞侵袭能力,结果显示,转染16 h后,H1975-sh 组细胞侵袭数目为(146±15),少于H1975-NC 组细胞的(254±22),差异有统计学意义(t=7.176,P﹤0.05)。(图4)
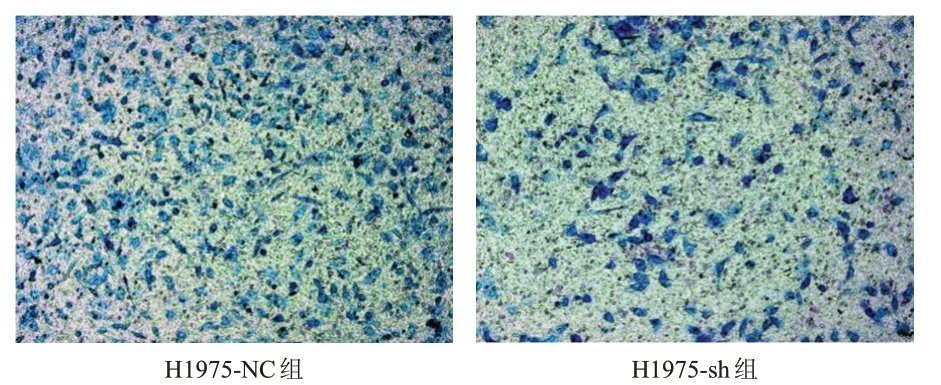
图4 Transwell侵袭实验检测H1975-sh组、H1975-NC组细胞侵袭情况
2.5 敲低CD73 的表达对EMT 通路标志蛋白E-cadherin、vimentin 表达的影响
Western blot 检测各组人肺腺癌H1975 细胞EMT 通路标志蛋白的表达情况,结果显示,空白对照组、H1975-NC 组、H1975-sh 组细胞E-cadherin、vimentin 蛋白相对表达量比较,差异均有统计学意义(P﹤0.01);其中H1975-sh 组细胞E-cadherin 蛋白的相对表达量高于空白对照组和H1975-NC 组细胞,差异均有统计学意义(t=20.95、10.62,P﹤0.05);H1975-sh 组细胞vimentin 蛋白的相对表达量低于空白对照组和H1975-NC 组细胞,差异均有统计学意义(t=31.30、7.77,P﹤0.05)。(表4)
表4 各组人肺腺癌H1975 细胞EMT 通路标志蛋白E-cadherin、vimentin 相对表达量的比较(±s)

表4 各组人肺腺癌H1975 细胞EMT 通路标志蛋白E-cadherin、vimentin 相对表达量的比较(±s)
组别空白对照组H1975-NC组H1975-sh组F值P值E-cadherin蛋白0.216±0.033*0.394±0.110*1.214±0.076 134.50<0.01 vimentin蛋白1.000±0.034*0.732±0.138*0.091±0.037 91.03<0.01
注:*与H1975-sh组细胞比较,P<0.05
2.6 敲低CD73 的表达对PI3K/AKT 通路蛋白表达情况的影响
采用Western blot 检测H1975-NC 组、H1975-sh组人肺腺癌H1975 细胞PI3K/AKT 信号通路蛋白的表达情况,结果显示,H1975-sh组细胞p-PI3K/PI3K、p-AKT/AKT 均低于H1975-NC 组细胞,差异均有统计学意义(P﹤0.05)。(表5)
表5 H1975-NC 组、H1975-sh 组人肺腺癌H1975 细胞p-PI3K/PI3K、p-AKT/AKT 的比较(±s)

表5 H1975-NC 组、H1975-sh 组人肺腺癌H1975 细胞p-PI3K/PI3K、p-AKT/AKT 的比较(±s)
组别H1975-NC组H1975-sh组t值P值p-PI3K/PI3K 1.298±0.322 0.416±0.211 2.33 0.017 p-AKT/AKT 2.485±0.805 0.694±0.364 7.33 0.042
3 讨论
肺癌严重危害人类健康,是全球肿瘤相关死亡的主要原因之一,其发病率和病死率均呈上升趋势[12]。由于吸烟、职业危害、人口老龄化及环境等因素的影响,肺癌发病率居高不下。尽管现有治疗手段较前已经取得了非常大的进展,但肺癌仍是中国发病率和病死率最高的恶性肿瘤,确诊时已发生远处转移的晚期肺癌患者的5 年生存率仅为6%[13-15]。新靶点的发现和免疫治疗的出现将肺癌患者的5 年生存率提升至15%~50%[15],明显延长了晚期肺癌患者的生存时间。尽管如此,也只有部分患者能从中获益。因此,探索新的潜在治疗靶点和进一步明确肺癌的发生、发展机制尤为重要。
CD73 可将腺苷一磷酸(adenosine monophosphate,AMP)水解为腺苷后与其受体结合,通过降低T 细胞、自然杀伤细胞和树突状细胞等免疫细胞的免疫活性来减少免疫因子,增强主要免疫抑制因子的活性,从而引起免疫抑制,促进肿瘤的发生、发展[10]。此外,CD73 还可充当黏附分子,可以调节细胞与细胞外基质(extracellular matrix,ECM)的相互作用,从而促进肿瘤细胞的侵袭、转移[16]。CD73 在多种肿瘤中高表达,说明其对肿瘤的发生、发展发挥重要作用,但具体机制仍有待进一步探索。
EMT 是各种生理、病理过程中的重要环节,与胚胎和器官的生长发育、组织再生和纤维化、肿瘤进展和肿瘤干细胞特性密切相关[17]。EMT 过程中,上皮相关基因E-cadherin的表达受到抑制,而间质相关基因vimentin的表达增强[18],且受到诸多如转化生长因子-β(transforming growth factor-β,TGF-β)、骨形成蛋白(bone morphogenetic protein,BMP)、WNT/β-catenin、Notch、Hedgehog 和受体酪氨酸激酶(receptor tyrosine kinase,RTK)等信号通路的共同调节[18-19]。有研究表明,PI3K/AKT 信号通路可促进EMT 的发生并导致肿瘤进展[20-23],但CD73 是否能促进肺腺癌EMT 的发生及其具体机制目前尚不完全清楚。
本研究探讨CD73 在肺腺癌细胞中的生物学作用及其机制,利用慢病毒CD73shRNA 转染人肺腺癌H1975 细胞构建CD73敲低细胞株,选取CD73敲低效果最明显的细胞进行后续细胞增殖、迁移、侵袭实验,结果显示,敲低CD73的表达后,人肺腺癌H1975 细胞的增殖、迁移和侵袭能力均受到抑制,说明CD73可以促进肺腺癌细胞的增殖、迁移和侵袭。为进一步探讨CD73 促进肿瘤细胞发生发展的具体机制,本研究采用Western blot检测各组细胞上EMT 通路上皮标志蛋白E-cadherin、间质标志蛋白vimentin 以及PI3K/AKT 信号通路标志蛋白的表达差异,结果显示,H1975-sh 组细胞E-cadherin 蛋白的相对表达量高于空白对照组和H1975-NC 组细胞,vimentin 蛋白的表达量低于空白对照组和H1975-NC 组细胞,差异均有统计学意义(P﹤0.05),表明敲低CD73的表达促进了E-cadherin 蛋白的表达,抑制了vimentin 蛋白的表达,从而表明敲低CD73的表达抑制了肺腺癌细胞EMT 的发生;此外,PI3K/AKT 磷酸化程度反映该信号通路的激活程度,本研究结果显示,H1975-sh组细胞p-PI3K/PI3K、p-AKT/AKT 均低于H1975-NC 组细胞,表明CD73 可能通过PI3K/AKT 信号通路促进肺腺癌EMT 的发生,进而导致肺腺癌进展。
综上所述,CD73 能促进肺腺癌细胞的增殖、迁移和侵袭,其机制可能与PI3K/AKT 信号通路和EMT 过程有关。
