雷公藤多苷片与呋塞米联用治疗肾病综合征大鼠的药动学/药效学研究
2024-03-22潘桂湘李自强吕春晓王婧媛黄宇虹
杜 犀,潘桂湘,李自强,刘 蓉,吕春晓,刘 佳,王婧媛,黄宇虹
天津中医药大学第二附属医院,天津 300250
肾病综合征(nephrotic syndrome,NS)是临床常见的一组肾脏疾病综合征,以大量蛋白尿、低白蛋白血症以及不同程度的水肿、高脂血症为主要特征,并伴随肾小管、肾小球等肾实质器官的损伤[1-2]。若不能及时控制改善NS 症状,其最终将会发展为慢性肾脏疾病进而造成肾衰竭[3]。在我国临床治疗NS中,常使用雷公藤多苷片缓解大量蛋白尿症状[4-5]。由于NS 常伴随水肿,临床上常使用袢利尿剂对症治疗。故在实际应用中,雷公藤多苷片与袢利尿剂常会发生合用,但相关研究却不足,多凭临床经验处理,相对缺乏数据支持。
雷公藤多苷片主要由二萜类、三萜类及生物碱类活性成分组成,其中二萜类成分雷公藤甲素及生物碱类主要经肾脏消除,尿液排出[6]。肾有机阴离子转运体底物袢利尿剂呋塞米,具有加速经肾消除的药物排泄的作用[7]。NS 条件下肾脏功能受损、内环境紊乱,可能会影响从肾脏消除药物的药动学行为。因此NS 状态下,2 药的药动学与健康状态相比可能发生变化并出现相互作用。课题组前期已建立血浆中雷公藤多苷片及呋塞米可靠的检测方法,本研究采用多柔比星诱导的NS 模型大鼠[8],探索雷公藤多苷片与呋塞米在健康或疾病状态下单用及合用后的药动学及药效学特点,为临床合理用药提供参考。
1 材料
1.1 动物
SPF 级雄性SD 大鼠,体质量(250~270)g,购自北京华阜康生物科技股份有限公司,许可证号SCXK(京)2019-0008。动物饲养于动物屏障SPF环境系统,温度20~26 ℃,相对湿度40%~70%,通风次数为15 次/h 全新风,光照为12 h 明/暗。动物实验经易生源基因科技(天津)有限公司实验动物伦理委员会批准(批准号YSY-DWLL-2021167)。
1.2 药品与试剂
雷公藤多苷片(批号20180603)购自湖南千金协力药业;呋塞米片(批号1910069)购自天津力生制药;注射用盐酸多柔比星(批号1907E2)购自深圳万乐药业;对照品呋塞米(批号100544-201503,质量分数为99.3%)、托拉塞米(批号100605-201402,质量分数为100.0%)购自中国食品药品检定研究院;雷公藤新碱(批号CFS201901)、雷公藤晋碱(批号 CFS201902)、雷公藤次碱(批号CFS201902)、雷公藤定碱(批号CFS201902)、雷公藤春碱(批号CFS201902)购自武汉中标科技有限公司,质量分数均为98%;内标多潘立酮(批号1-JTN-136-1,质量分数为99.72%)购自加拿大Toronto Research Chemicals 公司;色谱级乙腈、甲醇购自美国Thermo Fisher Scientific 公司;甲酸购自美国ROE 公司;醋酸乙酯购自天津渤化化学试剂有限公司;尿蛋白定量测试盒(批号20201222)购自南京建成生物工程研究所;丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、尿素氮(urea nitrogen,BUN)、肌酐(creatinine,CRE)、总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)试剂盒(批号均为140320110)均购自深圳迈瑞动物医疗科技有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号21612)、羊抗兔IgG 二抗(批号L3012-2)购自美国Signalway Antibody 公司;有机阴离子转运蛋白1(organic anion transporter 1,OAT1)抗体(批号Ab131087)购自英国Abcam 公司;OAT3 抗体(批号83500)购自北京博奥森生物技术有限公司。
1.3 仪器
Waters Acquity UPLC 超高效液质色谱(美国Waters 公司)串接AB Triple Quad 5500 三重四极杆质谱(美国AB 公司);BS-240VET 型动物专用全自动生化仪(深圳迈瑞生物医疗电子股份有限公司);XS205DU 型电子分析天平(瑞士梅特勒公司);Champchemi 610 plus 型全自动化学/荧光/凝胶成像分析系统(北京赛智创业科技有限公司);HistoCore MULTICUT 型病理切片机(德国Leica 公司);CKX43-LP 型显微镜(日本Olympus 公司)。
2 方法
2.1 动物造模、分组及给药
110 只雄性SD 大鼠适应性喂养7 d,置代谢笼,收集24 h 尿液,检测尿蛋白呈阴性,符合标准。大鼠尾iv 盐酸多柔比星4 mg/kg,隔1 周再次注射2 mg/kg 造模,对照组注射生理盐水。21 d 后代谢笼收集24 h 尿液,测定尿蛋白含量,与对照组相比具有显著性差异,认为造模成功。
取正常大鼠,设置对照组(C)、雷公藤多苷片单次给药组(C-GTW)、呋塞米单次给药组(CFSM)、5 倍雷公藤多苷片单次给药组(C-5GTW)、雷公藤多苷片联合呋塞米单次合用组(C-GTW+FMS)、5 倍剂量雷公藤多苷片联合呋塞米单次合用组(C-5GTW+FMS)、累积服用雷公藤多苷片联合呋塞米2 周组(C-GTW+FMS-2W)、累积服用5 倍雷公藤多苷片联合呋塞米2 周组(C-5GTW+FMS-2W),每组6 只。
造模大鼠随机分为模型组(NS)、雷公藤多苷片单次给药组(NS-GTW)、呋塞米单次给药组(NSFSM)、5 倍雷公藤多苷片单次给药组(NS-5GTW)、累积服用雷公藤多苷片联合呋塞米2 周组(NSGTW+FSM-2W)、累积服用5 倍雷公藤多苷片联合呋塞米2 周组(NS-5GTW+FSM-2W)、累积服用雷公藤多苷片2 周组(NS-GTW-2W)、累积服用5倍雷公藤多苷片2 周组(NS-5GTW-2W),每组6 只。
雷公藤多苷片以体表面积法折算给药剂量为10 mg/(kg∙d),5 倍给药剂量为50 mg/(kg∙d)。呋塞米给药剂量为6 mg/(kg∙d),各给药组ig 相应药物,对照组和模型组ig 等体积生理盐水。
2.2 取材
2.2.1 血液采集 于给药前(0 h),后10、30 min和1、1.5、2、3、4、6、8、24、30 h,大鼠内眦取血至肝素化的离心管中,取血后1 h 内以3 000 r/min离心10 min,分离血浆,置于−80 ℃冰箱中保存,用于药动学研究。生化指标检测所用血浆,仅采集对照组、模型组及各累积2 周服用给药组,在实施药动学研究采血前1 d 采集。
2.2.2 尿液采集 大鼠至代谢笼中,留取24 h 的尿液,进行尿蛋白定量分析。在实施药动学研究采血前1 d 采集。
2.2.3 肾组织采集 实验结束后,取大鼠左肾组织,浸泡在10%中性福尔马林缓冲液中进行固定用于病理切片检查;取右肾组织,于液氮中快速冷冻后分管储存在−80 ℃,用于肾脏的Western blotting检测。
2.3 药动学研究
2.3.1 样品前处理 取100 μL 大鼠样品血浆,加入10 μL 内标(多潘立酮/托拉塞米10 ng/mL)、1 mL醋酸乙酯,涡旋3 min,10 000 r/min 离心10 min,取上清转移入干净EP 管中,氮气吹干。残渣以100 μL 20%乙腈水溶液(含0.1%甲酸)复溶,进样。
2.3.2 标准曲线和质控样品制备 取90 μL 大鼠空白血浆,加入10 μL 标准曲线/质控工作液,分别制备成质量浓度为含雷公藤多苷片各成分0.1、0.5、1、5、10、100、400、500 ng/mL 的标准样品,及3、60、375 ng/mL 的质控样本;含呋塞米为0.5、1、5、10、50、400、500 ng/mL 的标准样品,及1.5、75、375 ng/mL 质控样品。
2.3.3 雷公藤多苷片色谱及质谱条件
(1)色谱条件:流动相为含0.1%甲酸的5 mmol/L 乙酸铵水溶液(A)-含0.1%甲酸的乙腈溶液(B),梯度洗脱:0~2.0 min,80% A;2.0~2.2 min,80%~45% A;2.2~5.8 min,45% A;5.8~6.0 min,45%~10% A;6.0~8.5 min,10% A;8.5~9.0 min,10%~80% A;9.0~13.0 min,80% A。体积流量0.3 mL/min;进样器温度4 ℃;柱温30 ℃;进样量5 μL。
(2)质谱条件:ESI 离子源,正离子分析模式,MRM 扫描。参数设置:气帘气压力241.325 kPa,碰撞气压力48.262 kPa,离子喷雾电压5 500.00 V,离子源温度450.00 ℃,辅助气压力344.75 kPa。其他参数见表1。
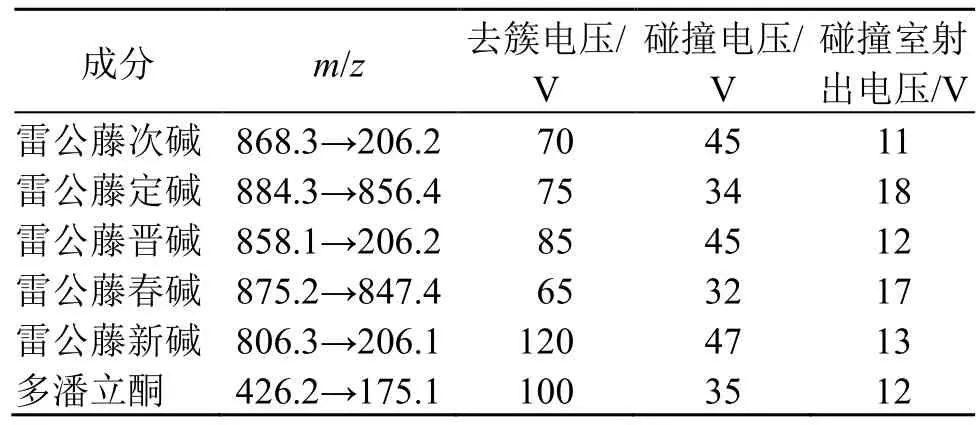
表1 雷公藤多苷片质谱参数Table 1 Mass spectrometry parameters of Tripterygium Glycosides Tablets
2.3.4 呋塞米色谱及质谱条件
(1)色谱条件:流动相、体积流量、进样器温度及柱温均同“2.3.3”项。梯度洗脱:0~0.6 min,70% A;0.6~0.8 min,70%~35% A;0.8~1.9 min,35% A;1.9~2.0 min,35%~5% A;2.0~2.5 min,5% A;2.5~2.6 min,5%~70% A;2.6~5.0 min,70% A。进样量5 μL。
(2)质谱条件:ESI 离子源,负离子分析模式,离子参数设置:离子喷雾电压−4 500.00 V,其余设置同“2.3.3”项。其他参数见表2。

表2 呋塞米质谱参数Table 2 Mass spectrometry parameters of furosemide
2.4 大鼠一般情况及生化指标检测
观察大鼠的皮毛光滑度、记录体质量、活动状态及进食情况等。使用尿蛋白试剂盒定量分析大鼠24 h 尿蛋白。全自动生化仪检测血浆ALT、AST、ALP 活性及TP、ALB、TC、TG、BUN、CRE 水平。
2.5 肾组织苏木素-伊红(HE)染色
取大鼠新鲜肾脏经4%多聚甲醛固定,梯度乙醇逐级脱水,依次透明、浸蜡、石蜡包埋、修整、切片、烤片,石蜡切片脱蜡至水,苏木素染细胞核,伊红染细胞质,脱水封片后于显微镜下观察并拍照。
2.6 Western blotting 检测肾脏OAT1 和OAT3 蛋白表达
取大鼠肾脏50 mg,剪碎研磨、冰上裂解,混匀后4 ℃离心,取上清测定蛋白含量。加入上样缓冲液,95 ℃加热10 min 使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后分别加入GAPDH 抗体(1∶5 000)、OAT1抗体(1∶600)、OAT3 抗体(1∶1 000),4 ℃孵育过夜,洗膜。加入二抗(1∶5 000),室温避光孵育60 min,洗膜。曝光洗片,采用Image J 软件分析条带灰度值。
2.7 药动学参数计算及统计学分析
药动学参数计算采用WinNonlin 8.1 软件计算分析,Tmax以中位数表示,其余参数以±s表示,缺失值以“—”表示,对Cmax和AUC0~t进行对数转化后再进行组间差异比较;结果使用SPSS 25 软件进行统计,计量资料以±s表示,两两组间比较采用独立t检验,多组间比较采用单因素方差分析。
3 结果
3.1 药动学研究
对大鼠血中的雷公藤多苷片成分雷公藤次碱、雷公藤定碱、雷公藤晋碱、雷公藤春碱、雷公藤新碱以及呋塞米进行检测,计算药动学参数并进行组间比较(表3~5),绘制各成分药-时曲线(图1)。
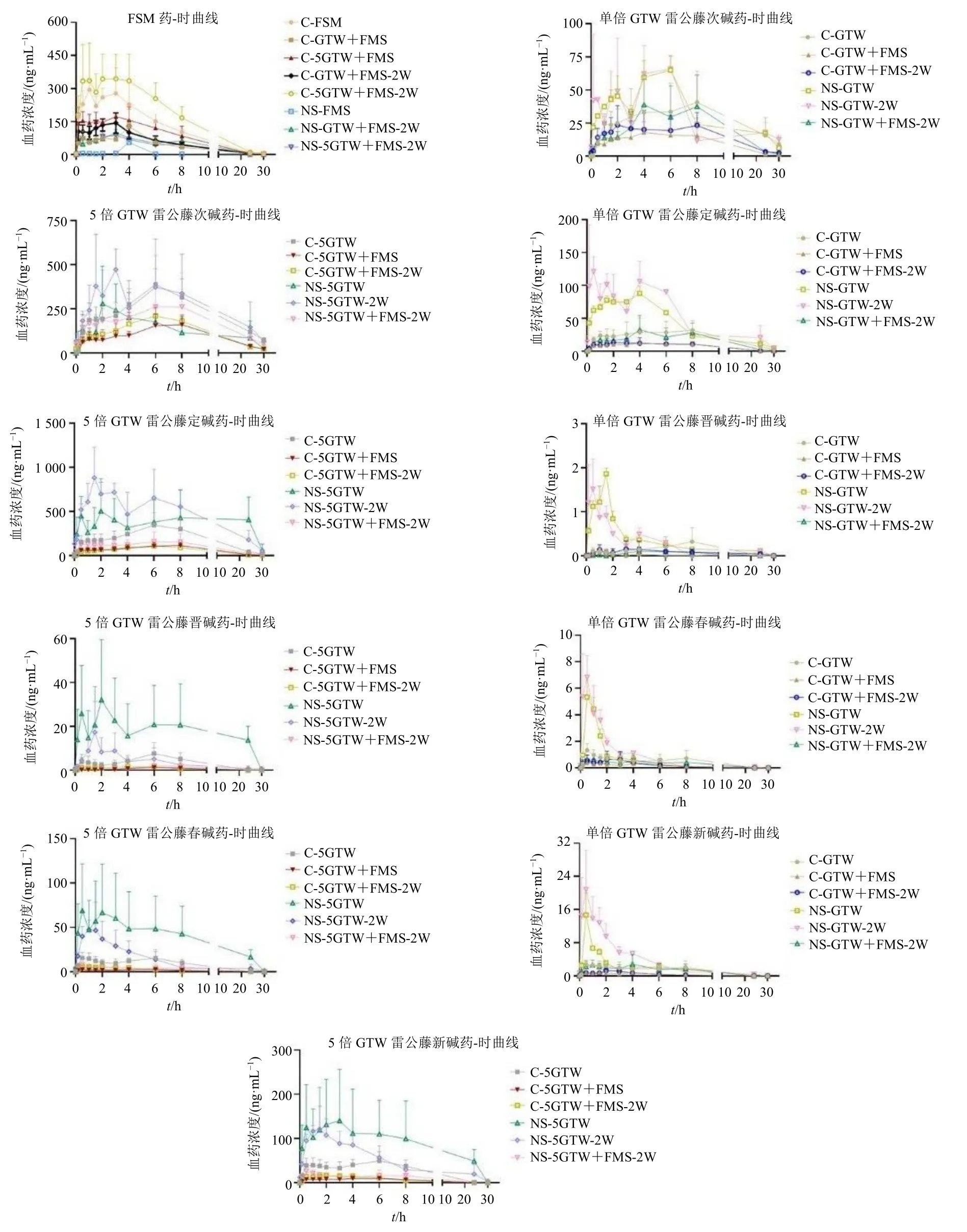
图1 呋塞米及雷公藤多苷片在不同组别大鼠体内的药-时曲线 (n = 6)Fig.1 Plasma concentration-time curves of furosemide and Tripterygium Glycosides Tablets in different groups of rats(n = 6)
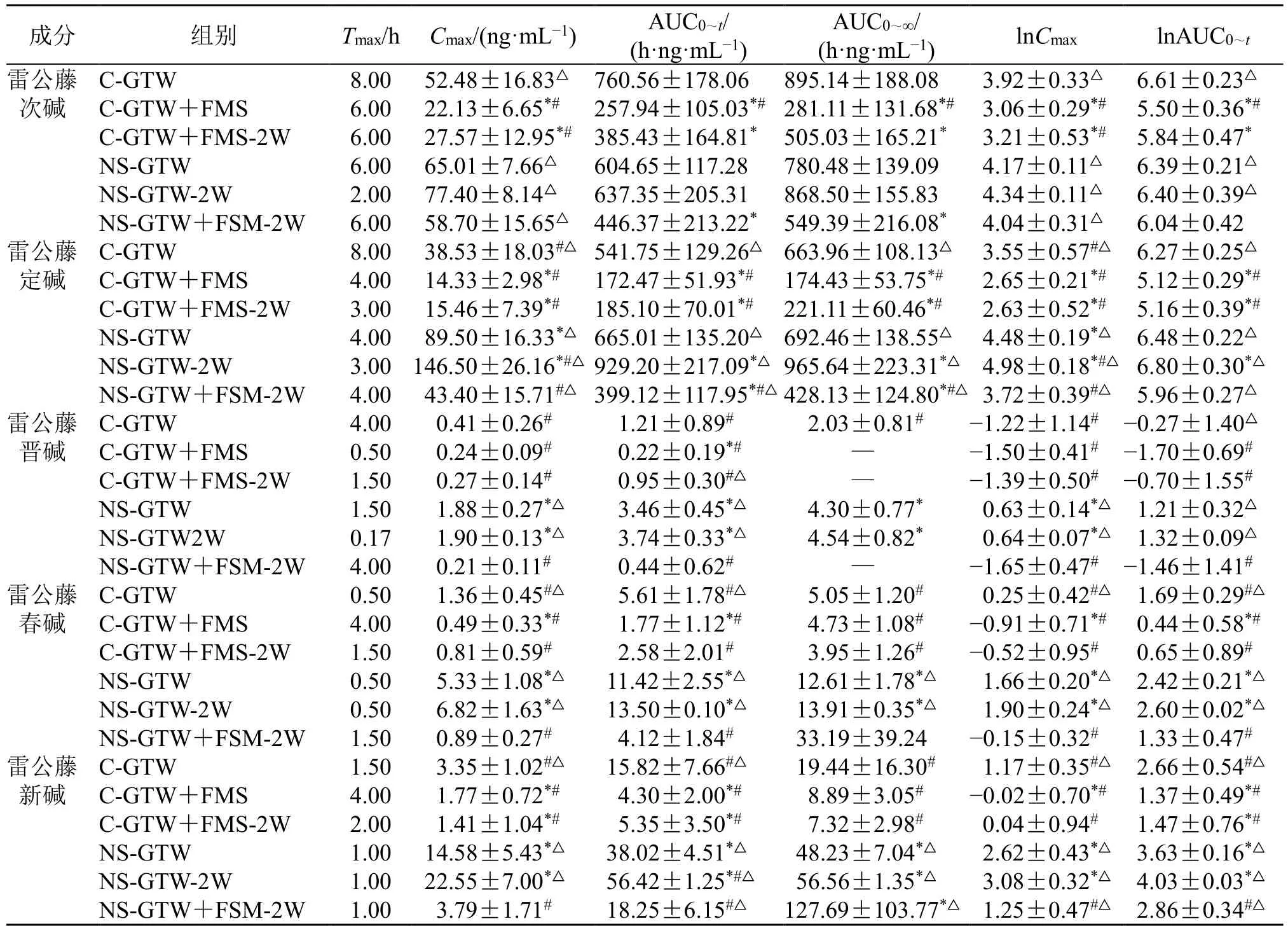
表3 单倍剂量雷公藤多苷片给药的大鼠药动学参数 (n = 6)Table 3 Pharmacokinetic parameters of rats after single dose administration of Tripterygium Glycosides Tablets (n = 6)
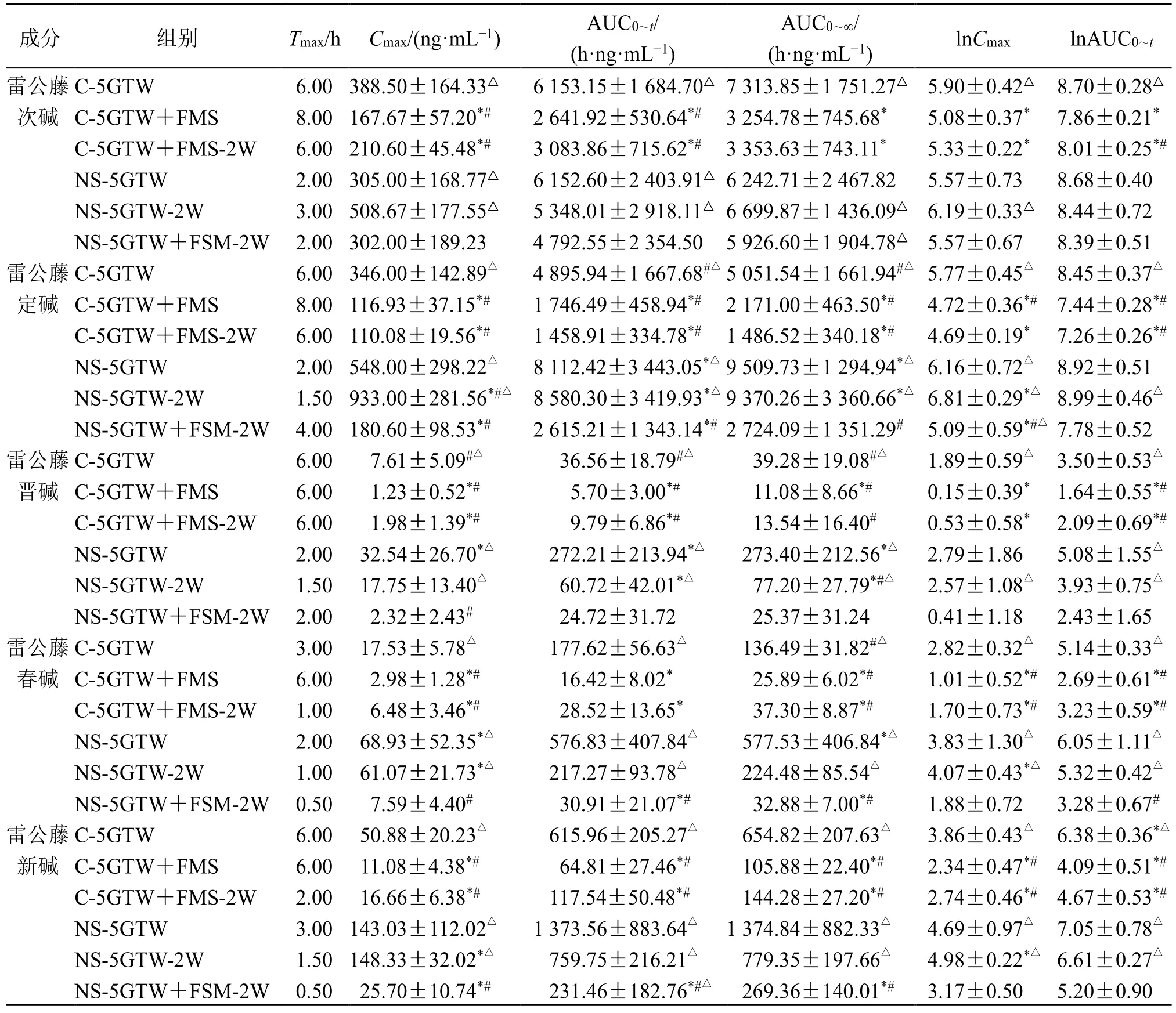
表4 5 倍剂量雷公藤多苷片给药的大鼠药动学参数 (n = 6)Table 4 Pharmacokinetic parameters of rats after five-fold doses administration of Tripterygium Glycosides Tablets (n = 6)
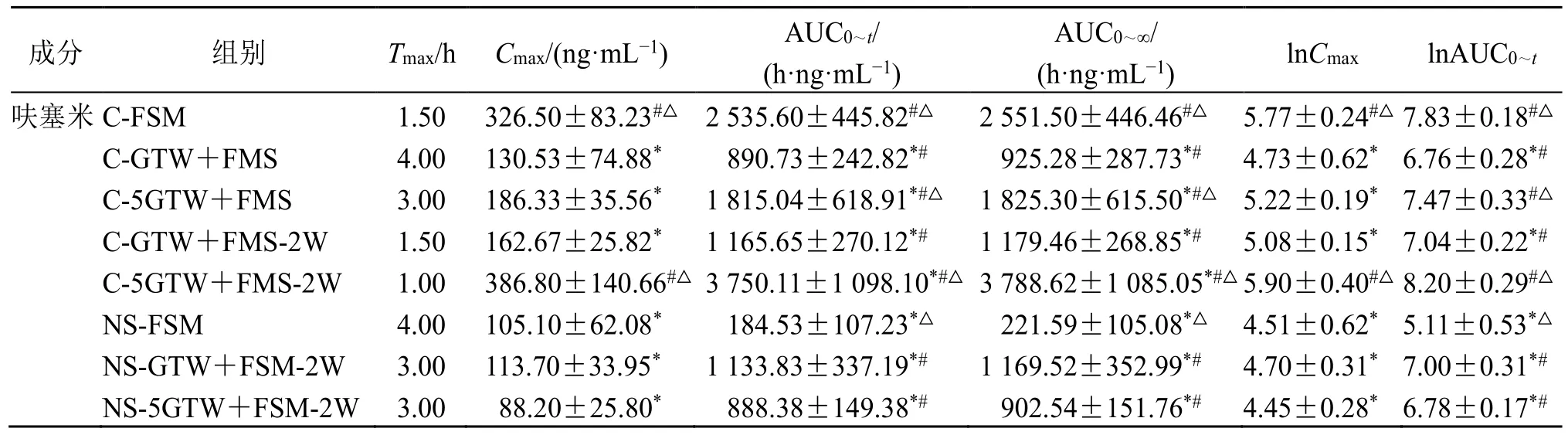
表5 呋塞米给药的大鼠药动学参数 (n = 6)Table 5 Pharmacokinetic parameters of rats after administration of furosemide (n = 6)
单因素方差分析显示,雷公藤多苷片的Cmax和AUC 在同一剂量组间均存在显著性差异,取对数后,除雷公藤次碱外其余成分均存在显著性差异。呋塞米组间差异显著。雷公藤多苷片生物碱类成分药动学呈现相似趋势,NS 下暴露明显增加。在2 个剂量间,无论是对照组还是模型组,5 倍雷公藤多苷片单次给药组的Cmax和AUC 值均显著高于雷公藤多苷片单次给药组的5 倍。与呋塞米合用,因其促排泄作用,雷公藤多苷片各成分暴露均显著下降。NS 下呋塞米的暴露显著降低,合用雷公藤多苷片可使呋塞米暴露部分回升。
3.2 大鼠一般情况及生化指标检测结果
如表6 所示,与对照组比较,模型组大鼠体质量显著下降(P<0.05),伴随精神不振、进食不佳、毛色晦暗等特征,尿蛋白含量显著升高(P<0.05)。经雷公藤多苷片治疗后,大鼠体质量有所回升,状态也有所恢复,尿蛋白含量有所好转但仍与对照组差异显著。合用呋塞米的组别尿蛋白含量高于未合用组,可能由于呋塞米的促排尿作用,使大鼠尿总量提升造成结果偏高。NS 大鼠肾功能下降,经给药治疗后肾功能有所改善,CRE 恢复明显。对照组在连续合并用药2 周后,肝功能指标升高,说明健康状态下连续合并用药或存在肝损风险,而疾病状态下用药则符合“有故无殒”理论。
表6 大鼠一般情况及生化指标检测结果 (±s, n = 6)Table 6 General condition and biochemical results of rats (±s , n = 6)

表6 大鼠一般情况及生化指标检测结果 (±s, n = 6)Table 6 General condition and biochemical results of rats (±s , n = 6)
组别 体质量/g 尿蛋白/mg ALT/(U·L−1) AST/(U·L−1) ALP/(U·L−1) TP/(g·L−1)C 337.2±6.6 9.3±3.0 59.2±9.4 98.6±9.4 214.5±11.1 63.2±5.2 C-GTW+FMS-2W 336.7±20.5# N/A 69.7±11.1# 121.3±9.9*# 292.0±73.9* 74.0±4.1*C-5GTW+FMS-2W 340.2±31.3# N/A 66.6±4.1# 111.2±12.0# 237.6±53.9 73.5±2.6*NS 306.5±18.6* 38.0±14.1* 54.6±4.4 83.2±23.5 284.6±205.5 69.2±14.2 NS-GTW-2W 348.8±20.0# 26.2±10.2* 67.8±23.2 54.1±14.0*# 152.9±66.4 72.0±22.7 NS-5GTW-2W 339.6±24.6 23.7±4.8* 65.3±14.4 78.3±18.0 189.1±45.2 70.2±16.3 NS-GTW+FSM-2W 335.8±17.3 30.9±15.4* 58.4±8.7 58.0±15.7*# 198.2±95.3 60.9±4.7 NS-5GTW+FSM-2W 333.0±50.8 34.4±17.6* 68.7±12.6# 88.9±62.7 259.3±286.5 75.0±4.5*组别 ALB/(g·L−1) CRE/(µmol·L−1) BUN/(mmol·L−1) TC/(mmol·L−1) TG/(mmol·L−1)C 32.7±1.8 33.8±4.3 4.81±0.50 1.66±0.19 0.71±0.16 C-GTW+FMS-2W 34.0±1.0# 35.5±4.8# 4.68±0.65 1.67±0.22# 0.91±0.31#C-5GTW+FMS-2W 33.8±1.2# 34.5±2.9# 4.26±0.69 1.83±0.14# 1.27±0.54#NS 28.0±2.0* 59.3±7.8* 5.70±1.50 4.49±1.99* 3.78±1.47*NS-GTW-2W 29.8±4.3 40.9±7.9# 5.08±1.26 6.30±2.73* 4.09±1.69*NS-5GTW-2W 28.6±2.7 42.3±5.2*# 5.48±1.30 5.07±1.23* 3.22±0.65*NS-GTW+FSM-2W 27.8±2.8* 45.8±4.0*# 7.32±3.16 4.45±1.75* 3.29±0.82*NS-5GTW+FSM-2W 30.3±3.4 44.4±4.8*# 5.93±2.81 5.39±1.15* 3.74±1.55*
与对照组(C)比较:*P<0.05;与模型组(NS)比较:#P<0.05;N/A 表示未测定,不适用。*P < 0.05 vs control group (C); #P < 0.05 vs model group (NS); N/A indicates that it has not been measured and is not applicable.
3.3 各组大鼠肾脏病理变化
如图2 所示,对照组、C-GTW+FMS-2W 组、C-5GTW+FMS-2W 组表现相似,肾脏组织结构正常,肾小球、肾小囊大小正常,肾小管结构正常,未见萎缩、扩张、变性坏死、管型。模型组大鼠肾脏组织结构大致正常,肾小球轻度萎缩,肾小囊轻度扩张,肾小管可见轻度萎缩、变性,未见坏死及管型,间质可见轻度纤维化、少量炎细胞浸润。NSGTW-2W 组、NS-GTW+FSM-2W 组、NS-5GTW-2W 组及NS-5GTW+FSM-2W 组表现类似,肾脏组织结构大致正常,偶见肾小球轻度萎缩,未见纤维化、变性,偶见肾小囊轻度扩张,肾小管结构正常,未见间质纤维化,偶见淋巴细胞浸润。病理结果一定程度揭示了2 药合用对NS 的疗效。
3.4 各组大鼠肾脏OAT1 和OAT3 蛋白表达
如图3 所示,与对照组比较,NS-5GTW+FSM-2W 组大鼠肾组织OAT1 蛋白表达水平显著降低(P<0.05),NS-GTW+FSM-2W 组和NS-5GTW+FSM-2W 组OAT3 蛋白表达水平均显著降低(P<0.05)。
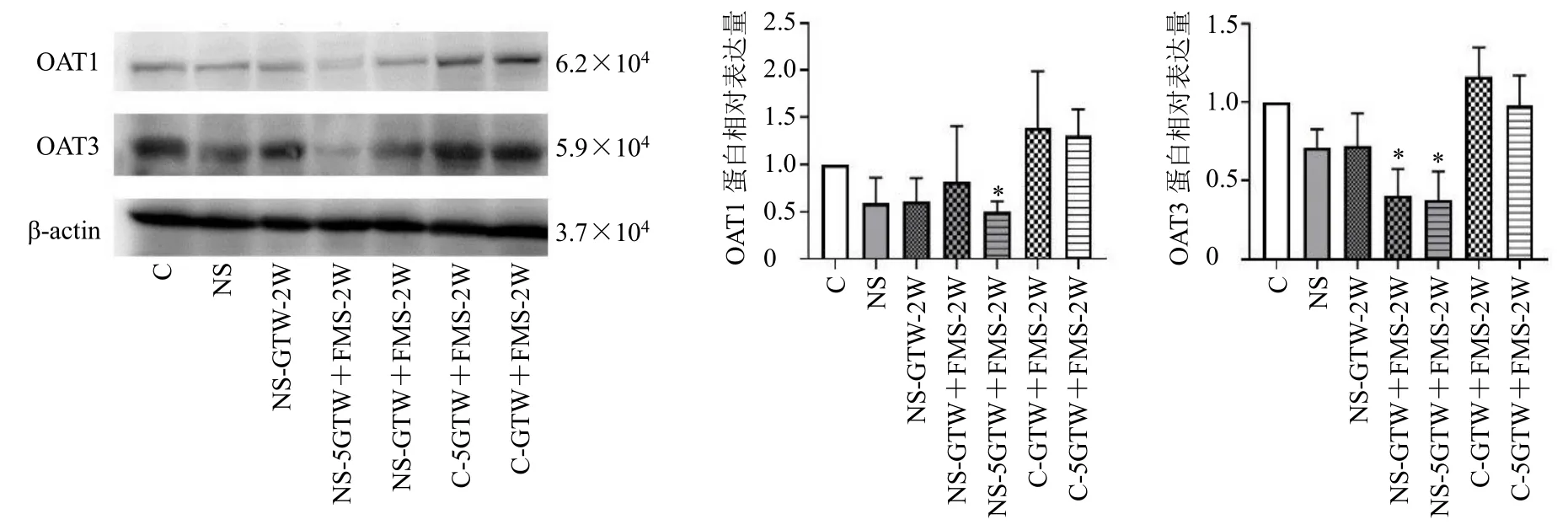
图3 各组大鼠肾脏OAT1 和OAT3 蛋白表达 (±s , n = 3)Fig.3 OAT1 and OAT3 protein expressions in kidney of rats in each group (±s , n = 3)
4 讨论
临床上使用雷公藤多苷片治疗慢性肾脏病已有超过40 年历史[9],因其疗效及毒性关系,许多团队关注其药动学及药物合用问题。Wu 等[10]对NS 大鼠雷公藤多苷片药动学进行了分析,其关于雷公藤次碱、雷公藤晋碱、雷公藤定碱和雷公藤春碱结果与本研究吻合,证实雷公藤多苷片对NS 的疗效,且出现一定程度肝损伤。本研究明确提示NS 状态下CRE、尿蛋白的升高,结合病理结果,可一定程度反映肾小球的损伤及滤过率的降低,参考其他研究中药物因患者肾小球滤过率降低而发生蓄积的现象,雷公藤多苷片成分血浆暴露升高也可能由肾小球滤过率的降低引起[11]。对于肝损伤本研究中在对照组中合用雷公藤多苷片和呋塞米,肝功能指标AST 和ALP 的活性呈现一定水平的升高,提示肝损风险,而NS 合用组未显示肝功能异常,提示NS下合用呋塞米可一定程度保护雷公藤多苷片对肝脏损伤。雷公藤多苷片暴露与剂量呈非线性,可能由于给药频率为1 次/d,瞬时浓度过高,远超机体代谢能力所致[12]。
呋塞米是OATs 的特异性底物[13],肾脏中OAT1/3富集,肾损伤时会导致OATs 表达显著下降[14];呋塞米药品说明书提示NS 状态下,由于肠壁水肿,口服吸收率会下降,这些均可能影响呋塞米药动学行为。本研究中观察到NS 组中呋塞米暴露显著降低,经雷公藤多苷片治疗后有所回升,从药动学角度分析2 药合用治疗NS,对于呋塞米有一定程度的恢复作用。既往研究表明对健康大鼠饲喂极大剂量雷公藤后表现出肾脏OAT1/3 的抑制作用[15]。但本研究应用临床治疗剂量的雷公藤多苷片干预NS大鼠可一定程度恢复其肾脏OATs 的表达,但使用高剂量并合用呋塞米后,则会明显降低OATs 蛋白表达,增加肾脏负担,提示可能存在一定风险。
综上,NS 下肾功能受损,OATs 表达下降,雷公藤多苷片成分暴露升高,呋塞米暴露降低。经正常剂量的雷公藤多苷片治疗后,OATs 表达有所恢复,CRE 水平降低,证明雷公藤多苷片对NS 的疗效,合用呋塞米可降低雷公藤多苷片过高暴露引起的肝损风险,2 药正常剂量合用安全性较好。临床实践中,需要关注病人肝、肾脏功能变化情况,恰当把控雷公藤多苷片的给药剂量和频度,并对症合用呋塞米,促进2 药合理联用。
利益冲突所有作者均声明不存在利益冲突
