有毒中药吴茱萸及减毒配伍研究探讨
2024-03-22马珍珍王秋月袁佳烨杨军令
何 宁,马珍珍,王秋月,王 婷,袁佳烨,杨军令,*,李 川,,3,4*
1.中国科学院上海药物研究所 原创新药研究全国重点实验室,上海 201203
2.天津中医药大学,天津 301617
3.中科中山药物创新研究院,广东 中山 528400
4.现代中医药海河实验室,天津 301617
中医使用有毒中药治病历史悠久、经验丰富。现存最早的本草专著《神农本草经》将其所载的365 味药材分成上、中、下品,指出:“上品无毒、多服久服不伤人,中品无毒有毒、斟酌其宜,下品多毒、不可久服”,即对于有毒中药要注意控制用药剂量和时间,并首次提出配伍减毒理论:“若有毒宜制,可用相畏相杀者”,即可利用配伍来减轻毒性。《黄帝内经·素问·六元正纪大论》中提出:“有故无殒,亦无殒也”,即“有病则病受之”,则是通过对证用药来合理使用有毒中药,讲究辨证施治、药证相符。此外,中药炮制技术通过除去毒性部位、降低毒性成分含量等方式发挥减毒增效的作用。有毒中药在传统中医药理论的指导下,不断完善其用法用量,通过多种手段来保证有毒中药在使用过程中的安全性和有效性。
吴茱萸为芸香科植物吴茱萸Euodiarutaecarpa(Juss.) Benth.、石虎E.rutaecarpa(Juss.) Benth.var.officinalis(Dode) Huang 或疏毛吴茱萸E.rutaecarpa(Juss.) Benth.var.bodinieri(Dode) Huang 的干燥近成熟果实[1],主产于贵州、湖南、四川、云南、陕西等地。吴茱萸性热,味辛、苦,有小毒,归肝、脾、胃、肾经;其功效为散寒止痛、降逆止呕、助阳止泻[1]。吴茱萸辛散苦泄,性热祛寒,主入肝经,既散肝经之寒邪,又疏肝气之郁滞,为治肝寒气滞诸痛之主药,代表方剂为吴茱萸汤(《伤寒论》);吴茱萸与黄连合用能治肝郁化火、肝胃不和、胁痛口苦、呕吐吞酸,代表方剂为左金丸(《丹溪心法》);吴茱萸还常配伍补骨脂、肉豆蔻、五味子以温肾暖脾、固涩止泻,代表方剂为四神丸(《校注妇人良方》);另外,对于冲任虚寒、瘀血阻滞之痛经者,常以吴茱萸配伍桂枝、当归、川芎等,以温经散寒、养血祛瘀,代表方剂为温经汤(《金匮要略》)。《神农本草经》中记载吴茱萸“味辛,温,主温中下气,止痛,咳逆寒热,除湿血痹,逐风邪,开腠理”,被列为中品[2]。《名医别录》《开宝本草》《本草经解》《药性论》等著作中,均有关于吴茱萸“有小毒”或“有毒”的论述[3]。《本草纲目》中对于吴茱萸毒性的描述为“多食伤神,令人起伏气,咽喉不通”“辛热,走气动火,昏目发疮”“多食冲眼又脱发也”。《本经逢原》中描述吴茱萸为“茱萸善上,故服茱萸者有冲膈、冲眼、脱发、咽痛、动火、发疮之害”[3]。
吴茱萸在临床使用中常通过配伍减毒、炮制减毒、对证用药、控制用药剂量和时间等手段保障其安全用药。在配伍减毒方面,吴茱萸常通过与甘草、大枣(辛甘相制),白芍、五味子(辛酸相制),黄连(寒热相制)等中药进行配伍而制约其毒性作用。在炮制方面,醋制和盐制可分别增强吴茱萸疏肝镇痛和引药入肾的功效(《雷公炮炙论》),黄连制使吴茱萸偏向于降逆止呕(《奇效良方》),甘草制能降低吴茱萸的毒性等[4-5]。目前《中国药典》2020 年版(以下简称药典)中仅收录1 种吴茱萸炮制品,为制吴茱萸(甘草制)。在对证用药方面,吴茱萸被多本中药书籍列为孕妇慎用药,但所谓“寒者热之,热者寒之”,临床上可用吴茱萸这味热药治疗寒症引发的妊娠恶阻,乃是对证用药、辨证施治[6]。在控制用药剂量和时间方面,吴茱萸在使用时一般会注明其剂量和疗程。例如,左金丸为口服,一次3~6 g,2 次/d,服用疗程15~30 d。
从现代药物科学的角度出发,吴茱萸含有哪些成分?给药后机体如何利用这些成分?吴茱萸的药用价值如何?毒性特点如何?毒性相关物质是什么?这些科学问题的阐释是保证吴茱萸现代临床应用安全有效的关键。药典一部共收录有毒中药83种,其中“有大毒”10 种,“有毒”42 种,“有小毒”31 种[1],对于药效确切的临床常用有毒中药,明确其毒性物质和作用机制,应当是开展现代减毒研究的基础。因此,本文系统地对吴茱萸所含的化学成分、药理作用、不良反应和毒理研究、药代特征进行阐述,并在此基础上对减毒配伍问题进行探讨,以期为吴茱萸和更多有毒中药的减毒配伍研究提供参考。
1 吴茱萸的化学成分
“物质清楚”是吴茱萸进行现代药物科学研究的前提条件,也是吴茱萸体内暴露研究、药效物质研究和毒性物质研究的基础。吴茱萸含约300 种化合物[7-39],其中生物碱类139 种、萜类35 种、黄酮类33 种、挥发油类45 种、有机酸类31 种以及其他类21 种。化合物信息见表1,其中研究较多的成分化学结构见图1。

图1 吴茱萸主要成分的结构Fig.1 Chemical structures of main constituents in Euodiae Fructus

表1 吴茱萸的化学成分Table 1 Chemical composition of Euodiae Fructus
1.1 吴茱萸药材中的化学成分
生物碱类成分是吴茱萸中种类最丰富、含量也最多的成分,主要为吲哚类生物碱(101~151)和喹诺酮类生物碱(161~228),此外还有一些喹啉类生物碱(231~237)、有机胺类生物碱(241~251)、吖啶酮类生物碱(261)及嘌呤类生物碱(271)。吴茱萸中大多为脂溶性生物碱,因此其生物碱类成分在醇提物中的含量会稍高于水提物。吴茱萸中吲哚类生物碱的代表性化合物为吴茱萸碱(115)、吴茱萸次碱(142)和去氢吴茱萸碱(105),在吴茱萸中含量也最高。其中,吴茱萸碱和吴茱萸次碱是药典中检测和鉴定吴茱萸的指标性成分,规定其按干燥品计算含吴茱萸碱和吴茱萸次碱的总量不得少于0.15%,未规定上限。其他报道较多的吲哚类生物碱还有β-卡波林(103)、吴茱萸酰胺(114)、吴茱萸酰胺I(120)、吴茱萸酰胺Ⅱ(121)、羟基吴茱萸碱(124、125)、羟基吴茱萸次碱(129~132)等。吴茱萸中喹诺酮类生物碱的代表成分为二氢吴茱萸卡品碱(162)和吴茱萸卡品碱(168)。除此之外,1-甲基-2-壬基-4(1H)-喹诺酮(196)、1-甲基-2-十五烷基-4(1H)-喹诺酮(210)、1-甲基-2-十一烷基-4(1H)-喹诺酮(226)等也是报道较多的成分。喹啉类生物碱中的白鲜碱(231)、6-甲氧基白鲜碱(235),有机胺类生物碱辛弗林(249)等也是被研究较多的成分。吴茱萸药材按照果实的大小,可分为“大花吴茱萸”“中花吴茱萸”和“小花吴茱萸”[40]。研究发现吴茱萸药材中吴茱萸碱、吴茱萸次碱和吴茱萸卡品碱的含量会随吴茱萸果实减小而减少,小花吴茱萸中甚至有一部分商品的吴茱萸碱和吴茱萸次碱总含量在药典规定含量以下。而1-甲基-2-壬基-4(1H)-喹诺酮和1-甲基-2-十一烷基-4(1H)-喹诺酮的含量则是小花吴茱萸最高,大花吴茱萸次之,中花吴茱萸最低[41-43]。
吴茱萸中含有三萜类成分,并以柠檬苦素类成分(301~330)为主,其代表性化合物是柠檬苦素(322)和吴茱萸苦素(328),除此以外还有吴茱萸内酯醇(310)、黄柏酮(325)等。柠檬苦素也是药典中规定的吴茱萸指标性成分,其按干燥品计算含量不得少于0.20%。柠檬苦素类成分是一种高度氧化的四环三萜,同时具有标志性的呋喃环结构,相对分子质量为454~668,因其脂溶性普遍较高,通常用醇溶剂对其进行提取。小花吴茱萸和中花吴茱萸中柠檬苦素的含量都比较高,分别约为0.74%和0.65%,而大花吴茱萸中的柠檬苦素含量仅为0.24%。
吴茱萸中还含有较多的黄酮类成分,其中以黄酮醇类(401~424)为主。黄酮醇类成分多为槲皮素、异鼠李素、柠檬黄素的苷和苷元,苷类成分多连接O-葡萄糖、O-木糖,也有连接O-半乳糖、O-鼠李糖、O-芸香糖和O-桑布双糖。报道较多的黄酮醇类成分包括槲皮素(416)、槲皮素-3-O-α-D-吡喃阿拉伯糖苷(417)、金丝桃苷(418)、异槲皮素(419)、芦丁(423)、异鼠李素(402)、异鼠李素-3-O-β-D-半乳糖苷(403)、异鼠李素-3-O-芸香糖苷(405)、柠檬黄素-3-O-芸香糖苷(411)等。吴茱萸中的黄酮类成分除了黄酮醇类,还有黄酮类的香叶木苷(433)、二氢黄酮类的橙皮苷(443)、二氢黄酮醇类的香树素-7-O-β-D-葡萄糖苷(451)、黄烷醇类的儿茶素(461)等。
吴茱萸具有浓郁而芳香的气味,是由于其含有挥发油成分。吴茱萸的挥发油成分主要为单萜(501~513)和倍半萜(521~539),另外还有一些脂肪族(541~550)和芳香族(561~563)成分。吴茱萸挥发油中主要成分为单萜类成分月桂烯(507)、(E)-罗勒烯(508)、(Z)-罗勒烯(509)和倍半萜类成分β-石竹烯(525)、β-榄香烯(528)等。
吴茱萸还含有一些有机酸类成分,相对分子质量为180~373,包括咖啡酸(601)、绿原酸(613)、隐绿原酸(615)、新绿原酸(629)、柠檬酸(614)、异柠檬酸(627)、阿魏酸(617)、反式咖啡酰葡萄糖酸(603~607)和阿魏酰葡萄糖酸(618~621)等。
除上述成分以外,吴茱萸还含有蒽醌类(701~703)、甾体类(711~713)等其他成分。
1.2 炮制加工对吴茱萸成分的影响
吴茱萸生品和炮制品在临床上都有使用,药典共收载吴茱萸复方制剂22 个,其中有7 个复方使用了生品吴茱萸,12 个复方使用了制吴茱萸(甘草制),还有3 个复方使用了盐制吴茱萸[1]。除了上述炮制品外,沿用至今的吴茱萸炮制品还有醋制吴茱萸、酒制吴茱萸、姜制吴茱萸、黄连制吴茱萸等[4,44]。吴茱萸炮制品与生品在化学成分的种类上并没有明显不同,仅在成分含量上有差异。
在生物碱成分方面,张晟瑞[45]比较了吴茱萸生品和炮制品用70%乙醇提取后主要生物碱的含量变化,发现甘草制和盐制使吴茱萸中的吴茱萸碱(2.43%)分别下降至0.86%和1.73%,使吴茱萸次碱(1.52%)分别下降至0.8%和1.04%。刘舒凌等[46]发现,与生吴茱萸相比,盐炙、醋炙和酒炙能使吴茱萸碱(生品中0.44%)的含量轻微下降(分别下降至0.42%、0.40%和0.39%),甘草制、黄连炙和姜炙则能使吴茱萸碱的含量明显下降(分别下降至0.38%、0.35%和0.32%);而炮制对吴茱萸次碱含量的影响却并不明显(生品中质量分数0.14%,上述几种炮制品中质量分数为0.11%~0.15%)。
在三萜类成分方面,刘舒凌等[46]发现,除黄连炙会使吴茱萸中柠檬苦素含量有所升高外(从1.21%升高至1.27%),其他炮制品中柠檬苦素的含量都呈下降趋势(下降至1.13%~1.16%)。张晟瑞[45]也发现,甘草制和盐炙分别可使吴茱萸中的柠檬苦素质量分数(2.00%)下降至1.37%和1.87%。刘湘丹等[47]发现甘草制吴茱萸中柠檬苦素的含量较生品显著减少,并推测可能是由于柠檬苦素具有内酯结构,甘草中的一些成分可能会催化柠檬苦素的酯键水解,导致炮制后柠檬苦素含量下降。
在黄酮类成分方面,甄攀等[48]测定了吴茱萸及其炮制品(甘草炙吴茱萸、盐炙吴茱萸、酒炙吴茱萸、醋炙吴茱萸、姜炙吴茱萸)中总黄酮含量,结果显示,吴茱萸不同炮制品中总黄酮质量分数为29.39~59.64 mg/g,与生吴茱萸中总黄酮含量(57.25 mg/g)相比,除了酒炙能使吴茱萸中黄酮类成分含量略微上升(59.64 mg/g),其他炮制方法都能使吴茱萸中黄酮类成分有不同程度的减少,其中甘草炙和姜炙使吴茱萸中黄酮类成分降低最多(分别降至48.36、48.78 mg/g)。
在挥发油成分方面,刘舒凌等[46]研究发现,不同辅料炮制后,吴茱萸挥发油总量均有所下降,吴茱萸生品和各炮制品的挥发油含量顺序为生吴茱萸(3.60%)>醋炙吴茱萸(3.25%)>盐炙吴茱萸(3.20%)>姜炙吴茱萸(3.15%)>甘草制吴茱萸=酒炙吴茱萸=黄连炙吴茱萸(2.85%)。陈炯等[49]同样对吴茱萸及其炮制品中的挥发油含量进行了测定,结果中炮制品的挥发油含量虽有所下降,但其挥发油总含量和挥发油含量顺序却与刘舒凌的研究有些许差异:生吴茱萸(0.71%)>姜炙吴茱萸(0.69%)>黄连炙吴茱萸(0.65%)>黄酒炙吴茱萸(0.63%)>醋炙吴茱萸(0.59%)=盐炙吴茱萸(0.59%)>甘草制吴茱萸(0.51%)。张晓凤等[50]采用水蒸气蒸馏法提取生吴茱萸和甘草制吴茱萸挥发油,并用GC-MS 法鉴定化学成分,结果吴茱萸生品和炮制品挥发油收率分别为0.75%和0.65%,其主要成分为罗勒烯、月桂烯、β-榄香烯、β-石竹烯等。
另外,杨文惠等[51]和张敏[52]指出,在甘草制吴茱萸中能够检测到来源于甘草的成分,为甘草苷、甘草酸和甘草次酸。
1.3 含吴茱萸的不同中药制剂间吴茱萸成分的剂量差异
目前药典中收载的含吴茱萸的中药制剂都未对制剂中吴茱萸的成分含量有明确的规定,但许多学者呼吁对制剂中吴茱萸的成分含量进行测定以更好地实现制剂的质量控制和保障临床用药安全[53-54]。
国内学者先后对左金丸[55-58]、香连丸[58]、左金胶囊[55,59]、四神片[60]、荜铃胃痛颗粒[61]、华佗再造丸[62]等中成药制剂中吴茱萸成分的含量进行了分析,制剂中吴茱萸成分的日服剂量(成分日服剂量=制剂日服剂量×成分在制剂中的含量)如表2 所示。相比于成分在制剂中的含量,成分日服剂量能更好地反映出制剂中各个成分的实际给药量,有利于比较同一个成分在不同制剂中给药剂量的差异[63]。对制剂中吴茱萸成分含量分析时,一般会选取吴茱萸碱、吴茱萸次碱、去氢吴茱萸碱和柠檬苦素作为表征吴茱萸成分的指标性化合物;且不同中药制剂之间吴茱萸成分含量差距很大,即使是同一种制剂,不同厂家和批次之间吴茱萸成分含量的差距也很大。

表2 含吴茱萸的不同中药制剂中吴茱萸成分的剂量及差异Table 2 Dosage and difference of components in different Chinese patent medicines containing Euodiae Fructus
2 吴茱萸的药理作用
吴茱萸的药理作用研究对指导其临床合理用药、发挥其有效性具有重要作用。因此,国内外学者采用多种现代科学的手段,对吴茱萸的药理活性展开了研究。
2.1 吴茱萸提取物的药理作用
现代研究发现,吴茱萸具有多种药理活性,主要包括抗炎、心血管保护、抗肿瘤,还包括维持中枢神经系统稳态、抗菌、抗氧化等活性[7,64]。Ko 等[65]研究发现,吴茱萸醇提物对佛波醇和甲酰甲硫亮氨酰苯丙氨酸诱导的中性粒细胞活性氧生成具有较强的抑制作用,半数抑制浓度(half maximal inhibitory concentration,IC50)为2.7~3.3 μg/mL;还能抑制脂多糖诱导的NO 生成(IC50约为0.8 μg/mL)和小胶质细胞中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的上调,说明吴茱萸具有抗炎作用,且其抗炎作用可能与抑制活性氧生成及iNOS 依赖性炎症细胞中NO 生成的作用相关。另外,Yu 等[66]发现,吴茱萸具有止泻作用,其水提物对蓖麻油致腹泻的ICR 小鼠具有明显的治疗作用,IC50为(76±17)mg/kg。吴茱萸还具有心血管药理活性,Hibino 等[67]研究了吴茱萸水提物对离体的雄性Wistar 大鼠主动脉的收缩作用,结果发现吴茱萸水提物在3×10−6~3×10−4g/mL 质量浓度内,对大鼠主动脉有明显的收缩作用,这种作用可能与肾上腺素能受体和血清素受体有关。除此之外,吴茱萸还具有抗肿瘤活性。Park 等[68]研究发现吴茱萸70%乙醇提取物在20~60 μg/mL 时能够显著降低人宫颈癌HeLa 细胞的活力,并且呈一定的浓度相关性。
吴茱萸提取物作为混合物所表现的药理活性是其所含的各种化学成分药理活性的集中表现。长期以来,吴茱萸碱和吴茱萸次碱被认为是吴茱萸产生药理作用的最重要成分[9]。因此对于吴茱萸的药理学研究多集中在这2 个吲哚类生物碱成分上。
2.2 吴茱萸碱和吴茱萸次碱的药理作用
吴茱萸碱与吴茱萸次碱的结构非常相似,因此吴茱萸碱与吴茱萸次碱有许多相似的药理作用,包括抗炎、抗菌、抗肿瘤、心脏保护和神经保护等活性[69-71],体现了其单药多靶效应。
抗炎活性是吴茱萸碱和吴茱萸次碱被研究最多的药理活性。吴茱萸碱和吴茱萸次碱主要通过3 条通路发挥抗炎活性,包括调节活性氧的产生、环氧化酶(cyclooxygenase,COX)相关的酶级联反应、以及核因子-κB(nuclear factor-κB,NF-κB)信号通路[7],但是两者作用的具体靶标有所不同。吴茱萸碱和吴茱萸次碱均能通过抑制烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶的活化和iNOS 依赖性NO 的产生而发挥抗炎作用[65];吴茱萸碱还可以通过干扰γ 干扰素启动的信号对小鼠巨噬细胞样细胞系RAW 264.7 中iNOS基因的转录激活进行干扰,从而抑制NO 的产生,抑制巨噬细胞的激活,以达到抗炎的效果[72]。Liu 等[73]发现吴茱萸碱通过阻断RAW264.7巨噬细胞中蛋白激酶B 和p70 核糖体蛋白S6 激酶的磷酸化,抑制缺氧诱导的COX-2 表达和缺氧诱导因子-1α 的积累,从而达到抗炎效果。而吴茱萸次碱则是COX-2 的选择性抑制剂,能剂量相关性地抑制小鼠肥大细胞中外源花生四烯酸向COX-2的转化[74]。另外,吴茱萸碱可以通过下调NF-κB 信号通路和NOD 样受体热蛋白结构域蛋白3 炎症小体,以及减少肿瘤坏死因子-α、白细胞介素-1β(interleukin-1β,IL-1β)和IL-6 的分泌来改善葡聚糖硫酸钠诱导的溃疡性结肠炎[75];吴茱萸次碱则可以通过下调α 干扰素、IL-23 p19 和IL-17A 的蛋白表达,并通过NF-κB 和Toll 样受体7 信号通路减少牛皮癣样皮炎小鼠的炎症反应[76]。研究发现,吴茱萸碱在心脑血管疾病(如动脉粥样硬化[77])、神经系统疾病(如神经退行性疾病[78])、胃肠道疾病(如胃溃疡[79]、结肠炎[75])、关节炎[80]、肿瘤发生(如卵巢癌[81]、肺癌[82])中都能够起到一定的抗炎作用。其在临床的应用也与抗炎作用相关,吴茱萸碱可以抑制皮肤炎症[83],故将其用于治疗原发性红热性红斑痛和雷诺综合征;吴茱萸碱还可以作为抗炎剂与3,3′-二吲哚甲烷联合使用,预防口腔黏膜疾病如牙周炎、牙龈炎或其他相关的口腔黏膜炎症[83]。
吴茱萸碱的抗肿瘤活性也得到了大量关注[84]。吴茱萸碱的抗肿瘤活性是区别于吴茱萸传统用药的体现,研究发现,吴茱萸碱主要通过诱导细胞凋亡[84-85]、阻断细胞周期[86-87]、调节细胞自噬[88-89]、抑制肿瘤细胞转移[90]4 个方面来发挥抗肿瘤作用[7]。吴茱萸提取物具有抗肿瘤相关的药理作用也主要与吴茱萸碱相关,说明中药在现代应用和研究的过程中,有更多新的活性有待被发现。
吴茱萸次碱的心血管保护作用也是被研究最多的药理活性之一。研究发现,吴茱萸次碱的心脏保护作用是由瞬时受体电位香草素1(transient receptor potential vanilloid1,TRPV1)和降钙素基因相关肽(calcitonin gene-related peptide,CGRP)介导产生的。TRPV1 又称辣椒素受体,是一种非选择性的阳离子通道,对Ca2+的通透性高于其他阳离子[91],在心脏[92]、血小板[93]和内皮细胞[94]中具有高表达。研究发现,吴茱萸次碱和辣椒素具有相同的结合位点[95],能够激活TRPV1 通道[96],引起细胞内阳离子浓度升高,从而调节心脏功能、缓解心肌缺血[97],还能够阻断动脉粥样硬化、高血压和心肌损伤的发展[98]。CGRP 在神经和心血管系统中同样广泛表达,可以作为一种有效的血管扩张肽,发挥血管保护作用[99]。Yi 等[100]发现吴茱萸次碱能够显著提高心脏过敏模型中冠状动脉流出液中的CGRP 的含量并显著改善心功能、消除过敏反应,且吴茱萸次碱对心脏过敏反应的保护作用能够被CGRP8-37(一种选择性CGRP 受体拮抗剂)所消除。Hu 等[101]研究发现给予1.0 μmol/L 的吴茱萸次碱可以显著改善豚鼠心脏低温缺血再灌注时心功能的恢复、减少肌酸激酶的释放,3.0 μmol/L 吴茱萸次碱可以显著降低肌酸激酶的释放,增加冠状动脉血流,且这种改善作用可以被竞争性TRPV1 拮抗剂capsazepine 和CGRP8-37消除。另外,吴茱萸次碱能够剂量相关地促进背根神经节中CGRP 的合成和释放,而这种促进作用能够被capsazepine 阻断[96]。这些结果说明,吴茱萸次碱激活TRPV1 受体进一步促进CGRP 的合成和释放,并由此发挥心脏保护作用[102]。
2.3 吴茱萸其他成分的药理作用
除了吲哚类生物碱吴茱萸碱、吴茱萸次碱以外,吴茱萸有机胺类生物碱成分辛弗林能够在0.3~30 μg/mL 质量浓度时,通过肾上腺素能和血清素受体的作用,使大鼠主动脉明显收缩,可能是吴茱萸发挥收缩血管功能的主要成分之一[67]。吴茱萸的三萜类成分柠檬苦素能通过NF-κB、丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)、和Janus 激酶(Janus kinase,JAK)/信号转导和转录激活因子( signal transducer and activator of transcription,STAT)信号通路发挥抗炎、抗癌、镇痛和抗菌活性等,但由于其水溶性差和生物利用度较低的问题未能得到很好的应用[103]。
3 吴茱萸的不良反应
3.1 含吴茱萸复方的临床不良反应报道
药典中规定吴茱萸的用量为2~5 g,外用适量[1]。临床上常因超剂量服用吴茱萸而产生中毒现象[104-105]。安俊丽等[106]统计分析发现2019—2021年首都医科大学附属医院北京儿童医院开具的中药饮片处方中,涉及毒性中药饮片的处方共18 680 张,其中毒性中药饮片超剂量使用处方条目共161 条,制吴茱萸以21%的使用率位列第1。蔡雪映等[107]报道,2004 年1 位女性患者因胃脘胀满、恶心反酸、呃逆而服用中草药配方(吴茱萸2 g、柴胡10 g、枳壳15 g、香附15 g、黄连6 g、蒲公英25 g、银花15 g、乌贼骨12 g、炒白术10 g、车前子包10 g、炒麦芽10 g,水煎服,每日1 剂),但是由于医生错将此方中“吴茱萸2 g”抄写为“吴茱萸12 g”,导致患者食用吴茱萸过量而出现严重的不良反应,患者服用第3 剂后出现剧烈腹痛、头痛、晕厥、呕吐胃内容物、视物不清、错觉、胸闷等症状,并送医院急救,血清检查发现,患者血清中含有吴茱萸碱。该患者出现不良反应是口服吴茱萸过量或积蓄中毒所致。另外,马锐等[108]报道有患者人工流产1 周后,开始口服中药颗粒剂(补骨脂10 g、吴茱萸3 g、豆蔻6 g、黄芪30 g、山药10 g、炒白芍6 g、当归15 g、熟地黄10 g、川芎6 g、丹参10 g、桃仁6 g、甘草6 g,每日2 剂),连续口服13 d 后,患者出现发热、恶心、呕吐等症状,肝功能指标异常,临床确诊为中药颗粒剂致肝脏损害。此例中,有毒中药补骨脂和吴茱萸的日服剂量分别为20 g和6 g,都超过了药典规定的最高用量(补骨脂为10 g,吴茱萸为5 g),患者的肝损伤可能是由于服用补骨脂和吴茱萸过量,也有可能是有毒中药的联合使用加重了毒性反应。
3.2 吴茱萸提取物及成分的毒理研究
吴茱萸组分能够造成实验动物的肝脏损伤,主要表现为血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)等指标的升高。孙蓉团队研究发现,昆明小鼠单次ig 给予吴茱萸挥发油成分0.08~1.35 μL/g,给药后6 h 的血清ALT、AST 显著升高,并呈现出明显的剂量-效应关系;1.35 μL/g 给药后,0.5 h 时血清ALT、AST 开始明显升高,并在6 h 时达到峰值(分别约为对照组的6 倍和3.2 倍),毒性时间可持续72 h[109]。此外,昆明小鼠单次 ig 2.1~32.5 mg/g(相当于人口服0.175~2.7 g/kg)的吴茱萸水提组分后,给药后2 h可检测到血清ALT、AST 的显著升高,并且随着给药剂量的上升呈现出明显的剂量-效应关系;肝组织病理学检查显示,吴茱萸水提组分可在8~72 h 内对肝组织产生明显损伤[110]。另外,连续7 d ig 给予昆明小鼠0.63、2.5、5.0 mg/g 3 个剂量吴茱萸水提组分(相当于人口服0.056、0.208、0.417 g/kg),结果发现,给药第1天,3 个剂量组的小鼠血清中ALT、AST 均开始有不同程度的升高,随着给药量的增加或给药时间的增加,小鼠肝损伤指标呈现不同程度的非线性“累加效应”,病理组织学检测出现不同程度的肝细胞水肿和脂肪变性、间质充血,并且呈现一定的“量-时-毒”关系[111]。另外,斑马鱼在肝脏结构和功能上与哺乳动物具有相似性,使其在肝毒性药物的高通量筛选中脱颖而出。范琦琦等[112]利用斑马鱼模型,给予亚致死剂量[<10%致死浓度(LC10),600、700、800 μg/mL]的吴茱萸水提物,24 h 后斑马鱼整体ALT、AST 的活性显著升高;给予800 μg/mL 吴茱萸水提物后,斑马鱼肝脏部位明显受损,出现组织结构松散、肝细胞空泡化、细胞凋亡增加的现象。
吴茱萸造成的肝脏损伤具有一定的可恢复性,停药恢复一段时间后,肝损伤的程度有明显的下降。李波等[113]观察到单次ig 给予SD 大鼠吴茱萸70%乙醇提取物15、30、60 mg/g(相当人口服2.5、5、10 g/kg)后的第3 天,中、高剂量组的大鼠肝脏系数较对照组分别增加了65.2%和72.9%,而给药后第14 天,仅高剂量组的肝脏系数较对照组有明显升高(增加了12.1%);给药后第3 天肝组织病理检查发现各个剂量组均可见部分动物中央静脉、小叶下静脉周围肝细胞显疏松及灶性坏死,且剂量越大中央静脉周围肝细胞变性坏死的程度越大,高剂量组中有40%的动物出现中央静脉周围肝细胞片块状变性、坏死;而给药后14 d,仅中、高剂量组大鼠肝脏病理检查发现部分动物肝组织结构较紊乱,中央静脉周围肝细胞显疏松变性、灶性坏死,未见片块状肝细胞坏死。刘颖等[114]连续28 d ig 给予SD 大鼠2.50、6.66、20.83 mg/g 吴茱萸醇提物(相当于人口服0.42、11.1、34.7 g/kg),随后停药恢复14 d。肝脏切片光镜检查发现,给药结束时高剂量组肝细胞变性肿胀、炎细胞浸润,中、低剂量组与对照组则无明显差异;恢复期后高剂量组恢复正常。肝脏切片的电镜检查发现,给药结束时低剂量组肝细胞内出现了脂质空泡、毛细血管扩张、肝血窦内皮细胞肿胀,中剂量组肝血窦内皮细胞有不明物质(疑似胆汁),高剂量组肝细胞线粒体轻微肿胀伴有内质网扩张、肝血窦内皮细胞线粒体肿胀且内有空泡;恢复期结束时上述症状均有减轻。
吴茱萸诱发的肝损伤可能与细胞色素P450(cytochrome P450,CYP450)3A4 及其代谢激活产生的反应性代谢物有关[115-119],吴茱萸所含成分中吲哚类生物碱含有的3-烷基吲哚结构、柠檬苦素类化合物含有的呋喃结构是有可能产生反应性代谢物的警报结构[120]。反应性代谢物是化合物在代谢激活过程中产生的一种亲电性中间体,当细胞内具有抗氧化活性的谷胱甘肽(glutathione,GSH)充足时,GSH 能够与反应性代谢物快速反应生成稳定的结合物;而当细胞内GSH 含量不足时,反应性代谢物则会攻击细胞内的生物大分子(如DNA 或蛋白质),从而导致细胞功能障碍或刺激免疫反应[121]。Wen 等[118]研究发现,吴茱萸碱和吴茱萸次碱中的3-烷基吲哚部分通过肝微粒体中CYP450(主要由CYP3A4 催化,较小程度由CYP1A2 和CYP2D6 催化)介导的氧化反应生成高度亲电的中间体3-亚甲基吲哚胺和亚胺喹酮,在GSH 耗竭时产生毒性损伤肝细胞。Liu 等[116]发现,柠檬苦素类化合物吴茱萸苦素能够在大鼠和人肝微粒体的孵育下,代谢生成反应性代谢物顺丁烯-1,4-二酮中间体,从而被GSH 捕获,且其代谢激活过程主要是由CYP3A4 介导。Zhang 等[117]研究发现,CYP3A4 的诱导剂地塞米松可加重吴茱萸提取物对L-02 细胞(人正常肝细胞)的细胞毒性,而CYP3A4 的抑制剂酮康唑可减轻吴茱萸提取物的细胞毒性。
目前在吴茱萸肝毒性物质研究方面,主要有2种思路:一种是使用吴茱萸所含的单体成分进行体外或体内实验,以验证单个化合物是否具有毒性。例如,Li 等[122]采用L-02 细胞进行体外实验,发现吴茱萸碱和吴茱萸次碱能诱导ALT、AST释放增加;Wang 等[38]用2-O-反式-咖啡酰葡萄糖酸(603)、3-O-反式-咖啡酰葡萄糖酸(604)和4-O-反式-咖啡酰葡萄糖酸(605)的混合物进行12 h 的肝毒性验证实验,其IC50为319.8 μmol/L,表明其混合物对L02细胞具有一定的毒性,但由于这类化合物在吴茱萸中含量较低,IC50也相对比较大,可能无法在体内达到产生毒性的浓度。另一种思路是基于谱毒关系,依据不同来源的药材中各个成分含量的差异以及不同来源药材给药后体内或体外毒理学实验数据,开展统计学分析建立谱-毒关系,以推测毒性相关的成分。Zhang 等[43]分析了市面上流通的39 批次吴茱萸药材并建立了UPLC 指纹图谱,然后结合不同批次吴茱萸给药后L02 细胞活性的测定结果,建立谱-毒关系,指出吴茱萸碱(115)是吴茱萸主要的肝毒性成分,1-甲基-2-壬基-4(1H)-喹诺酮(196)和1-甲基-2-十一烷基-4(1H)-喹诺酮(226)也是值得关注的毒性成分。此外,柠檬苦素(322)作用与吴茱萸碱相反,可能是潜在的保肝成分。另外,Liang 等[123]还基于谱-毒性关系的UHPLC-QTOF/MS 筛选,提出二氢吴茱萸卡品碱(162)、吴茱萸卡品碱(168)、1-甲基-2-十一烷基-4(1H)-喹诺酮(226)、1-甲基-2-[(6Z,9Z,12E)-6,9,12-十五三烯基]-4(1H)-喹诺酮(199)、1-甲基-2-[(Z)-7-十三烯基]-4(1H)-喹诺酮(215)、1-甲基-2-十四烷基-4(1H)-喹诺酮(213)、松柏苷(724)也有可能与吴茱萸诱导的肝毒性相关,柠檬苦素(322)、吴茱萸苦素(328)、6α-乙酰氧基-5-表柠檬苦素(301)可能是潜在的保肝成分。需要注意的是,基于谱-毒关系的肝毒性研究,仅仅研究了中药化学成分与肝损伤的关系,而并不涉及物质体内过程的研究,因此谱-毒关系的研究结果可能难以向临床研究转化。
综上所述,吴茱萸单次或长期给药均能够诱导实验动物的肝脏损伤,且损伤具有一定的可恢复性。其毒性作用可能是由吴茱萸吲哚类生物碱吴茱萸碱、吴茱萸次碱和三萜类化合物柠檬苦素的代谢激活产生的反应性代谢物所导致的。因此,吴茱萸碱和吴茱萸次碱可能是吴茱萸产生肝毒性的主要物质,而柠檬苦素则由于其在谱-毒关系研究中表现出与吴茱萸碱相反的活性,需要进一步研究其和毒性作用的关系。
4 吴茱萸成分的药动学特征
在药物作用于机体的同时,机体也在作用于药物。吴茱萸给药后能在机体产生系统暴露的成分与药材或提取物中所含成分有可能不同,要真正揭示吴茱萸的毒性物质基础,就需要明确有哪些成分能够被机体利用产生显著的体内暴露,体内过程中的代谢环节是否可能致毒以及体内暴露物质相关的药物相互作用(drug-drug interaction,DDI)是否能在联合用药时导致毒性的发生。
4.1 口服给药后吴茱萸成分的体内暴露
药动学首先需要明确的是给药后有哪些物质能够产生体内暴露,关注上述与药效或毒性相关的物质的体内浓度水平。张红梅等[124]开展了吴茱萸在大鼠体内吸收分布情况的研究,连续3 d、每天2 次ig给予SD 大鼠吴茱萸80%乙醇提取物(品种为石虎,相当于8 g/只)后,吴茱萸入血活性成分主要为吴茱萸碱、吴茱萸次碱和柠檬苦素,并且在肺和肝内分布程度最高。程宇欣等[125]采用UHPLC-QTOFMS 技术对吴茱萸水提物ig 给药后雄性SD 大鼠(给药剂量5 mg/g)体内的原型成分及其代谢产物进行了定性分析,发现大鼠血浆中吴茱萸卡品碱和双羟基吴茱萸卡品碱主要以原型形式存在,而吴茱萸碱、吴茱萸次碱、柠檬苦素和去氢吴茱萸碱则主要以代谢物的形式存在。另外,Zhang 等[115]ig 给予雄性SD大鼠吴茱萸50%乙醇提取物(相当于25 mg/g),吴茱萸碱、吴茱萸次碱、1-甲基-2-壬基-4(1H)-喹诺酮、1-甲基-2-十一烷基-4(1H)-喹诺酮和吴茱萸卡品碱均能产生明显的系统暴露,其中吴茱萸碱的达峰时间(tmax)为(0.10±0.09)h、半衰期(t1/2)为(3.3±1.2)h。Wang 等[126]报道,雄性SD 大鼠ig 30 mg/kg 吴茱萸碱单体成分后,其tmax为(3.38±1.15)h、t1/2为(2.71±0.64)h。可见提取物给药时吴茱萸碱的tmax较单体给药明显缩短,t1/2却有所延长,这可能与提取物中所含的其他成分有关。
由此可见,吴茱萸提取物大鼠ig 给药后,吴茱萸碱和吴茱萸次碱能够以原型或代谢物的形式在血浆中产生暴露,其主要分布的部位是肺和肝脏。吴茱萸碱和吴茱萸次碱既是药效学研究中体现活性的成分,又是一些毒理学研究中可能产生肝毒性的成分,并且在其毒性部位肝脏中能够暴露。此外,柠檬苦素是谱-毒关系研究中被指出具有保肝作用的物质,其在肝脏中也有一定的暴露。因此,在吴茱萸药动学的研究中应重点关注吴茱萸碱和吴茱萸次碱的体内浓度及其在体内被代谢激活生成反应性代谢物的情况,还应关注柠檬苦素是否能够影响吴茱萸碱和吴茱萸次碱在肝脏产生毒性的关键环节,以保证吴茱萸碱和吴茱萸次碱在安全窗范围内合理用药。
4.2 吴茱萸成分的代谢转化
药物代谢会影响机体内物质的暴露形式,代谢过程还可能对药效和毒理作用产生影响,因此需要了解吴茱萸物质的代谢转化。
吴茱萸碱具有较为明显的首过效应,进入肝脏后迅速通过氧化、N-去甲基化、脱氢、葡萄糖醛酸化、硫酸酯化和谷胱甘肽结合生成多种代谢产物[127],主要为10-羟基吴茱萸碱、3-羟基吴茱萸碱,以及这2种代谢产物的葡萄糖醛酸结合物[126,128]和硫酸酯结合物[128]。Zhang 等[127]利用人肝细胞悬浮液和人肝微粒体在体外进行吴茱萸碱的代谢转化,在人肝微粒体中共检测到12 种I 相代谢物,而在人肝细胞中共检测到19 种代谢物,除了肝微粒体中检测到的12 种I 相代谢物,还包括7 种II 相代谢物。吴茱萸碱的代谢途径如图2 所示。除此之外,Sun 等[129]利用人重组CYP450 亚型对代谢吴茱萸碱的代谢酶进行了探究,发现吴茱萸碱的氧化代谢主要由CYP3A4、CYP1A2 和CYP2C9 介导。
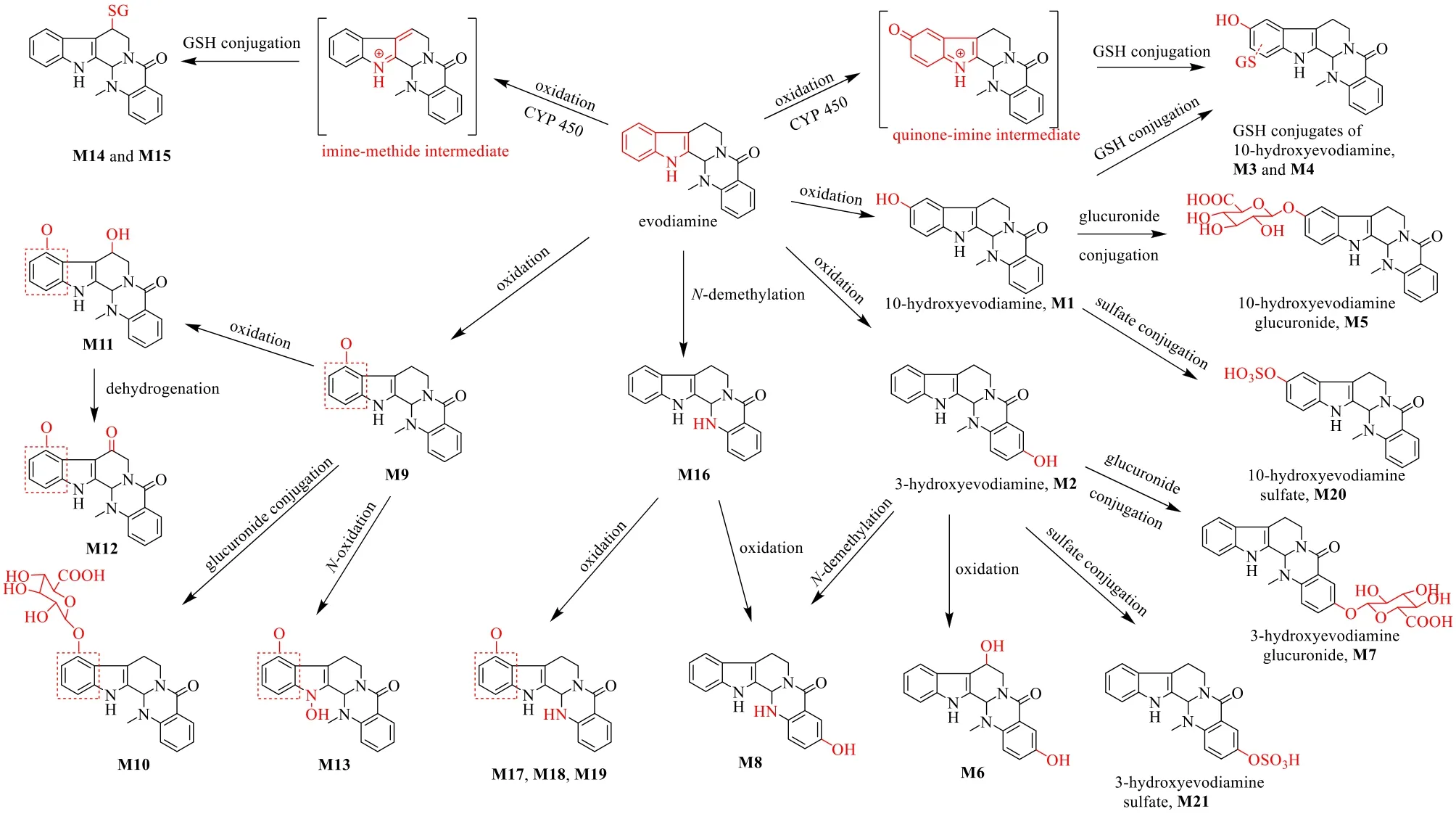
图2 吴茱萸碱的代谢途径Fig.2 Proposed metabolic pathways of evodiamine
吴茱萸次碱在肝脏中的代谢主要包括羟基化、葡萄糖醛酸化以及硫酸酯化。Lee 等[130]利用人肝微粒体进行体外实验发现,吴茱萸次碱在人肝微粒体中主要被代谢为6 种单羟基吴茱萸次碱(图3 中M1~M6),CYP3A4 在人肝微粒体中吴茱萸次碱的代谢中起主要作用,CYP1A2 和CYP2C9 在吴茱萸次碱的代谢中起次要作用。Ueng 等[131]研究了吴茱萸次碱在大鼠肝微粒体中的代谢,发现吴茱萸次碱在大鼠肝微粒体中主要被代谢为4 种单羟基化合物(图3 中M1、M3、M5 和M6)。此外,Lee 等[132]在雄性SD 大鼠iv 4 mg/kg 吴茱萸次碱后,在尿液中鉴定出8 种I 相代谢物,包括4 种单羟基代谢物(图3 中M3~M6)、4 种双羟基代谢物(图3 中M7~M10)和8 种II 相代谢物,包括4 种葡萄糖醛酸结合物(图3 中MG1~MG4)和4 种硫酸酯结合物(图3 中MS1~MS4)。

图3 吴茱萸次碱的代谢途径Fig.3 Proposed metabolic pathways of rutaecarpine
Liu 等[133]研究了柠檬苦素在大鼠肝微粒体中的代谢及在大鼠ig 柠檬苦素(6 μg/g)后的体内代谢转化,结果在大鼠肝微粒体中可以检测到3 种柠檬苦素的代谢物(图4 中M1~M3),尿液中可以检测到5 种代谢物(图4 中M1~M5),其中4 种也可以在大鼠胆汁中检测到(M2 除外)。3 种样品中均未检测到II 相代谢物。Liu 等[134]采集了人服用柠檬苦素(120 mg)后的尿液和粪便样品以及柠檬苦素和人肠道细菌共培养样本,利用HPLC-Q-TOFMS 对其中的柠檬苦素代谢物进行分析和鉴定,在人的尿液和粪便样本中共鉴定出3 种代谢物(图4中M1、M2 和M4),在肠道菌样本中共鉴定7 种代谢物(图4 中M1~M7),由此发现柠檬苦素的代谢主要通过还原、水解和甲基化3 种途径进行。
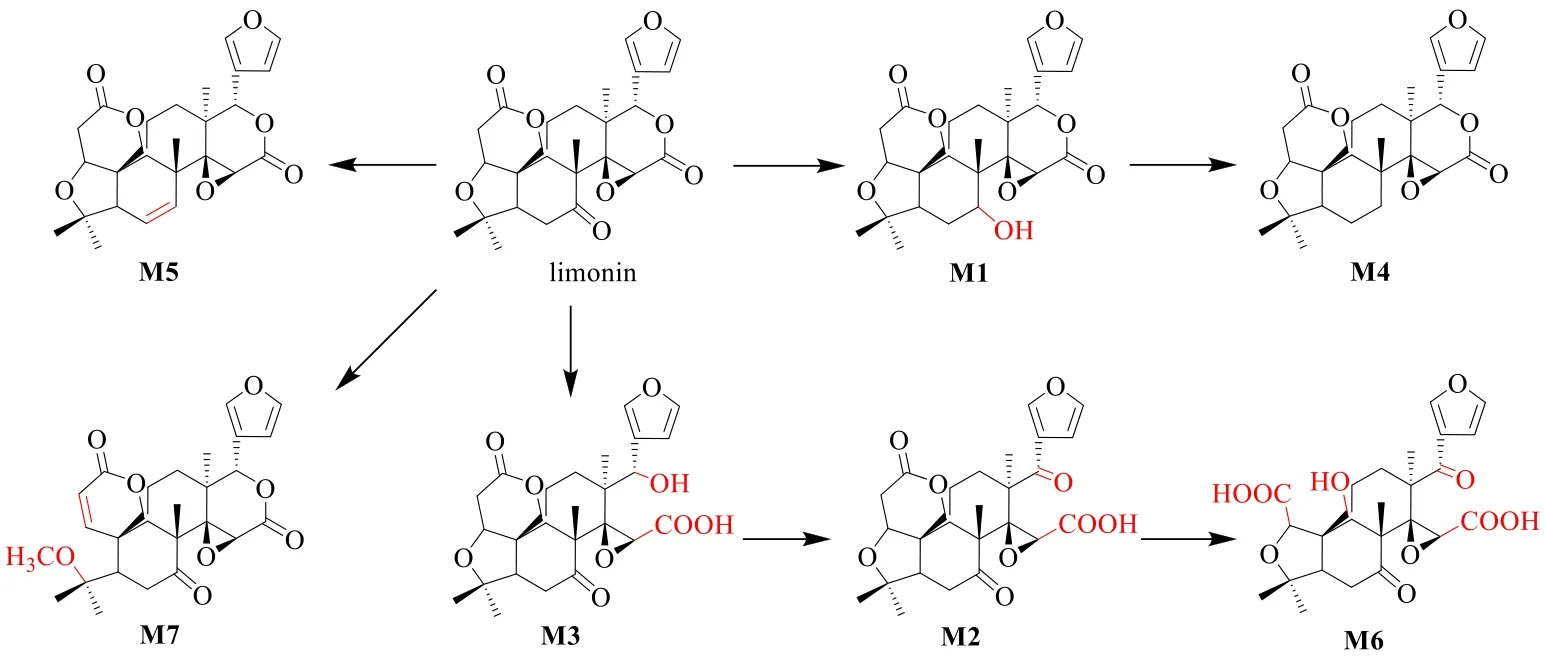
图4 柠檬苦素可能的代谢途径Fig.4 Possible metabolites pathways of limonin
上述研究表明,吴茱萸碱、吴茱萸次碱和柠檬苦素都能够在肝脏中发生代谢,CYP3A4、CYP1A2和CYP2C9 是吴茱萸碱和吴茱萸次碱的主要代谢酶。提示这3 种物质在经历肝脏首过代谢时,会有一部分原型药物转化为代谢物,原型和代谢物都能够在体内产生暴露。
4.3 吴茱萸的DDI 风险
方剂配伍是中医用药特色,中药临床上还常与其他药物联合使用,因此潜在的DDI 风险也会影响吴茱萸临床用药的安全性。
研究发现,吴茱萸中的化学成分会对CYP450的活性产生影响。Zhang 等[135]评估了吴茱萸碱对大鼠CYP450 酶活性的影响,结果发现吴茱萸碱对CYP1A2、CYP2C 和CYP2D 具有抑制活性,对CYP3A 则没有明显影响。Ueng 等[136]研究发现吴茱萸次碱主要是CYP1A 的选择性抑制剂,其抑制CYP1A1 的IC50[(0.90±0.09)μmol/L]是其抑制CYP1A2 的IC50[(0.06±0.00)μmol/L]的15 倍,对CYP2C、CYP2E1、CYP3A4 则没有影响。此外,吴茱萸次碱的代谢物10-羟基吴茱萸次碱也同样具有CYP450 酶的抑制活性,其抑制CYP1A1、CYP1A2和CYP1B1 的IC50分别是(2.56±0.04)、(2.57±0.11)和(0.09±0.01)μmol/L[137]。Han 等[138]研究了柠檬苦素在体外对人肝微粒体中CYP450 酶活性的抑制作用,发现柠檬苦素对CYP3A4 有较强的抑制作用,IC50值分别为6.20 μmol/L(底物为睾酮)和19.10 μmol/L(底物为咪达唑仑),对人CYP1A2、CYP2C8、CYP2C9、CYP2C19 和CYP2D6 的抑制作用则较小。另外,Zhang 等[139]发现吴茱萸碱、吴茱萸次碱和去氢吴茱萸碱能通过芳香烃受体( aromatic hydrocarbon receptor,AhR)在体外小鼠肝细胞水平诱导Cyp1a1、Cyp1a2、Cyp1b1的mRNA 表达,其有效性顺序为吴茱萸次碱>去氢吴茱萸碱>吴茱萸碱。此外,在小鼠整体动物实验水平(80 μg/g ig 给药)上,吴茱萸次碱和去氢吴茱萸碱能诱导Cyp1a1、Cyp1a2、Cyp1b1的mRNA 表达,而吴茱萸碱则不能。配体对接预测N-14 位上的甲基可能是影响AhR激活的重要结构。
从上述研究来看,吴茱萸的主要成分吴茱萸碱、吴茱萸次碱、去氢吴茱萸碱和柠檬苦素都有可能在分子、细胞或动物水平上影响某些代谢酶的活性,因此有可能影响其他药物在体内的代谢和暴露,在临床应用中应关注与这些酶的特异性底物合用时是否会基于DDI 产生不良后果。
5 吴茱萸的减毒配伍探讨
5.1 吴茱萸的减毒配伍研究现状
中药的不同性味使其在配伍过程中存在着各种复杂的相制关系,根据药物性味进行配伍便形成了性味配伍理论。吴茱萸常与甘味中药配伍,吴茱萸辛热燥烈,配伍甘味中药则能缓和吴茱萸的峻烈,乃是辛甘相制,与吴茱萸配伍的常见甘味中药有甘草、大枣、人参、茯苓等。吴茱萸还可以和酸味中药配伍使用,吴茱萸辛散,酸味中药能收敛以制约其辛味之行散,乃是辛酸相制,与吴茱萸配伍的常见酸味中药有白芍、五味子、木瓜等。吴茱萸配伍寒性药,寒性中药能够制约吴茱萸的燥热之性,乃是寒热相制,其中最经典的便是吴茱萸-黄连药对。
这种基于性味进行配伍减毒的理论能够体现在吴茱萸的方剂配伍中,代表方剂为吴茱萸汤、温经汤(辛甘相制)和左金丸(寒热相制)。吴茱萸汤出自《伤寒论》,由吴茱萸(9 g)、人参(9 g)、生姜(12 g)、大枣(4 枚)组成。吴茱萸辛热燥烈,温中焦,散寒凝,配伍同为辛散温通之生姜,二者相须为用;配伍大枣使用,能散中寓补、刚柔并济,大枣既能制约吴茱萸的辛热,又能使吴茱萸不致温散太过;人参味甘性温,大补脾胃之气,吴茱萸配伍人参使用,则是温补并行、温中补虚。温经汤出自《金匮要略》,由吴茱萸、麦门冬(去心)各9 g,当归、芍药、川芎、人参、桂枝、阿胶、牡丹皮(去心)、生姜、甘草、半夏各6 g 组成。方中吴茱萸配伍当归、甘草、人参使用,当归甘、辛、温,补血活血,乃血中之气药,吴茱萸得当归则温散而不致伤血,当归得吴茱萸则补血而不碍血行,相辅相成、刚柔并济[140];甘草味甘性平,善补脾益气、调和诸药,同时也可制约吴茱萸的温燥。左金丸源自《丹溪心法》,方中仅有吴茱萸和黄连2 味中药,组成比例为1∶6。吴茱萸辛热疏利、开郁力强,而黄连苦、寒,清热燥湿、泻火解毒。黄连能制约吴茱萸的燥热之性,同时吴茱萸也能制约黄连苦寒之性,二者配伍使用,乃是寒热并用、相反相成[140-142]。
配伍能够影响吴茱萸成分的溶出,李丽等[143]发现当归、甘草、炙甘草、生地黄、熟地黄、人参、茯苓、黄芪8 种甘味中药与吴茱萸合煎时均可以不同程度地降低吴茱萸中吴茱萸碱、吴茱萸次碱和柠檬苦素的溶出量,其中,黄芪使这3 种成分的溶出量下降程度最大(吴茱萸碱、吴茱萸次碱和柠檬苦素分别从9.03、1.61、17.61 mg/g 下降至6.23、0.94、12.74 mg/g),甘草也可以使吴茱萸碱和吴茱萸次碱的溶出量明显降低(分别降至6.57、1.17 mg/g),但对柠檬苦素的影响较小(降至15.37 mg/g)。栗焕焕等[144]利用中药指纹图谱结合化学计量学的方法,同样证明吴茱萸配伍甘草后,能使吴茱萸碱和吴茱萸次碱在水提物中的含量有较大程度的下降。另外,临床上常将吴茱萸与生姜配伍使用,研究发现吴茱萸配伍生姜后,吴茱萸碱在水煎液中的溶出量随生姜用量的增大而逐渐减少[145]。这些研究提示,吴茱萸在配伍使用时,有可能在煎煮过程中便降低了毒性物质的溶出量,从而通过降低毒性物质的剂量达到减毒的目的。
配伍还能够影响吴茱萸成分的体内过程。王怡薇等[146]采用正交设计法对戊己丸组方(黄连--制吴茱萸-炒白芍=1∶1∶1)中单味药之间的关系进行研究,发现戊己丸中白芍可以抑制吴茱萸成分的吸收。于洋等[147]研究发现,五味子提取物能显著降低吴茱萸碱和吴茱萸次碱在大鼠单向灌流模型中的肠吸收速率常数(Ka)和表观渗透系数(Papp),说明五味子可能会抑制肠道对吴茱萸碱和吴茱萸次碱的吸收。Ren 等[148]发现,以甘草配伍吴茱萸使用时,甘草能够抑制SD 大鼠的CYP450,从而降低其将吴茱萸生物碱代谢为亲电中间体的速率,缓解吴茱萸引起的GSH 耗竭并抑制蛋白质偶联物的产生,从而降低吴茱萸的毒性。
5.2 “两类三种机制”指导减毒配伍研究
上述配伍研究尽管从不同角度对配伍机制进行了探索性研究,但仅关注了少数几个化合物的含量、体内暴露和代谢的改变,研究的全面性和系统性不足。从减毒配伍研究的角度来看,虽然吴茱萸具有肝毒性的证据比较确凿,初步研究提示吴茱萸生物碱可能是吴茱萸的毒性物质。作为在吴茱萸中含量最丰富的一类化学物质,目前大部分研究只关注到少数几个生物碱,吴茱萸生物碱的体内暴露信息还不够全面,肝脏的暴露水平和在肝脏的代谢研究不够系统。①毒性和药代研究未在吴茱萸全成分谱分析的基础上开展,这样在对吴茱萸进行毒性和药代研究时难以保证不遗漏与吴茱萸毒性或减毒配伍相关的重要物质;②目前的药代研究只是关注了吴茱萸中主要物质的系统暴露,并未按照吴茱萸的毒性作用来确定何种体内暴露在研究中应被关注,如在研究吴茱萸的肝毒性时还应关注给药后吴茱萸中物质的肝暴露;③缺乏对吴茱萸主要暴露物质的体内过程和重要环节的研究,包括影响暴露的关键环节和因素、中药暴露物质的靶标到达、毒性代谢物的生成等;④在开展吴茱萸方剂研究时,对配伍中药的体内暴露和体内过程缺乏研究,这不利于减毒配伍所涉及的物质间关系和相互作用的后续研究;⑤缺乏对吴茱萸中物质与配伍中药物质之间的暴露关系和相互影响的研究,这种不同中药之间关系的药代研究是揭示有毒中药减毒配伍科学内涵所必需的;⑥药代研究与毒理研究结合不够,也缺乏对基础研究发现向临床应用转化的支持。
“减毒配伍”是中医的用药特色,主要在中医“七情和合”配伍理论和中药性味理论指导下实施。“减毒配伍”在“七情和合”配伍理论中,主要存在于“相须”(同类不可离也)、“相使”(我之佐使也)、“相畏”(受彼之制也)或“相杀”(彼之毒也)配伍关系中,涉及两类3 种机制,分别是“相制减毒”(包括药代和效应2 种性质的相制减毒)和“增效减毒”。药代性质的相制减毒是通过配伍来干预中药毒性物质体内过程的某个或某些环节,使其体内浓度向减毒的方向改变。效应性质的相制减毒是通过配伍中药的减毒物质与有毒中药的毒性物质进行直接或间接的效应对抗实现减毒配伍,对此给药后双方中药的有关物质均具有支持这种效应对抗的体内暴露和体内过程。增效减毒是指有毒中药和配伍中药的联合使用产生的药效协同或互补可使有毒中药在比单药使用更低的剂量下发挥同等的药效作用,有毒中药的毒性作用可因剂量的降低而降低。在增效减毒中,如果有毒中药和配伍中药仅发生药效上的协同和互补,不发生能够影响中药有效性和安全性的药代性质的药物相互作用,这种增效减毒的配伍会较为简单,反之则会增加用药的复杂性。进一步来说,药代性质的相制减毒和增效减毒都将“降低有毒物质在毒性靶标的浓度”为目标,属于从源头上预防毒性反应的发生。而药效性质的相制减毒则是通过效应的对抗,一方面从机制上预防毒性反应的发生,另一方面对已发生的毒性结果进行逆转。
针对吴茱萸配伍研究中存在的问题,首先应针对吴茱萸的肝脏毒性,采用“多成分”药动学方法[149],开展全成分谱分析,研究吴茱萸毒性物质的体内暴露和体内过程,重点关注能影响这些物质体内暴露及其毒性靶标到达的关键环节和因素,考察可能有肝毒性的物质和可能保肝物质的肝脏暴露水平,以及体内是否产生亲电子反应性代谢物,找到保障吴茱萸临床安全使用的药代性质的“安全带”。若反应性代谢物的生成是吴茱萸致毒的关键药代机制,那么能生成反应性代谢物的吴茱萸物质的体内暴露水平、多种代谢途径组成的代谢网络和体内GSH 浓度水平就是其安全用药的关键,研究清楚这个关键问题就可能揭示吴茱萸安全使用的“安全带”。其次,应采用“多药”药动学方法[150],比较吴茱萸中毒性物质在单味药给药和配伍后复方给药条件下的体内暴露差异,研究吴茱萸方剂减毒配伍的药代机制,即配伍中药如何影响有毒中药的“安全带”。针对药代性质的相制减毒,需考察吴茱萸毒性物质的体内浓度能否通过DDI 向减毒的方向发生改变,并阐明其中药代靶标、物质基础、作用机制和关键条件;针对效应性质的相制减毒,需考察配伍中药与吴茱萸毒性物质的体内“联合暴露”,包括配伍中药中主要暴露物质对毒性靶标或其他相关解毒靶标的到达和暴露情况;针对增效减毒机制,需考察中药配伍在药效协同和互补时中药物质间能否“药代和谐”。
6 结语
近年来围绕有毒中药减毒配伍研究已成为中医药研究的重点和热点之一,中药毒性相关研究被列入“2021 年度中医药重大科学问题和工程技术难题”的前沿科学问题[151]。吴茱萸是一味具有上千年应用历史的“有小毒”中药,一方面吴茱萸的药效作用明确,另一方面,吴茱萸又“有小毒”。虽然在传统中医药理论的指导下,有炮制减毒、配伍减毒、对证用药、控制用药剂量和时间等方式来保障其安全用药。但是中药现代化的发展对中药有效性和安全性做出了更高的要求,即需要从现代科学的角度解释吴茱萸的毒性并阐释吴茱萸减毒措施的科学内涵。为此,对于吴茱萸的毒性研究应当做到毒性作用清楚、毒性物质清楚、减毒方法清楚。从而通过减毒配伍实现吴茱萸的安全用药,并将其药效作用更好地发挥出来。
本文系统总结了对吴茱萸进行减毒配伍研究所需要的基本信息。吴茱萸的主要化学成分为生物碱类和三萜类,其中又以吲哚类生物碱、喹诺酮类生物碱、柠檬苦素类三萜为主,大部分炮制方法会降低这些成分的含量。吴茱萸确实拥有诸多药理活性,如抗炎、心血管保护、抗肿瘤等活性,吴茱萸生物碱是吴茱萸发挥药效作用的主要成分。吴茱萸的毒性研究表明,超剂量服用吴茱萸有可能引起人或实验动物的毒性反应。其毒性作用主要表现为肝毒性,指标为血清ALT、AST 的显著上升。吴茱萸诱导的肝毒性可能与CYP3A4 介导的代谢激活所产生的反应性代谢物有关,并且很有可能与吴茱萸中的生物碱类成分和柠檬苦素类成分相关。吴茱萸的药代研究表明,吴茱萸口服给药后吴茱萸碱、吴茱萸次碱、柠檬苦素为体内主要暴露物质,且能够在体内经历多种途径的代谢。此外,在联合用药时吴茱萸生物碱可能基于CYP450 酶发生DDI。
虽然已有不少的现代药物科学研究,但目前尚不能清楚回答毒性物质以及毒性机制问题。未来应在全成分谱分析的基础上,开展全面的系统暴露和肝脏暴露研究,明确吴茱萸生物碱类的机体暴露和肝脏代谢,找到保障吴茱萸临床安全使用的药代性质的“安全带”。
本文为吴茱萸的减毒配伍研究进行了梳理,并提出了新的思路,也希望将这种研究思路和方法推广至更多与吴茱萸具有共性问题的有毒中药上,提高有毒中药减毒配伍研究的科技内涵和水平。
利益冲突所有作者均声明不存在利益冲突
