环磷酰胺不同剂量及停药周期构建小鼠卵巢早衰动物模型比较研究
2024-03-20莫金桦胡鸿颜秋霞李鹏东陈彩蓉
莫金桦,胡鸿,颜秋霞,李鹏东,陈彩蓉*
(广州医科大学附属清远医院(清远市人民医院)1.生殖医学中心;2.中心实验室,清远 511500)
卵巢早衰(premature ovarian failure,POF) 指40岁前出现卵巢功能衰竭,闭经时间≥4个月、两次月经间隔>4周、卵泡刺激素(FSH)>40 U/L并伴有雌激素水平降低及绝经症状,患者生育能力近乎丧失,严重影响身心健康和生活质量,引发骨、心脑血管以及神经系统等病变[1-3]。文献报道,40岁以前POF发生率为1%,30岁以前发生率为1‰[4]。根据WHO的预测,全世界不孕症的发病率日趋上升,将成为仅次于肿瘤、心脑血管病的第三大疾病[5]。随着不孕症发病率的日趋升高,POF作为女性不孕症的主要原因之一,其发病人群将进一步增加[6]。然而,POF的病因及发病机制至今尚未完全阐明[7-8],其中包括遗传因素、免疫因素、医源性因素如手术及放化疗等、环境因素,以及占半数以上的不明因素。目前对于POF的治疗,主要包括补充雌激素及对不孕症的治疗,缺乏从根本上改善卵巢功能的治疗方法[9]。鉴于此,关于POF疾病的基础研究对临床工作具有非常重要的意义,而动物模型是研究其病因、机制、治疗的基础。
目前常见的POF动物模型有化疗药物模型、基因敲除模型、半乳糖血症模型和自身免疫性疾病模型等[10]。这些模型都侧重于不同的病因学,均有着各自的独特性和局限性,如基因敲除、半乳糖血症和自身免疫疾病在临床上发病率较低,缺乏代表性。随着肿瘤发病的年轻化,化疗所致的女性POF问题日益突出[11]。尤其对年轻未孕育女性,如何在化疗时保护卵巢功能、如何恢复化疗所致生育力损伤都是亟待解决的问题。环磷酰胺(cyclophosphamide,CTX)是一种常用的广谱抗肿瘤药和免疫抑制剂,具有严重的生殖毒性,使用CTX不同剂量及周期均可出现POF的典型表现[10];但是不同的剂量及停药周期使模型的稳定性存在一定偏差,且尚不清楚CTX在停药后何时达到对卵巢功能损害之最,以及POF模型治疗时间窗。本研究拟比较CTX不同造模剂量和停药周期构建的小鼠POF模型,探索制备小鼠POF的最佳剂量及停药周期,为进一步研究POF提供更为适用的实验模型。
材料和方法
一、实验材料
1.实验动物:7周龄的C57BL/6雌性SPF小鼠购自广东斯嘉景达生物科技有限公司[SCXK(粤) 2020-0052],体重(18±1)g,饲养于广州医科大学附属清远医院(清远市人民医院)实验动物中心[SCXK(粤)2014-0082]。饲养条件为SPF级,温度(22±2)℃,相对湿度50%~60%,自由饮食,每天光照时间12 h,适应性喂养一周后进行后续实验。所有实验操作均在该院医学实验中心进行,严格遵守实验中心的规范要求,并得到动物伦理委员会的许可(批件号:LAEC-202208-032)。
2.主要试剂及仪器:环磷酰胺-水合物(CTX;货号C0768,Sigma-Aidrich,美国);小鼠抗苗勒管激素ELISA Kit(货号JYM0786M0)、小鼠卵泡刺激素ELISA Kit(货号JYM0417M0)、小鼠雌二醇ELISA Kit(货号JYM0379M0)均购自武汉基因美;多聚甲醛购自武汉赛维尔。电子天平(BCE2241-1CCN型,赛多利斯,德国);离心机(H1-16K型,湖南可成仪器);轮转式切片机(RM2016型,上海徕卡);包埋机(JB-P5,武汉俊杰);相差显微镜(E200型,尼康,日本)。
二、实验方法
1.实验分组与造模:(1)CTX诱导POF模型最佳CTX暴露剂量:C57BL/6雌性小鼠适应性喂养一周后,使用相差显微镜观察阴道涂片、记录小鼠动情周期(图1),将动情周期规律的40只小鼠随机分成5组:CON、CTX80(80 mg·kg-1·d-1)、CTX100(100 mg·kg-1·d-1)、CTX120(120 mg·kg-1·d-1)、CTX150(150 mg·kg-1·d-1),每组8只,连续腹腔注射10 d,其中CON组注射生理盐水,其余组注射CTX。记录开始注射至停药7 d内小鼠的活力、毛发、体重、动情周期和卵巢脏器系数,比较得出CTX诱导POF模型最佳CTX暴露剂量。

图1 正常小鼠动情周期阴道涂片
(2)CTX诱导POF模型最佳CTX停药周期:C57/BL6雌性小鼠适应性喂养一周后,将动情周期规律的小鼠使用最佳CTX暴露剂量重新造模,随机分为模型组(24只)和对照组(24只),分别在停药后第1、2、3、4周随机选取6只小鼠,检测其血清抗苗勒管激素(AMH)、FSH、E2水平,分析其卵巢脏器系数,卵巢HE染色计数各级卵泡,比较得出CTX诱导POF模型最佳停药周期。对照组分组记为:CON-1W、CON-2W、CON-3W和CON-4W;模型组分组记为:CTX-1W、CTX-2W、CTX-3W、CTX-4W。
2.体重变化与卵巢脏器系数:自注射CTX开始,到试验取材,记录每只小鼠体重变化,观察周期结束后,颈椎脱臼处死小鼠,取双侧卵巢组织进行称重,拍照记录。卵巢脏器系数=双侧卵巢质量(g)/体重(g)×10 000()。
3.血清性激素检测:自注射结束日为D0,分别于D7(1W)、D14(2W)、D21(3W)、D28(4W) 通过眼球摘除法取血,常温静置30 min,待血清析出,3 000 r/min离心15 min后取上清(血清),-80℃冰箱内保存备用。血清收集完整后,酶联免疫吸附法(ELISA)检测小鼠血清E2、FSH、AMH的含量。
4.卵巢组织形态观察与卵泡计数:4%多聚甲醛溶液固定卵巢组织24 h,经脱水、透明,卵巢最大平面石蜡包埋,5 μm切片,每隔10 μm取一张,每个组织取3张切片,常规HE染色后,每张切片全视野观察卵巢的组织学变化及各级卵泡个数,最终卵泡计数为3张切片计数之和除以3。
三、统计学分析
结 果
一、模型小鼠一般情况比较
CTX150组小鼠自注射第3天开始出现明显的进食减少、活力减退,第5天开始出现脱毛,其中2只小鼠分别于注射CTX第7天及停药第2天死亡,由于CTX150组出现死亡,说明CTX 150 mg·kg-1·d-1剂量过大,不适合进行小鼠POF造模,后续部分结果不纳入统计。CTX100组和CTX120组小鼠注射CTX第6天开始出现进食减少、活力减退和脱毛;而CTX80组小鼠在注射CTX后虽也出现进食减少、活力减退,但直至停药后才开始出现脱毛。各组小鼠用药前动情周期规律,约为4~5 d(图1)。CTX暴露后,CTX80组小鼠仍有完整的动情周期,但延长至6~7 d,CTX120组和CTX100组小鼠则出现动情周期紊乱,在停止暴露的1周内基本处于动情间期,少见动情后期(CTX100组有3只小鼠共出现4次动情后期,CTX120组仅1只小鼠出现1次动情后期),未见动情期,说明CTX 80组剂量不足,剔除该剂量小鼠POF造模。
二、各组小鼠体重和卵巢脏器系数比较
CTX150组注射CTX过程中小鼠体重下降最快。CTX其他组第4天开始小鼠体重均低于CON组,但第4~7 天差异无统计学意义(P>0.05),第8天开始CTX小鼠体重均显著低于CON组(P<0.05),但各CTX组间无显著差异(P>0.05);CTX小鼠体重在停药后开始回升,且与CON组体重差逐渐减小,但至停药第7天仍显著低于CON组(P<0.05)(图2A)。在停药1周时各CTX组卵巢脏器系数显著低于CON组(P<0.01),且CTX100最低(P<0.001),但各CTX组间差异无统计学意义(P>0.05),对比得出CTX100(100 mg·kg-1·d-1×10 d)是诱导卵巢早衰模型最佳CTX暴露剂量(图2B)。
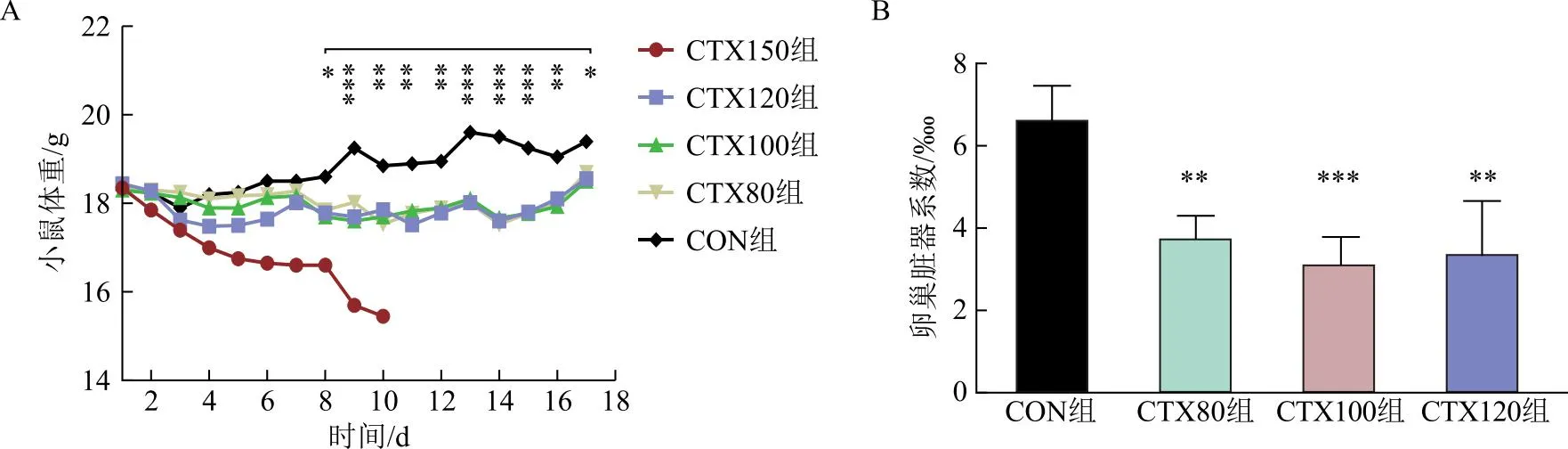
A:造模不同时期小鼠体重变化(第1~10天为药物注射日,第11~17天为停药后);B:停药第7天时各组卵巢脏器系数比较情况。注:与CON组比较,*P<0.05,**P<0.01,***P<0.001。
在研究最佳停药周期时,模型组使用CTX 100 mg·kg-1·d-1×10 d的最佳剂量造模。随停药周期延长,模型组与对照组体重差逐渐减小,但到4W时模型组小鼠体重仍显著低于对照组[(20.03±0.55)g vs.(21.38±1.29)g,P<0.01],而这种趋势差异在卵巢质量[(5.43±0.67)mg vs.(8.41±1.07)mg,P<0.001]和卵巢脏器系数[(2.71±0.31)vs.(3.92±0.70),P<0.001]同样存在,说明CTX 100 mg·kg-1·d-1×10 d诱导的POF模型具有较好的稳定性(表1)。模型组组内比较时,相比1W,体重在2W、3W、4W增长,但只有在3W时差异有统计学意义(P<0.05);而卵巢质量和卵巢脏器系数仅在2W、3W时增长,4W时相对降低,但是只有卵巢质量在3W时差异有统计学意义(P<0.05),展现出模型组体重和卵巢脏器系数并未随停药周期延长而出现明显差异,同样反映出较好的模型稳定性(表1)。

表1 CTX不同停药周期小鼠卵巢早衰模型参数比较(-±s)
三、血清性激素水平比较
模型组(CTX)小鼠在停止CTX暴露后的第1、2、3、4W,血清AMH、E2水平均显著低于同期对照组(P<0.05),而FSH在第1、3、4W均显著高于同期对照组(P<0.05),血清性激素水平符合POF模型特征(表2)。模型组组内比较时,AMH水平随停药周期延长呈进行性下降趋势,而FSH水平在3W、4W时显著低于1W和2W(P<0.001),E2水平在3W、4W时显著高于1W和2W(P<0.001),但是E2和FSH水平在1W和 2W间、3W 和 4W间的差异均无统计学意义(P>0.05),呈现出随停药周期延长,小鼠血清E2和FSH开始出现一定程度回复、而AMH呈持续走低的状态(表2)。

表2 CTX不同停药周期小鼠性激素水平比较(-±s)
四、卵巢组织形态与卵泡计数
模型组在CTX停药后的第1、2、3、4W卵巢组织肉眼可见的小于同期CON组(图3)。模型组在CTX停药后的第1、2、3、4W原始卵泡、初/次级卵泡均显著低于同期CON组,第3、4W成熟卵泡计数均显著低于同期CON组,而第1、2、4W的闭锁卵泡计数均显著高于同期CON组(P<0.05),符合POF特征表现。随CTX停药周期延长,模型组小鼠原始卵泡、初/次级卵泡、成熟卵泡计数呈进行性下降,闭锁卵泡计数升高(P<0.05),展现出CTX对卵巢损伤呈进行性加重(图4)。
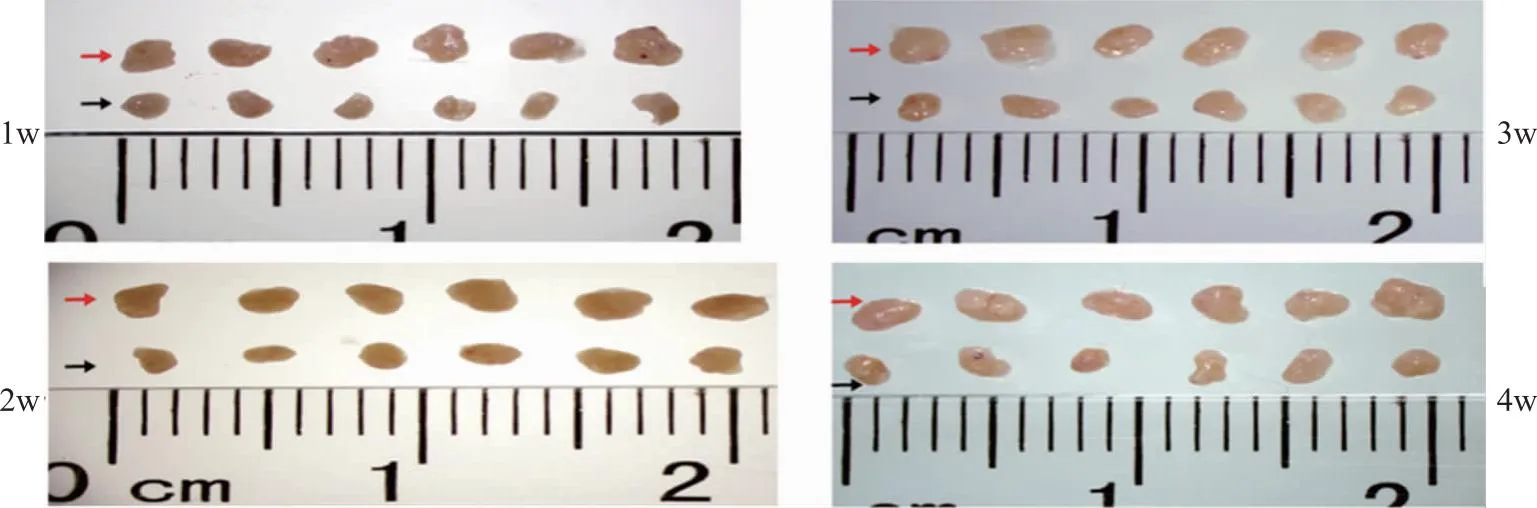
红色箭头:对照组;黑色箭头:模型组。每个卵巢组织代表1只小鼠。
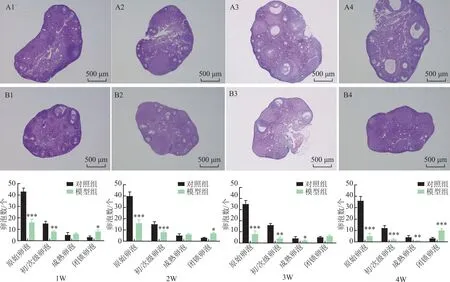
A1~A4:对照组;B1~B4:模型组。1~4分别代表停药后第1~4周。注:与同期对照组比较,*P<0.05,**P<0.01,***P<0.001。
讨 论
随着经济和医学的发展,肿瘤和自身免疫疾病早期诊断率的升高,化疗药物在临床上的广泛应用,化疗所致的女性POF问题日益突出[1]。POF增加了不孕症发病率和退行性健康问题,如心血管疾病、骨质疏松、抑郁焦虑和神经认知障碍等,严重影响了生活质量,使POF患者承受着心理、生理的双重打击[12-13]。但暂无针对POF有效的治疗方法,需要进一步的动物模型和临床研究去探索。目前POF建模方式多样,操作复杂程度、模型稳定性差异较大[10]。由于化疗药物造模具有造模时间短,操作简单,稳定性好且重复率高,在研究中较为常用。CTX是一种广谱抗肿瘤药和免疫抑制剂[14],是治疗卵巢癌、乳腺癌、白血病、恶性淋巴瘤及自身免疫性疾病等常用的化疗药物,价格低廉,同时具有严重的生殖毒性,损伤颗粒细胞,引发POF[13],是诱导POF的最佳造模方式。但是当前CTX构建小鼠POF模型方式各异,模型稳定性有待探讨。Nguyen等[15]用CTX 300 mg/kg单次静脉注射,在24 h内即可显著消耗小鼠的原始卵泡,构建POF模型,但是剂量过大,且与临床周期化疗不符;亦有腹腔注射CTX 120 mg·kg-1·d-1,连续2周,停止暴露后即可成模[16]。更多的研究者使用大剂量冲击+后续小剂量维持的方法建模,如:CTX 200 mg/kg单次腹腔注射,后续8 mg·kg-1·d-1连续14 d的小剂量维持,以此构建POF模型[17],但该类模型与临床POF表现有待进一步考量。而Bahrehbar等[18]对比了白消安50 mg/kg+CTX 100 mg/kg连续10 d、CTX 100 mg/kg连续10 d、首次CTX 200 mg/kg +白消安50 mg/kg及后续9 d的CTX 50 mg/kg+白消安 5 mg/kg、单次CTX 200 mg/kg+白消安20 mg/kg,发现CTX 100 mg/kg连续10 d构建小鼠POF成模最佳。多项研究发现,在构建小鼠POF模型时,使用CTX暴露天数各有不同[10,19]。本研究为提高造模成功率及减少暴露药物剂量,选择10 d作为暴露天数。目前,关于CTX诱导POF小鼠模型所用剂量和停药周期的优化组合,未见系统报道,且达到卵巢功能损害之最的最佳停药周期亦不清楚。研究CTX诱导小鼠POF模型所用最佳造模剂量可提高模型稳定性,而探讨最佳停药周期将对POF模型治疗时间窗的确定具有重要意义。
本研究通过腹腔注射不同剂量的CTX,首先观察小鼠的一般状况,与CON组相比,各CTX组先后出现不同程度的毛发脱落、活动量减少、体重下降和动情周期紊乱。CTX150组造模过程中小鼠体重下降过快,最终出现小鼠死亡情况,说明CTX150剂量过大,不适合进行POF造模,故剔除出后续数据统计。在停止CTX暴露后小鼠体重迅速回升,各CTX组间无统计学差异(P>0.05),但至停药1周各CTX组小鼠体重仍显著低于CON组,说明CTX对小鼠的毒性损伤仍在持续。当前并未见CTX对卵巢功能损害最佳干预时间的系统性研究报道,这也是本研究后续探讨CTX停药周期的原因之一。与成年女性相似,小鼠阴道黏膜上皮细胞也可随着体内雌激素的变化而出现典型的动情周期,通过阴道涂片法可观察出小鼠所处的动情周期,进而评估卵巢的功能变化[20]。CTX120和CTX100小鼠在停止暴露的1周内未见动情期,说明较高剂量的CTX明显损伤了卵巢功能,导致动情周期紊乱[21];然而CTX80仍存在完整的动情周期,说明CTX80剂量不足,故对比后得出CTX80并非最佳模型诱导剂量。卵巢是重要的生殖器官,卵巢脏器系数反映了雌鼠的生殖功能[22]。在停药1周时,CTX100组卵巢脏器系数最低(P<0.001),但各CTX组间差异无统计学意义(P>0.05);再结合上文Bahrehbar等[18]的研究基础,以及考虑到尽量缩小药物对实验动物伤害的伦理要求,故在对比不同CTX剂量诱导POF小鼠模型效果后,得出以100 mg·kg-1·d-1连续暴露10 d作为CTX诱导小鼠POF模型的最佳造模剂量。
为进一步探讨最佳停药周期,本研究使用最佳环磷酰胺暴露剂量(100 mg·kg-1·d-1×10 d)重新造模进行后续研究。相比对照组,模型组小鼠在停止CTX暴露后的第1周AMH水平、E2水平、原始卵泡、初/次级卵泡、成熟卵泡计数均有所降低,而FSH水平、闭锁卵泡计数均显著升高(P<0.05),这与常规POF造模特性相符[12]。同样的,在后续的第2、3、4W也呈现出类似的表现。卵巢脏器系数随停药的时间的延长呈现出第2W显著升高(P<0.05),而从第3W开始下降,第4W低于第1W(表1),且更为客观代表卵巢功能的各级卵泡计数也处于下降趋势,这可能与卵巢组织的纤维增生有关[3],也从侧面说明CTX对卵巢功能的损害具有持续性并进行性加重。结合血清性激素水平、卵巢脏器系数和卵巢病理,可以得出结论:使用CTX 100 mg/kg连续暴露10 d,对小鼠卵巢损害呈进行性加重,随着停药时间延长血清FSH出现一定程度下降和E2水平回升,但卵巢功能仍处于卵巢早衰状态,具有良好的模型稳定性;考虑到干预治疗时间窗,最佳成模时间为停药后1周。
同时,我们发现一个有趣的现象,血清E2在对照组和模型组的组内比较显示,1W和2W水平均显著低于3W和4W(P<0.01),但1W和 2W间、3W和4W间的差异均无统计学意义(P>0.05);且FSH也表现出类似情况(表2)。由于1W和2W在同一批次行ELISA检测,而3W和4W在另一批次检测,这种差异可能由检测批次不同而造成,为消除这种偏倚,后续试验中如需对同一指标进行统计对比,则最好在同一批次进行。再者,考虑到FSH由垂体前叶嗜碱性细胞分泌,AMH由窦前卵泡和窦卵泡的颗粒细胞合成、分泌[23],结合本研究小鼠血清AMH随停药周期延长呈进行性下降,在小鼠POF模型中评估激素标志物时,建议优先使用AMH,次之FSH。Farzaneh等[24]对就诊的96例患者测量血清AMH和FSH水平,发现与FSH相比,AMH的灵敏度更高(80% vs. 28.57%),特异性几乎相同(78.89% vs. 78.65%)。此外,AMH(98.61%)和 FSH(87.5%)的阴性预测值也不同。但阳性预测值相同(17.39%)。得出AMH的诊断准确性高于FSH,AMH对POF的早期诊断更适用。显然Farzaneh的研究结论也证实该现象,但仍须进一步研究佐证。本研究不足之处,未对模型组进行配种,验证模型小鼠的生育能力和F1代的卵巢功能的影响,后续开展干预治疗研究时应同步进行。
综上所述,本研究通过比较CTX不同造模剂量和停药周期构建的小鼠卵巢早衰动物模型,以100 mg·kg-1·d-1连续暴露10 d为CTX诱导小鼠POF模型的最佳造模剂量,最佳成模时间为停药后1周。
