心脏手术患者衰弱的评估及管理
2024-03-19冉菊红杨平亮彭勇刚
冉菊红,杨平亮,彭勇刚
(1郑州大学第一附属医院麻醉与围术期医学部,河南 郑州 450052; 2成都医学院第一附属医院麻醉科,四川 成都 610050; 3佛罗里达大学医学院麻醉科,美国 佛罗里达州 32610)
人口老龄化持续加速,预计到2050年,全球65岁以上人口将达到20亿[1]。 在中国接受外科手术的老年患者(年龄≥65岁)比例明显增加,占1/4至1/3[2],在美国此比例高达50%。 年龄相仿的老年患者术后结局差异很大,这可能与不同程度的衰弱有关。 衰弱比实际年龄更能预测术后并发症率和死亡率[3]。 衰弱随年龄增长而增加[4],且女性高于男性,心脏手术患者明显高于非心脏手术患者。 与非衰弱患者相比,心脏手术患者死亡风险增加2~4倍。 美国外科医师学会和美国老年医学会建议65岁及以上患者术前应进行衰弱评估,但常规的围术期衰弱评估及干预经常被忽视。 调查显示超过80%的麻醉医生 “很少或从不” 实施衰弱评估[5]。 本文就衰弱的概念、病理生理、心脏手术患者衰弱评估方法及围术期干预措施等方面的研究进展予以综述,以期为衰弱患者心脏手术围术期管理提供借鉴。
1 衰弱的概念及病理生理
衰弱(Frailty,也有译为 “虚弱” 或 “脆弱” ),指多个相互关联的生理系统功能累积下降,器官生理储备能力和抵御应激的能力降低,较小的应激事件易引起健康状况不成比例的恶化,使机体更容易产生不良结局的一种综合征[1]。 衰弱有5个特征: 易感性、多因素病因、临床特征多样性、可评估性和不良结局增加[6](表1)。 这些特征反映了衰弱在个体间的差异性及复杂性。 衰弱与 “共病” 或 “失能” 不是同义词,共病是衰弱的危险因素之一,失能则是衰弱的结果。

表1 衰弱的5个特征
衰弱的病理生理机制涉及神经、内分泌、免疫、运动、心血管、呼吸、泌尿和血液等多个系统,这些系统通过相互关联的反馈网络相互作用。 衰弱患者的神经内分泌失调,以睾酮、脱氢表雄酮和胰岛素样生长因子-1 (insulin-like growth factor-1,IGF-1)等为代表的合成代谢激素联合缺乏比任何单一激素缺乏更能预测患者的衰弱状态[7]。
在衰弱的发生和发展中起关键作用的是,衰老的免疫系统对急性炎症刺激不能做出适当反应,表现为对炎症刺激反应过度,且在初始炎症刺激消失后仍持续较长时间。 衰弱患者白细胞介素-6 (interleukin-6,IL-6),C-反应蛋白(C-reactive protein,C-RP),肿瘤坏死因子-α (tumor necrosis factor,TNF-α)和CXC趋化因子配体-10 (CXC chemokine ligand-10,CXCL-10)等炎症因子水平升高。 衰弱还与线粒体功能障碍、胰岛素抵抗、维生素D缺乏、糖蛋白增加等有关。 且患者的共病(如糖尿病等)、促炎饮食、久坐的生活方式、吸烟、饮酒、神经精神状态(如认知障碍和抑郁)及社会经济因素也与衰弱的发展有关[8]。
衰弱患者因调控合成和分解代谢的激素失衡、炎症反应失调、骨骼肌线粒体减少、氧化磷酸化受损等,引起肌肉质量流失和力量下降,即肌肉减少症; 而肌肉流失和活动量减少会导致体质量下降和食欲减退,进一步恶化肌肉减少症[6]。 肌肉减少症是衰弱的主要临床特征之一。
2 衰弱的评估方法
目前虽有多种不同的衰弱评估方案,但尚无统一的 “标准” 。 主要有 “表型模型” 和 “缺陷累积模型” 2种(表2)。 这2种模型识别衰弱的不同侧面及其严重程度,提供不同的临床和预后信息,各有特点,可以相互补充[9]。
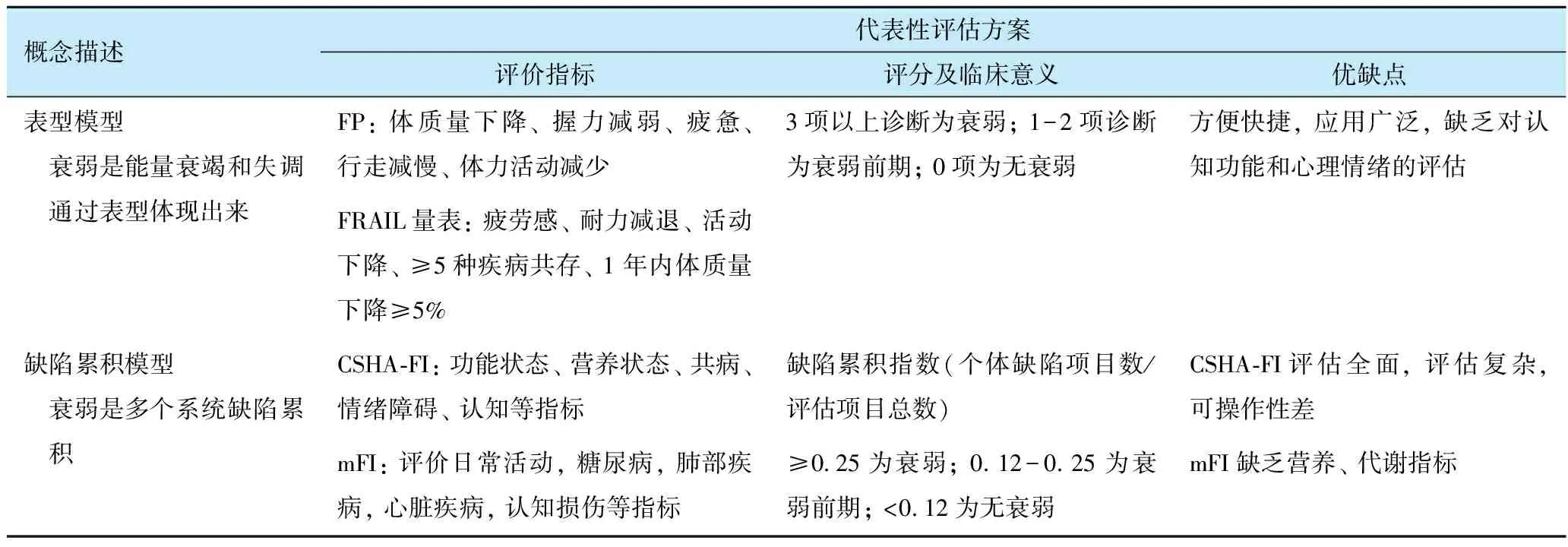
表2 衰弱的2种模型
目前有多种评估衰弱的量表,常用的有费德曼表型评估法(fried phenotype,FP)、简易体能状况量表(short physical performance battery,SPPB)、衰弱指数(frailty index,FI)、改良衰弱指数(modified frailty index,mFI)、临床衰弱量表(clinical frailty scale,CFS)、埃德蒙顿衰弱量表(edmonton frailty scale,FS)、FRAIL量表、重要衰弱工具箱(essential frailty toolset,EFT)、Katz 指数、加拿大健康与老年研究衰弱指数(canadian study of health and aging-frailty index,CSHA-FI)、多维衰弱状态评分(multidimensional frailty score,MFS)等。 在选择评估衰弱量表时应综合考虑其准确性和可行性。 Aucoin等[10]研究结果显示,CFS具有较高的准确性和可行性,在预测术后死亡和非痊愈出院方面最出色,是最快捷和最实用的评估量表; FP与术后并发症和谵妄相关性较强,准确度高,但可行性低。
上述评估衰弱的量表大部分需要患者参与(如握力、步速和认知测试),这对危急重症患者不可行。 生物标记物简单客观且不需要患者参与,是麻醉医生评估衰弱更实用的方法。 目前已知许多血清标记物与衰弱相关,如C-RP、IL-6、TNF-α、IGF-1、单核细胞趋化蛋白(monocyte chemoattractant protein-1,MCP-1)、巨噬细胞炎性蛋白(macrophage inflammatory protein-1β,MIP-1β)[11]等,缺点是用这些标记物评估衰弱并不准确,不能用于常规评估衰弱。 肌肉和骨骼质量减少与衰弱相关,可以通过人体测量学(如测量身体质量指数、皮肤褶皱厚度、腰围和四肢周长)和生物电阻抗分析(测肌肉质量)评估衰弱,但这些方法也不精确。 通过影像学方法(CT、MRI、超声)检测肌肉质量和骨量丢失更可靠,许多患者因诊断或治疗需要,术前已预约了影像学检查,这为医生评估衰弱提供了便利,如利用超声测量股四头肌深度; 利用腹部-盆腔CT测量L3骨骼肌指数(即利用CT、MRI检查获取L3椎体横断面内所有骨骼肌的总面积,除以身高的平方获得的数值)和腰肌密度及体积等识别骨骼肌减少。 研究显示,骨骼肌指数是经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)患者术后住院时间的独立预测指标,骨骼肌指数每增加14 cm2/m2,住院时间就减少1 d[12]。 放射成像作为评估衰弱的客观指标,是一种适合麻醉前评估使用的新型、有前景的评估方法[6]。
3 心脏手术患者术前评估方法
心脏手术常用的风险预测模型是美国胸外科医师协会(Society of Thoracic Surgeons,STS)风险评分和欧洲心脏手术风险评估系统Ⅱ (European System for Cardiac Surgery Risk Evaluation,EuroSCORE Ⅱ),这2种方法均未考虑患者的衰弱因素,对于高龄患者和重大心脏手术的风险评估容易出现差错。
研究表明衰弱预测择期心脏术后1年死亡 (Frailty predicts death One year after Elective Cardiac Surgery test,FORECAST) 评分(包含坐位起立、乏力、爬楼梯、CFS和血肌酐5个测试项目)在预测择期心脏手术后1年死亡风险方面,优于STS评分和EuroSCORE评分。 与单独使用Parsonnet或STS评分相比,纳入衰弱指标可以提高其风险预测能力[3]。 Afilalo等[13]比较7种不同的衰弱量表对TAVR或外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)术后不良结局的预测,结果显示,衰弱是TAVR和 SAVR术后死亡和失能的主要危险因素,推荐使用EFT(包含下肢无力、认知障碍、贫血和低蛋白血症4个项目)评估衰弱,EFT评分是TAVR或SAVR术后1年全因死亡和失能的最强预测量表。
心脏瓣膜病管理指南[14]推荐采用Katz指数和EFT评分评估衰弱,还可依据Katz指数选择手术方式。 Katz 评分包含洗澡、穿衣、如厕、移动、大小便控制和进食6个项目。 若不能独立完成的项目超过2项,表明患者严重衰弱,实施SAVR风险很高,推荐TAVR治疗。 衰弱与心血管疾病专家共识[8]推荐≥70岁的心血管病患者接受心脏介入手术或大手术前应常规评估衰弱。 由于心血管疾病种类不同和个体差异,导致衰弱的原因和程度可能不同,一种评估方法不可能适合所有患者,应根据受试者的特征、评估目的和临床具体情况选择合适的衰弱筛查和评估工具。 推荐先使用一种简易便捷的衰弱量表进行筛查,如用以EFT评分为主的衰弱筛查方法筛查瓣膜性心脏病患者,对筛查出的阳性患者,针对具体缺陷再进行更详细更深入的评估(若已证实存在认知损害或共存疾病和/或失能,可使用具体的认知功能评估量表或评估共存疾病和/或失能的量表)或全面的老年综合评估(comprehensive geriatric assessment,CGA)。 关键要识别导致衰弱的原因(是躯体疾病及综合征方面、还是心理与情感、身体功能、社会环境等方面)、组成成分及其严重程度,以便制定一个适合患者特殊需求的个体化的干预措施,优化临床结局。
4 衰弱与心脏手术患者ERAS策略
加速术后康复 (enhanced recovery after surgery,ERAS) 是指采用一系列有循证医学证据支持的措施,优化围术期处理,降低患者应激反应,以达到快速康复的目的,是一项新的治疗理念和康复模式。 国际ERAS协会在2019年发表了心脏外科手术快速康复的专家共识,制定了22项干预措施[15]。 研究表明,ERAS方案用于70岁以上老年患者,可减少并发症数量和并发症严重程度,并缩短住院时间,但此研究未说明衰弱患者是否被排除在外。 ERAS可缩短衰弱老年患者的住院时间,但仍比年轻患者时间长[16],这对衰弱患者接受统一ERAS方案的获益性提出了质疑。 心脏手术后6 h内气管拔管是ERAS的一个重要目标,可减少ICU停留时间和总住院时间,并降低医疗费用。 但这项措施对衰弱患者是否合适,是否会增加再插管率尚无可靠证据。 ERAS实践中需要针对衰弱患者的特点,识别衰弱患者的特殊问题,优化围手术期管理,提高衰弱患者麻醉管理质量。
5 衰弱患者心脏手术围术期管理
5.1 术前优化(预康复)
衰弱的发展是动态过程,在一定程度上是可逆的,通过科学干预可得到改善。 在术前增强患者身体素质,使之能承受手术应激的过程称为预康复。 预康复主要包括运动锻炼、营养干预、社会支持及减轻焦虑等。 干预的时机对效果影响较大,轻-中度衰弱对干预反应良好,而重度衰弱的干预效果较差,因此衰弱患者早期干预十分重要[17]。
运动锻炼可减轻交感神经过度反应,提高胰岛素敏感性,增加肌肉质量,减少体脂比例,对身体各成分和肌肉功能均有益。 特定的吸气肌训练可以减少心脏手术患者术后呼吸系统并发症[18]。 衰弱患者在冠状动脉旁路移植术或瓣膜手术前6周开始进行预康复,能够改善身体功能、缩短住院时间[19]。 欧洲心脏病学会(European Society of Cardiology,ESC)衰弱与心血管疾病专家共识[8]推荐衰弱患者进行适当的低强度力量训练,不建议进行中等强度的有氧或抗阻力运动训练,这会增加跌倒的风险。
营养不良是导致衰弱的危险因素。 心脏手术患者普遍存在能量和蛋白质摄入不足,且术后开始营养支持的时间滞后,围术期发生营养不良的风险较高。 心脏外科手术ERAS专家共识建议,对血清白蛋白低于30 g/L的患者,应实施7~10 d的强化营养治疗[15]。 营养干预是通过维持正常的新陈代谢和肠道功能完整,保持充足的水分和正常的血糖水平,改善伤口愈合和减少术后并发症等多种途径促进患者康复。 健康成人推荐每日蛋白质摄入量0.83 g/kg,老年人0.89 g/kg,衰弱合并肌少症患者1.20 g/kg,应激状态时则需要1.30 g/kg。 血清25-羟维生素D水平<100 nmol/L的患者,推荐每日补充800 U维生素D3(常联合钙剂) 以增强下肢肌力[17]。 复杂和长时间手术的患者,可以考虑补充免疫调节成分(如硒、鱼油)。 另外,诊断和治疗缺铁性贫血和牙齿护理在衰弱患者围术期管理中也十分重要[20]。 营养干预能改善营养不良衰弱老年患者的体质量下降,降低病死率,但对非营养不良的衰弱人群尚缺乏足够证据支持[17]。 也有研究认为改善营养状况与心脏手术患者总死亡率无关,且营养干预在紧急情况下并不可行。
衰弱与全身炎症反应、肌肉线粒体功能障碍和神经内分泌功能失调等有关。 炎症介质的单克隆抗体可能会减缓衰弱进展[7],肌肉生长抑制素抑制剂和激活素A拮抗剂具有对抗肌肉萎缩的作用[21]。 IGF-1对骨骼肌有直接影响,但不能改善健康老年妇女的肌肉力量或骨密度。 睾酮可提高肌肉力量,但也会增加心血管和呼吸系统的不良后果。 血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)可以改善骨骼肌的结构和功能,减缓老年肌肉力量的下降,并提高运动能力和生活质量[1]。
焦虑和抑郁在老年衰弱患者中很常见,识别潜在的精神健康问题和心理压力来源,相应地采用综合心理支持(如提供手术相关信息、家庭和社会支持、音乐放松等)缓解患者对手术的恐惧与焦虑。
衰弱患者往往合并多种基础疾病,如抑郁、糖尿病、心血管疾病等,在治疗过程中应重视合理用药,避免不合理用药和多重用药。 不合理用药会延长衰弱老年患者住院时间,增加老年综合征和死亡的风险。 建议采用北美Beers和欧洲STOPP-START标准评估衰弱患者用药的合理性,确定药物的相互作用,制定个体化、最小有效剂量的临床治疗策略[22-23]。
有创检查和治疗会导致衰弱患者并发症增加,应仔细评估,慎重选择,避免过度医疗,减少医疗伤害。
5.2 术中管理
目前尚无衰弱患者心脏手术的麻醉管理专家共识,老年患者的麻醉管理原则也适用于衰弱患者。 衰弱患者的心脏自主神经系统可能受损,自主神经功能障碍表现为心率动态复杂度降低,心率变异性降低,这与死亡率增加相关[24]。 要维持合适的麻醉深度,术中麻醉深度监测可减少麻醉药用量,有利于维持血液动力学稳定。 爆发抑制与围术期神经认知功能障碍增加有关,避免爆发抑制可降低术后30 d 内死亡率。 右美托咪定可降低术后谵妄的风险,而阿米替林和苯二氮类药物会增加术后谵妄。 体外循环期间复温过快与术后神经系统并发症增加相关,术中应密切监测患者体温,并采取肺保护策略。
5.3 术后处理
手术应激和术后活动不便会使衰弱患者的身体机能恶化,甚至导致下肢功能丧失,所以要强调术后早期活动,并预防跌倒。 血液动力学稳定的心脏手术患者术后应尽早恢复口服/肠内营养。 需重视术后疼痛管理,老年患者应采用低阿片的多模式镇痛方式,疼痛和应用过量止痛药都与老年患者术后并发症增加有关。 对乙酰氨基酚(最大剂量不超过3 g/d)、区域麻醉(包括胸壁神经阻滞、竖脊肌平面阻滞、肋间神经阻滞、胸骨旁阻滞和椎旁阻滞)、加巴喷丁 (术前1~2 h口服600 mg)或普瑞巴林(术前1~2 h口服150 mg)、右美托咪啶[术中连续静脉输注1 μg/(kg·h)及氯胺酮(初始剂量不超过0.35 mg/kg,连续输注剂量不超过1 mg/(kg·h)]均可作为心脏手术后多模式镇痛的基本组成部分[2]。 衰弱患者可参考以上老年患者术后镇痛原则,根据情况适当减少剂量选择合适的低阿片多模式镇痛方案。
6 结语
衰弱与老年患者心脏外科手术的不良结局密切相关,选择合适的评估方案,识别导致衰弱的主要原因,通过多学科合作(包括麻醉医生、心脏外科医生、老年病学专家、康复医学专家、营养师和姑息治疗医生等)制定适合衰弱患者特殊需求的个体化的围术期干预措施,可改善患者预后,减少ICU停留时间和总住院时间,降低医疗成本。 准确的预测风险,有利于医患沟通,改善知情同意过程,并可优化医疗资源配置,减少过度医疗,减轻医疗负担。
