细胞分裂素信号调控植物雌配子体发育的研究进展
2024-03-18马苏卓刘开创黄幼梅柴梦楠蔡汉阳
马苏卓, 苏 涵, 刘开创, 黄幼梅, 柴梦楠, 秦 源, 蔡汉阳
(1.福建农林大学生命科学学院;2.福建农林大学农学院,福建 福州 350002)
被子植物雌雄配子体发育、双受精和胚胎发生是实现世代交替的关键。其中,雌配子体发育是一个复杂而有序的生物学过程,包括大孢子发生和雌配子体发生两个连续的调控阶段[1]。大孢子发生阶段:从胚珠原基顶端的一个孢原细胞分化形成大孢子母细胞,大孢子母细胞经过一次减数分裂形成4个单倍体大孢子;之后,处在珠孔端的3个大孢子退化,仅合点端的大孢子存活,形成功能大孢子。雌配子体发生阶段:功能大孢子经历3轮无缺陷的有丝分裂后形成合胞体,再经过细胞化产生一个“七胞八核”胚囊,包括珠孔端的2个助细胞、1个卵细胞、2个极核(中央细胞)和合点端的3个反足细胞[1]。相比于雄配子体,雌配子体通常由母体组织层层包围,包裹于胚珠中,且数量少、取材难,因此,雌配子体发育的研究进展落后于雄配子体。植物激素在植物生长发育过程中发挥重要作用,细胞分裂素是植物激素的重要组成部分,参与植物营养生长、雄配子体发育和雌配子体发育等诸多过程[2]。本文拟在综述细胞分裂素代谢、信号感知和转导的基础上,重点介绍细胞分裂素在模式植物拟南芥(Arabidopsisthaliana)雌配子体发育过程中的主要功能,为揭示植物雌性生殖发育机理提供参考。
1 细胞分裂素代谢及其信号感知和转导
细胞分裂素是一种N6替代的腺嘌呤衍生物,随着研究技术的进步,其代谢、信号感知和转导过程相继被揭示[3]。高等植物中常见的细胞分裂素主要包括异戊烯腺嘌呤、反式玉米素、顺式玉米素和二氢玉米素。植物细胞分裂素水平由生物合成和失活途径决定,异戊烯转移酶催化异戊烯腺嘌呤和顺式玉米素核糖的形成,前者可被细胞色素P450单氧酶CYP735A1和CYP735A2羟基化,形成反式玉米素核糖[4-5],这些前体被LONELYGUY(LOG)基因编码的磷酸核糖水解酶水解,转化为相应的生物活性游离碱[6]。细胞分裂素是由根和芽中多种类型细胞合成的,并且发生了局部和长距离的运输[7]。活性细胞分裂素水平降低是通过细胞分裂素氧化酶(脱氢酶)的不可逆降解或与糖(葡萄糖)部分结合实现的[8]。
大部分生物体都能产生细胞分裂素,细胞分裂素在植物细胞中的信号传导作用已被揭示[9]。拟南芥中的细胞分裂素信号通路类似于细菌中的双组分信号通路,由多步磷光体介导[10],该途径的关键成分包括组氨酸激酶型受体(arabidopsis histidine kinase, AHKs)、组氨酸磷酸转移蛋白(arabidopsis histidine phosphotransfer protein, AHPs)和反应调节器(arabidopsis response regulators, ARRs)[11]。信号转导主要是通过AHKs中的His残基和AHKs接收域中的Asp残基的磷酸化修饰进行的[3]。细胞分裂素被膜定位的组氨酸激酶受体AHKs感知,与受体蛋白结合,导致其激酶结构域出现自磷酸化和磷酸基向受体结构分子内域转移[12]。AHPs将磷酸基从细胞质带到细胞核,激活B型ARRs,即细胞分裂素在His-Asp磷酸转导下,激活细胞核中的ARRs转录因子[13](图1)。激活的B型ARR促进转录,A型ARR反过来负向调节该通路(图1)。
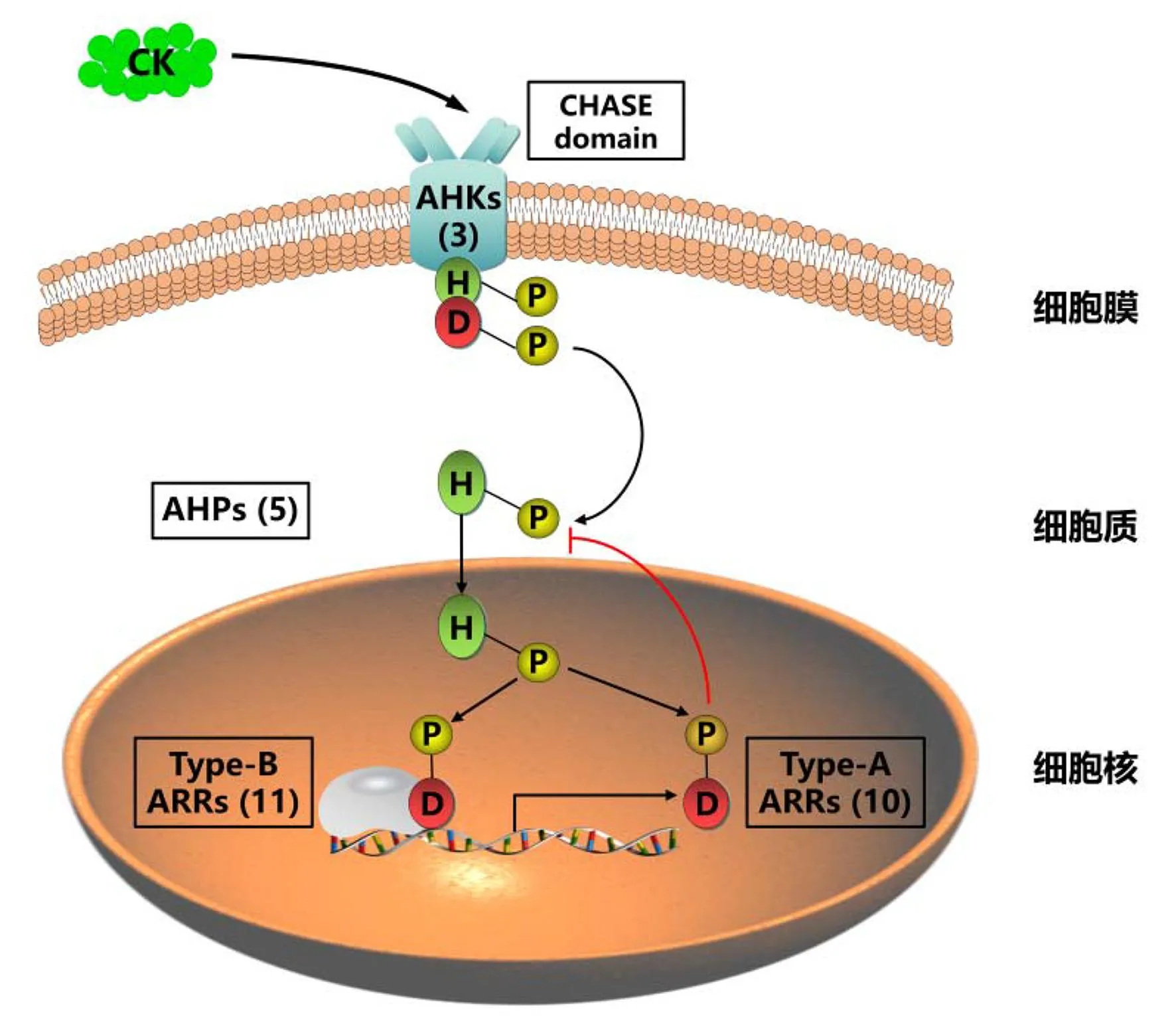
图1 细胞分裂素信号的转导模型Fig.1 Cytokinin signaling through His-Asp phosphorelay
在拟南芥、水稻(Oryzasativa)等植物中,细胞分裂素信号元件是由功能重叠的基因家族编码的[9,14],用外源细胞分裂素处理植物会导致这些基因的表达发生改变[15]。在对细胞分裂素不敏感的突变体中,大部分细胞分裂素诱导基因表达的水平下降,表明它们在植物中受内源性细胞分裂素调控[16]。B型ARRs通过直接结合并激活细胞分裂素相关基因的表达来调控植物的生长发育[17]。例如,WUSCHEL(WUS)转录因子是B型ARRs的下游靶基因,是调控分生组织发育的关键转录因子[17-18]。此外,B型ARRs转录因子也直接与生长发育调控的关键转录因子或其他激素途径中的转录因子相互作用,共同调控下游靶基因的转录表达,从而调控植物的生长发育[19]。
2 细胞分裂素信号在大孢子发生过程中的调控作用
植物雌配子体发育过程包括大孢子发生和雌配子体发生两个连续阶段。大孢子发生过程的顺利进行是雌配子体正常发育的基础。在拟南芥ahk2/3/4三突变体中胚珠原基数目显著减少,表明细胞分裂素信号参与植物胚珠原基的调控[20]。人工合成的细胞分裂素响应启动子TCS(包含B型ARR结合基序和最小的35S启动子[21])的表达模式显示,细胞分裂素在大孢子母细胞时期和功能大孢子时期在胚珠的合点端表达[22]。此外,细胞分裂素的合成基因ISOPENTENYLTRANSFERASE1(IPT1)[23]和受体基因AHK2/3/4在拟南芥大孢子母细胞时期的胚珠中也有大量表达[24],暗示着细胞分裂素信号可能参与调控大孢子发生过程。
前期研究显示,AHKs、AHPs以及B型ARRs转录因子参与孢子体和配子体组织之间的信号交流,并在孢子体中表达,对功能大孢子的正常发育尤为重要。通过对表达模式进行分析,发现细胞分裂素信号在胚珠中是不对称分布的,在大孢子发生过程中主要分布在合点端。当外珠被开始形成而减数分裂尚未发生时,AHK2/3/4在胚珠的合点端表达;AHK2和AHK4(CRE1)在内珠被原基中表达;ahk2/3/4三突变体的大部分胚珠没有胚囊,这是减数分裂过程出现异常所致[23]。由此可知,功能大孢子的正常发育依赖于周围孢子体组织中的细胞分裂素,细胞分裂素在胚珠合点端富集,为功能大孢子发育提供位置信息。此外,AHP和B型ARRs转录因子调控功能大孢子发育是通过AHK和CKI1(cytokinin-independent 1)通路作用于孢子体和配子体实现的[23]。
3 细胞分裂素信号在雌配子体发生过程中的调控作用
在拟南芥中,根据胚囊内核数量、液泡的形成和细胞化,雌配子体的发生可分为7个时期(FG1~FG7)。FG1时期:功能大孢子经过细胞分化和生长,体积显著增大,形成一个椭圆形细胞。FG2时期:第1次有丝分裂产生的2个核分别位于珠孔端和合点端。FG3时期:2个核之间形成中央液泡并将2个核分别推至两极。随着胚珠的发育,在胚囊中进行第2、3次有丝分裂,先后形成4个细胞核(FG4时期)和8个细胞核(FG5时期),同时开始细胞化。FG6时期:两端各有一个极核向中间移动,合胞体细胞化形成典型的“七胞八核”结构的胚囊。FG7时期:2个极核融合,形成成熟胚囊[25]。细胞分裂素是植物重要的生长调节剂,参与植物众多生长发育过程。目前研究发现细胞分裂素在雌配子体发生过程中发挥重要作用。
CKI1是拟南芥AHK2/3/4的同源物,但缺乏与细胞分裂素结合的CHASE结构域。CKI1介导的细胞分裂素信号途径对于中央细胞至关重要。在成熟的雌配子体中,CKI1的表达主要局限在中央细胞核中,在卵细胞核中也有较低水平的表达[26]。在cki1突变体雌配子体发育的FG4时期,合点端的2个核发生退化,导致拟南芥成熟雌配子体出现异常,未检测到中央细胞和反足细胞,而卵细胞和助细胞特征延伸到合点端[26-27]。作为一个非受体型AHK基因,CKI1可能与其他细胞分裂素信号转导组分相互作用共同调控雌配子体发育。拟南芥基因组含有5个AHP基因,即AHP1~AHP5[28],都在中央细胞中表达。研究发现,ahp1/2/3/4/5五突变体胚珠中有38.2%的雌配子体在不同发育阶段均存在严重缺陷,而ahp单突变体没有明显的胚珠发育表型,表明AHP基因在调控雌配子体发育中存在功能冗余[29]。ahp1/2/3/4/5五突变体胚珠胚囊发育异常的表型与cki1突变体相似,进一步分析发现CKI1作用于AHP基因的上游,通过调控AHP的表达来调控雌配子体发育[29]。利用CKI1启动子驱动IPT8和ARR1基因表达可以部分恢复cki1的雌配子体发育异常表型,表明CKI1、AHPs和B型ARRs组成的遗传途径参与调节雌配子体发育过程[29]。研究表明,MYB64和MYB119在中央极核融合和细胞化过程中特异表达,是拟南芥雌配子发生过程中细胞化和分化所必需的[30]。在myb64/119双突变体中,大多数雌配子体的中央极核不能融合,最终无法形成正常的雌配子体。MYB64和MYB119的转录表达受CKI1调控[30]。由此可知,CKI1作为细胞分裂素信号途径中的关键组分,通过调控细胞分裂素信号途径的其他组分参与调控雌配子体发育,也可以通过调控其他信号途径的基因或者转录因子共同调控雌配子体发育。
ARRs是细胞分裂素信号转导途径中的转录因子之一,在细胞分裂素信号途径中发挥重要作用。拟南芥基因组中共有23个ARRs转录因子,分别为A型(10个)、B型(11个)和C型(2个),其中A型ARRs起负调控作用,而B型ARRs起正调控作用[31]。B型ARRs转录因子成员ARR10/12/18都在胚囊中表达,它们从胚囊发育的FG4期开始定位于胚囊的合点端。由反向遗传学研究可知,ARR10/12/18调控雌配子体发育,arr10/12/18三突变体中胚囊细胞出现缺陷,卵细胞和助细胞的细胞属性向合点端扩展,而中央细胞和反足细胞的细胞属性消失。由遗传学和转录组分析可知,CKI1、AHP2/3/5和ARR10/12/18在同一个调控中央细胞的途径中发挥作用。激活型ARR10/12/18可以克服cki1和ahp2/3/5中央细胞的缺陷,表明ARR10/12/18位于CKI1-AHP2/3/5的下游,调控中央细胞[32]。
此外,细胞分裂素也可能参与调控植物雌配子体的发育过程。拟南芥基因组中共有7个细胞分裂素氧化酶基因CYTOKININOXIDASE(CKX)[9]。CKX通过不可逆的分裂作用降低植物中活性细胞分裂素水平,从而调控植物的生长发育过程。研究显示,在拟南芥中过表达CKX基因导致转基因拟南芥植株中的内源性细胞分裂素水平降低,出现生长发育缺陷,表现出与细胞分裂素合成或者信号转导相关基因突变相类似的表型[9]。近期研究显示,利用早期衰老相关基因EARLYSENESCENCE1(ES1)的启动子在胚囊中特异表达CKX1(pES1∷CKX1),pES1∷CKX1转基因植株胚囊中细胞分裂素水平显著下降,并导致胚囊发育延迟,表现为部分胚囊发育停滞在单核阶段,部分停滞在二核或四核阶段[33]。进一步研究发现,pES1∷CKX1转基因植株胚囊中细胞周期相关基因的表达水平显著下降,表明细胞分裂素可通过影响细胞周期相关基因的表达来调控雌配子体发育[33]。
4 细胞分裂素与其他激素在雌配子体发育过程中的共同调控作用
多种植物激素在植物生长发育过程中是相互作用、共同调节的。细胞分裂素还与其他植物激素协同调控雌配子体的发育过程(图2)。研究发现:在ahk2/3/4三突变体中雌配子体发育停留在FG1~FG2时期,胚珠数量大大减少;生长素外排使得PIN-FORMED(PIN1)因子的表达水平显著降低[34]。此外,在spl/nzz突变体中,PIN1的表达水平也显著降低,表现出与ahk2/3/4三突变体相似的表型[22]。外源施加细胞分裂素N6-苄基氨基嘌呤改变了生长素在胚珠中的分布从而导致胚珠发育异常[22],表明细胞分裂素是通过影响PIN1的表达来调控胚珠发育。研究发现,细胞分裂素信号和油菜素内酯信号会调控胚珠原基的起始过程,使得种子数目增多,油菜素内酯和CK在植物体内可以互相增强对方的信号响应;油菜素内酯信号转录因子BZR1与CK信号转录因子ARR1相互作用,通过加强BZR1与ARR1的相互作用来增强细胞分裂素功能,增强ARR1对下游基因(如STK、HLL和SHP2)的转录调控能力,从而促进拟南芥的胚珠发生,增加种子数量[35]。表明BR和CK在调控胚珠起始过程中发挥协同作用。
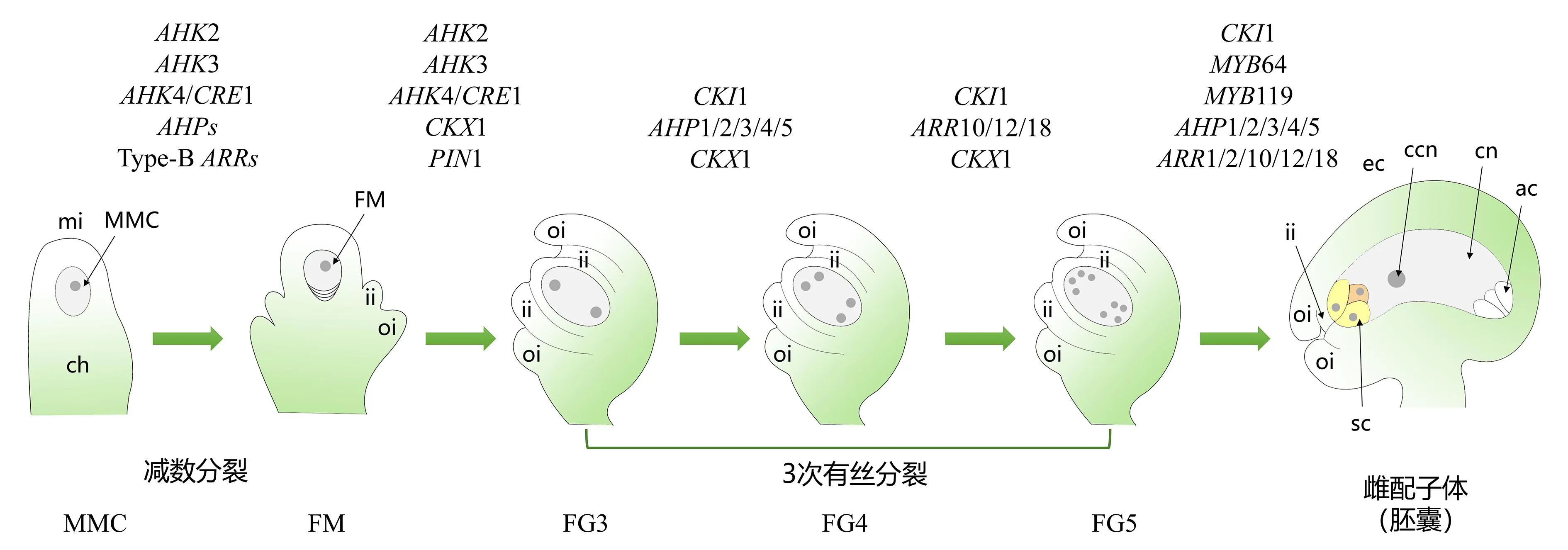
MMC:大孢子母细胞;FM:功能大孢子;mi:珠孔端;ch:合点端;ii:内珠被;oi:外珠被;sc:助细胞: ec:卵细胞;ac:反足细胞;cn:中央细胞;ccn:中央极核。
5 结语
细胞分裂素是植物激素的重要组成,参与调控植物生长发育的多个过程。本研究综述了细胞分裂素在植物雌配子体发育中的功能,包括细胞分裂素信号途径中的主要成员对雌配子体发育过程不同阶段的调控,作用于孢子体中的AHK-AHP-Type-B ARR信号通路,参与调控功能大孢子的特化过程;PIN1受到AHKs的影响,调控雌配子体发生的FG1-FG2阶段;CKI1在FG3~FG7时期发挥着重要作用,且MYB64和MYB119的转录表达受CKI1调控;AHPs和B型ARRs也参与CKI1依赖的雌配子体发生的信号途径,并发挥重要作用。同时,本文还展望了细胞分裂素在调控植物雌配子体发育中可能存在的新的作用机制。此外,在雌配子体发育这个精准的调控网络中,细胞分裂素信号何时何地发挥作用、与其他信号途径之间的调控和协同作用,以及在孢子体和配子体之间是否存在双向信号传导等诸多问题仍有待进一步探索。
