非小细胞肺癌不同中医证型与肠道菌群-免疫功能相关性研究
2024-03-16周夏成刘远财孙梦莹杨佳颖陈卓张爱琴
周夏成 刘远财 孙梦莹 杨佳颖 陈卓 张爱琴


[摘要] 目的 探討不同中医证型非小细胞肺癌肠道菌群及免疫功能的基本特征。方法 选取2019年3—10月于浙江省肿瘤医院胸外科门诊就诊且诊断为非小细胞肺癌的患者46例作为患者组,其中气滞血瘀证组13例,脾虚湿滞证组12例,气阴两虚证组7例,阴虚内热证组14例;选取同期12名健康志愿者作为健康对照组,收集纳入者的粪便标本,用16S rDNA技术检测肠道微生态。采集纳入者的血清标本,通过酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)比较纳入者的白细胞介素(interleukin,IL)-12和干扰素γ(interferon-γ,IFN-γ)差异。结果 与健康对照组比较,属水平相对丰度前20的种系中,气阴两虚证组有6个差异性菌属,阴虚内热证组有4个差异性菌属,气滞血瘀证组有5个差异性菌属,脾虚湿滞证组有3个差异性菌属。气滞血瘀证组患者血清中的IL-12含量显著降低,气阴两虚证组患者血清中的IFN-γ含量显著升高,其余差异均无统计学意义。结论 不同中医证型非小细胞肺癌具有特异的肠道菌群,罗斯氏菌属(Roseburia)、另枝菌属(Alistipes)可能通过调控IL-12、IFN-γ表达影响宿主免疫应答。
[关键词] 非小细胞癌;肠道菌群;免疫功能;中医证型
[中图分类号] R273 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.06.001
Study on the correlation between different traditional Chinese medicine evidence types and intestinal flora-immune function in non-small cell lung cancer
ZHOU Xiacheng1, LIU Yuancai1, SUN Mengying1, YANG Jiaying1, CHEN Zhuo2, ZHANG Aiqin2
1.The Second Clinical School, Zhejiang University of Traditional Chinese Medicine, Hangzhou 310005, Zhejiang, China; 2.Department of Traditional Chinese Medicine, Zhejiang Cancer Hospital, Hangzhou Institute of Medicine (HIM), Chinese Academy of Sciences, Hangzhou 310022, Zhejiang, China
[Abstract] Objective To explore the basic characteristics of intestinal flora and immune function in different traditional Chinese medicine evidence-based non-small cell lung cancer. Methods A total of 46 patients with non-small cell lung cancer who were diagnosed in the Department of Thoracic Surgery, Zhejiang Cancer Hospital from March to October 2019 were selected as the patient group, including 13 cases in the Qi stagnation and blood stasis evidence group, 12 cases in the spleen deficiency and dampness stagnation evidence group, 7 cases in the Qi and Yin deficiency evidence group, and 14 cases in the Yin deficiency and internal heat evidence group as the patient groups, and 12 healthy volunteers were selected as the healthy control group, collected stool specimens, and intestinal microecology was detected by 16S rDNA technique. Collect serum samples from enrolled individuals and compare their levels of interleukin (IL)-12 and interferon-γ (IFN-γ) using enzyme linked immunosorbent assay (ELISA). Results Compared with the healthy control group, among the top 20 strains in terms of relative abundance of genus levels, there were 6 differential genera in the Qi and Yin deficiency evidence group, 4 differential genera in the Yin deficiency internal heat evidence group, 5 differential genera in the Qi stagnation and blood stasis evidence group, and 3 differential genera in the spleen deficiency and dampness stagnation evidence group. The IL-12 level in serum was significantly lower in Qi stagnation and blood stasis group, and the IFN-γ level in serum was significantly higher in Qi and Yin deficiency group, but the rest were not significant. Conclusion Different traditional Chinese medicine evidence of non-small cell lung cancer have specific intestinal flora, Roseburia and Alistipes may affect the host immune response by regulating IL-12 and IFN-γ expression.
[Key words] Non-small cell lung cancer; Intestinal flora; Immune function; Traditional Chinese medicine evidence
肺癌是目前世界范围内发病率和死亡率最高的恶性肿瘤[1]。肠道微生态是影响人体健康的重要因素,研究表明肠道菌群可通过调节炎症、免疫反应等影响肿瘤的发生、发展[2-5]。中医证候是疾病发展过程中某个阶段生理、病理变化的高度概括,具有动态性和即时性的特征[6]。目前,“如何为中医证候提供客观的评判依据?如何用内在的变化表征外在的表现?”等问题已成为中医药领域的研究热点。运用生物学方法研究中医证候,有助于从客观上揭示证候的本质[7]。因此,本研究运用16SrDNA和酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)对不同中医证型非小细胞肺癌(non-small cell lung cancer,NSCLC)进行肠道微生态学和免疫功能的研究,从生物学角度分析NSCLC中医证候的诊断依据,为今后中医药治疗NSCLC提供理论支持,为中医药抗肿瘤治疗提供依据。
1 资料与方法
1.1 诊断标准
患者相关病理报告示:组织病理学和(或)细胞学证实为NSCLC[8]。患者本人证候主诉符合《中医临床诊疗术语·证候部分》中医证诊断标准[9]: ①气阴两虚证:咳嗽痰少,气短息弱,声低懒言,面色觥白,自汗或盗汗,口干少饮,诸症劳累后加剧,舌质淡嫩或偏红,脉细弱;②阴虚内热证:咳嗽少痰或无痰,或痰中带血丝,口干、口渴,潮热盗汗,夜寐不安,大便燥结,舌红少苔或无苔,脉细数;③脾虚湿滞证:咳嗽痰多,痰白或黄白相兼,不欲食或纳少腹胀便溏,面色萎黄,舌淡苔白腻有齿痕,脉滑;④气滞血瘀证:咳嗽不畅,痛处固定,拒按,夜间加剧,面色黯淡,舌质紫边尖有瘀点,脉涩或结代。
1.2 纳入、排除及脱落标准
纳入标准:①符合1.1中的诊断标准;②无其他恶性肿瘤个人史;③符合中医辨证标准;④年龄18~70岁;⑤患者本人同意并签署知情同意书。排除标准:①患者近14d内使用过抗生素治疗;②有精神疾病,无完全民事行为能力。脱落标准:①患者依從性差;②患者要求终止试验。
1.3 样本量估算
本研究采用Logistic分析,拟探查变量有6项,相关资料显示Logistic回归样本量要求每个自变量需有10~15个样本,经计算得出需收集60~90例患者样本。
1.4 一般资料
选取2019年3月—10月于浙江省肿瘤医院胸外科门诊就诊且诊断为NSCLC,并拟行肺癌根治术的患者作为患者组。患者入组前经中医科两名副主任以上中医师同时辨证为气滞血瘀证、脾虚湿滞证、气阴两虚证或阴虚内热证。本研究共收集样本70例,其中排除或退出24例,共纳入46例,其中气滞血瘀证组13例,脾虚湿滞证组12例,气阴两虚证组7例,阴虚内热证组14例。选取同期12名健康志愿者为对照组。本研究经浙江省肿瘤医院伦理委员会审批通过(伦理审批号:IRB-2018-219)。
1.5 质量控制
1.5.1 组织培训 研究开始前综合培训相关研究员,明确纳排标准,并严格执行,要求各研究员熟练掌握样本采集操作及储存方式。
1.5.2 入组评估 患者入组前需经2名副主任以上中医师同时辩证确认分型,若有分歧则再请一名主任中医师重新评估,方可入组。
1.5.3 标本采集 采集粪便标本过程中尽量采取无菌操作,过程迅速,尽量减少标本与空气的接触时间,并及时将标本放至–80℃冰箱内冻存备用。
1.6 观察指标及方法
1.6.1 肠道微生态分析 DNA提取:使用DNA提取试剂盒对粪便总DNA进行提取,将样本进行16S V3-V4区域扩增。聚合酶链反应(polymerase chain reaction,PCR)分析:以稀释后的基因组DNA为模板进行PCR。将1.5μl PCR产物置于120V电压下持续电泳20min,再使用凝胶成像系统进行紫外线成像拍照。质检测序:质检合格后进行浓度定量,并进行相应的比例混合,最后运行Miseq测序程序。引物信息见表1。
1.6.2 白细胞介素(interleukin,IL)-12和干扰素γ(interferon,IFN-γ)检测 ①分组:准备酶标包被板,将其置于框架上,选择一处加入50μl标准品,标记为标准品孔;另选一处加入10μl待测样本及40μl样本稀释液,标记为待测样品孔;选取一处空白对照孔。分别向待测样本孔、标准品孔加入100μl辣根过氧化物酶(horseradish peroxidase,HRP)标记的检测抗体。②温育:将酶标包被板置于37℃ CO2孵箱中温育1h后取出,倒掉多余液体,用无菌磷酸缓冲液(phosphate buffered saline,PBS)洗板5次,每个孔250μl。③显色:每孔分别加入50μl显色剂A液及显色剂B液,混匀30s后把板置于37℃湿润的培养箱中避光显色15min,再加入50μl终止液终止反应。④测量:测量各孔的吸光值并记录分析数据。
1.7 统计学方法
采用SPSS 26.0统计学软件对数据进行分析处理。计量资料以均数±标准差(![]() )表示,比较采用单因素方差分析或独立样本t检验,计数资料以例数(百分率)[n(%)]表示,比较采用c2检验,P<0.05为差异有统计学意义。
)表示,比较采用单因素方差分析或独立样本t检验,计数资料以例数(百分率)[n(%)]表示,比较采用c2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组患者一般资料的比较
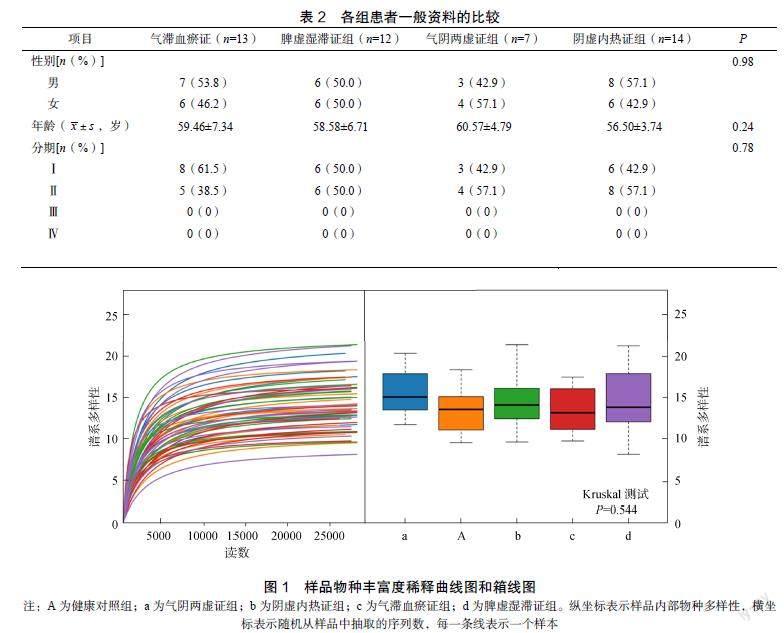
符合纳排标准的NSCLC患者46例,病理类型均为腺癌。气滞血瘀证组13例,其中男7例,女6例;平均年龄(59.46±7.34)岁;Ⅰ期病例8例(61.5%),Ⅱ期病例5例(38.5%)。气阴两虚证组7例,其中男3例,女4例;平均年龄(60.57±4.79)岁;Ⅰ期病例3例(42.9%),Ⅱ期病例4(57.1%)。脾虚湿滞证组12例,其中男6例,女6例;平均年龄(58.58±6.71)岁;Ⅰ期病例6例(50.0%),Ⅱ期病例6例(50.0%)。阴虚内热证组14例,其中男8例,女6例;平均年龄(56.50±3.74)岁;Ⅰ期病例6例(42.9%),Ⅱ期病例8例(57.1%)。各组患者在疾病分期、年龄、性别等方面比较,差异无统计学意义(P>0.05),具有可比性,见表2。
2.2 微生态组间差异
2.2.1 操作分类单元(operational taxonomic units,OUT)聚类及稀释曲线 稀释曲线可用来反映测序的数据量是否足以反映样品内部物种的多样性。曲线上升趋势随读数条数的增加而逐渐趋于平坦,反映本研究的数据量较为合理,见图1。
2.2.2 韦恩图 本研究对58个样品进行16S测序分析,共产生284个分类操作单元(operational taxonomic unit,OTU)。其中,5组样本有117个共有OTU,相比于健康对照组,气滞血瘀证组有13个特有的OUT,气阴两虚证组有3个特有的OTU,脾虚湿滞证组有15个特有的OTU,阴虚内热证组有7个特有的OTU,健康对照组有18个特有的OUT,见图2。
2.2.3 肠型分析 不同中医证型的肺癌患者肠道菌群结构存在差异。其中,气阴两虚证组与阴虚内热证组的样本点较集中,菌群组成分布较为相似;脾虚湿滞证組与气滞血瘀证组的样本点较分散,群菌组成分布差异相对较大,见图3。
2.2.4 差异物种分析 不同中医证型中属水平差异性菌属相对丰度排行前20的种系中,气阴两虚证组有6个差异性菌属,其中罗斯菌属(Roseburia)、芽殖菌属(Gemmiger)、毛螺菌属(Lachnospiracea)、另枝菌属(Alistipes)较健康组显著富集;放线菌属(Actinomyces)、肠杆菌属(Enterobacteriaceae)、克雷伯菌属(Klebsiella)较健康组显著降低。阴虚内热证组有4个差异性菌属,其中,罗斯菌属、毛螺菌属、瘤胃菌属(Ruminococcaceae)较健康组显著富集;埃希菌属/志贺杆菌属(Escherichia/Shigella)较健康组显著降低。气滞血瘀证组有5个差异性菌属,其中,毛螺菌属、普氏菌属(Prevotella)、梭菌属(Clostridium XⅠVa)、双歧杆菌属(Bifidobacterium)较健康组显著富集;放线菌属(Actinomyces)较健康组显著降低。脾虚湿滞证组有3个差异性菌属,其中,副细菌(Parabacteroides)较健康组显著富集;而链球菌属(Streptococcus)、放线菌属较健康组显著降低。
2.3 各组纳入者的血清IL-12、IFN-γ含量比较
与健康对照组比较,气阴两虚证组患者血清中的IFN-γ含量显著升高(P<0.05);气滞血瘀证组患者血清中的IL-12含量显著降低(P<0.01),其余组间差异无统计学意义(P>0.05),见表3。
3 讨论
基于本研究结果,笔者推测肺癌中医证候变化的实质可能与肠道中某些菌群的数量变化或种类有关。故假设通过观察不同中医证型NSCLC患者肠道菌群的多样性及差异性,来探究NSCLC患者不同中医证型的生物学基础,从而阐释中医证候的科学机理。
免疫失调是致使肺癌发生、发展的重要原因[10]。IFN-γ是一种具有抗病毒、抗肿瘤和免疫调节作用的细胞因子,是机体发挥免疫作用不可缺少的成分[11]。IL-12被认为是调节免疫系统反应最有意义的细胞因子之一[12]。本研究结果提示,气滞血瘀组血清中IL-12含量较健康组显著降低,气阴两虚组血清中的IFN-γ含量较健康组显著升高,其余无显著性差异。在4个证型中,血清IFN-γ的浓度均高于健康组。笔者推测早期肺癌患者正气尚足,处于邪正交争阶段,从而促进宿主分泌IFN-γ调节免疫功能及增强抗肿瘤作用。
特定的肠道微生物与宿主免疫系统相互调节,共同影响人体健康[13-17]。有学者发现菌群可通过激活Myd88通路来刺激免疫细胞分泌IL-1β及IL-23,进一步诱导肺部产生IL-17的γδT细胞(主要是Vγ6+ Vδ1+ T细胞)增殖与活化,从而促进肺部肿瘤发展[18]。本研究中,罗斯菌属、另枝菌属的丰度在气阴两虚组中均较健康组显著富集。相关研究证实,罗斯菌属作为肠道中的有益菌,可促进免疫系统的抗肿瘤作用。Kenya Honda研究团队发现另枝菌属等11株肠道微生物可增加INFγ+CD8+T细胞水平,提高由这些菌群介导的抗肿瘤免疫反应[19]。笔者推测,气阴两虚组血清中的IFN-γ、IL-12浓度均较其他3个证型组高可能与肠道罗斯菌属、另枝菌属有关。此外,本研究还检测出诸多目前尚未证实影响肿瘤发展及免疫应答的菌属,有待于进一步研究。
证候的生物学基础是中医药现代化研究的关键部分,生物学方法的运用有助于阐明中医药的科学本质。笔者认为菌群的数量、结构、种类及人体与菌群之间都维持着相对的动态平衡,一旦平衡被破坏,就会导致菌群的失调进而影响疾病的发生、发展。这种微生态理论与中医学中的阴阳学说、整体观等基础理论不谋而合。本研究对不同中医证型NSCLC患者进行肠道微生态学和免疫功能的分析,有助于为肺癌的中医证候研究提供新思路。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics2018: GLOBOCAN estimates of incidence and mortality world wide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424.
[2] GAGNIERE J, RAISCH J, VEZIANT J, et al. Gut microbiota imbalance and colorectal cancer[J]. World J Gastroenterol, 2016, 22(2): 501–518.
[3] HOLTMEIER W, KALLER J, GEISEL W, et al. Development and compartmentalization of the porcine TCR delta repertoire at mucosal and extraintestinal sites: The pig as a model for analyzing the effects of age and microbial factors[J]. J Immunol, 2002, 169(4): 1993–2002.
[4] APPLEYARD C B, CRUZ M L, ISIDRO A A, et al. Pretreatment with the probiotic VSL-3 delays transition from inflammation to dysplasia in a rat model of colitis-associated cancer[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301(6): G1004–G1013.
[5] ZHANG J W, DU P, GAO J, et al. Preoperative probiotics decrease postoperative infectious complications of colorectal cancer[J]. Am J Med Sci, 2012, 43(3): 199–205.
[6] 陳卓, 马冠君, 钱祥, 等. 多组学技术在非小细胞肺癌脾虚湿滞证中的应用研究[J]. 浙江中医药大学学报, 2022, 46(1): 12–22.
[7] 陈卓, 钱祥, 傅晓璇, 等. 基于系统生物学的非小细胞肺癌气阴两虚证多组学联合分析研究[J]. 浙江中西医结合杂志, 2021, 31(11): 1000–1006.
[8] 李进. 中国临床肿瘤学会(CSCO)原发性肺癌诊疗指南[M]. 北京: 人民卫生出版社, 2019.
[9] 中华人民共和国技术监督局. 中医临床诊疗术语·证候部分[S]. GB/T16751. 2–1997. 北京: 中国标准出版社, 1997: 12.
[10] HAO Z, LIN M, DU F, et al. Systemic immune dysregulation correlates with clinical features of early non-small cell lung cancer[J]. Front immunol, 2021, 12: 754138.
[11] 王淑敏. 肺癌細胞HMGB1对IFN-γ诱导PD-L1表达水平影响的研究[D]. 郑州: 郑州大学, 2019.
[12] 张晓妮, 胜利. IL-12抗肿瘤作用机制的研究进展[J]. 医学综述, 2018, 24(2): 301–305.
[13] VALDES A M, JENS W, ERAN S, et al. Role of the gut microbiota in nutrition and health[J]. BMJ, 2018, 361: k2179.
[14] BEYOGLU D, SMITH R L, IDLE J R. Dog bites man or man bites dog? The enigma of the amino acid conjugations[J]. Biochem Pharmacol, 2012, 83: 1331–1339.
[15] MICHAEL C A, LISA C O, LAUREL M, et al. Commensal bacteria calibrate the activation threshold of innate antiviral immunity[J]. Immunity, 2012, 37(1): 158–170.
[16] UMESAKI Y, SETOYAMA H. Structure of the intestinal flora responsible for development of the gut immune system in a rodent model[J]. Microbes Infect, 2000, 2(11): 1343–1351.
[17] HAISER H J, TURNBAUGH P J. Is it time for a metagenomic basis for therapeutics[J]. Science, 2012, 336(6086) : 1253–1255.
[18] JIN C, LAGOUDAS G K, ZHAO C, et al. Commensal microbiota promote lung cancer development via γδ T cells[J]. Cell, 2019, 176(5): 998–1013.
[19] TANOUE T, MORITA S, PLICHTA D R, et al. A defined commensal consortium elicits CD8 T cells and anti–cancer immunity[J]. Nature, 2019, 565(7741): 600–605.
(收稿日期:2023–01–09)
(修回日期:2024–02–23)
