外泌体负载的KV11通过VDAC1和自噬机制对角膜新生血管的抑制作用
2024-03-15陈文倩杜玮于文贞
陈文倩 杜玮 于文贞
北京大学人民医院眼科 北京大学人民医院眼视光中心 北京大学人民医院眼病与视光医学研究所 视网膜脉络膜疾病诊治研究北京市重点实验室 北京大学医学部眼视光学院,北京 100044
角膜是重要的屈光介质之一,无血管是其维持光学透明的主要原因之一[1-2]。但在缺氧、炎症、创伤等情况下,角膜缘血管网的新生血管容易生长到角膜内,对角膜的透光性造成损害,从而导致视力下降,称为角膜新生血管(corneal neovascularization,CNV)[3-4]。现有的CNV治疗方法存在一定缺陷和局限性,如糖皮质激素诱导的青光眼、抗血管内皮生长因子(vascular endothelial growth cell,VEGF)药物对于成熟CNV效果较差、光动力疗法对周围角膜和角膜缘干细胞造成损害等[2,5]。CNV治疗方法的部分有效性和相关不良反应提示我们,需要探索新的CNV治疗方法。Kringle结构域广泛存在于纤溶酶原和载脂蛋白中,在抑制血管生成中发挥关键作用,尤其是Kringle V(KV)[6-10]。KV可抑制胃癌、肝细胞癌和CNV等的形成[11-13],KV来源的十一肽KV11(YTMNPRKLFDY)对视网膜新生血管具有明显抑制作用[14-15]。然而,短肽存在不稳定、生物膜渗透性较差等缺点[16-18]。因此,需要一种药物载体协助KV11在体内稳定发挥抑制血管生成的作用。外泌体(exosome,EXO)是各种细胞分泌的直径为30~150 nm的胞外囊泡[19-20],可以作为药物的微载体直接将药物递送入细胞,增强药物稳定性,延长药物半衰期[21-22]。Gao等[23]研究发现了一种名为CP05的锚定肽,可以靶向EXO膜标记蛋白CD63,从而负载药物。Dong等[24]利用CP05将KV11负载到EXO上,发现该系统可以通过侵袭性较低的方式较好地治疗视网膜新生血管。然而,EXO-KV11对CNV的作用及其机制尚不清楚。本研究拟探讨EXO负载抗新生血管短肽KV11在CNV中的作用和相关机制,以期为EXO-KV11可能的临床应用提供实验基础。
1 材料与方法
1.1 材料
1.1.1细胞及动物来源 原代人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自浙江美森科技有限公司。8周龄SPF级健康雄性SD大鼠100只,体质量180~220 g,购自北京华阜康实验动物技术有限公司[许可证号:SCXK(京)2019-0008]。其中10只大鼠不做任何处理,为正常对照组;其余大鼠均经角膜碱烧伤构建CNV模型。本研究经北京大学人民医院动物伦理委员会批准(批文号:20210019),所有动物操作均符合视觉与眼科学协会及北京大学动物保护与使用委员会的规定。
1.1.2主要试剂及仪器 短肽KV11(YTMNPRKLFDY)、KV11(CP05)(YTMNPRKLFDYCRHSQMTVSRL)、FITC标记的KV11(CP05)(苏州强耀生物科技有限公司);ECM培养基(美国Sciencell公司);总EXO提取试剂(细胞培养基)、Bis-Tris预制胶、MOPS SDS电泳缓冲液、MES SDS电泳缓冲液、RIPA溶液(美国Thermo公司);0.22 μm、0.45 μm NC膜(德国Merck Millipore公司);蛋白酶抑制剂混合物(苏州新赛美生物科技有限公司);电转缓冲液、BCA蛋白定量试剂盒(北京兰博利德生物技术有限公司);TBS封闭液(美国LI-COR公司);兔抗四跨膜蛋白30(tetraspanin 30,CD63)多克隆抗体(25682)、兔抗电压依赖性阴离子通道1(voltage-dependent anion channel 1,VDAC1)多克隆抗体(55259)、兔抗半胱氨酸蛋白酶3(caspase 3)多克隆抗体(19677)、鼠抗β-actin单克隆抗体(66009)(武汉Proteintech公司);兔抗蛋白质激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)单克隆抗体(C33E10)、兔抗自噬接头蛋白1(sequestosome-1,SQSTM1/p62)单克隆抗体(D10E10)(美国Cell Signaling Technology公司);兔抗血小板内皮细胞黏附分子1(platelet endothelial cell adhesion molecule-1,CD31)多克隆抗体(ab281583)、兔抗自噬微管相关蛋白轻链3B(microtubule-associated proteins 1A/1B light chain 3B,LC3B)单克隆抗体(ab192890)(美国Abcam公司);CruzFluorTM790标记小鼠抗兔IgG(sc-516253)、CruzFluorTM790标记小鼠IgG κ结合蛋白(sc-516181)(美国Santa Cruz公司);异硫氰酸荧光素标记的右旋糖酐(FITC-dextran,相对分子质量2 000 000)(德国Sigma公司);异氟烷(深圳瑞沃德生命科技有限公司)。Olympus BX41倒置显微镜(日本Olympus公司);Apogee A-50微流式细胞仪(美国Apogee公司);石蜡切片机、透射电子显微镜JEM-1400(德国Leica公司);Nanosight NS300纳米跟踪分析仪(英国Malvern公司);裂隙灯显微镜(日本拓普康公司);Odyssey Clx显影仪(美国LI-COR公司)。
1.2 方法
1.2.1细胞培养 HUVECs用ECM完全培养基于37 ℃、5%CO2培养箱中培养,当细胞生长至70%融合时,将细胞消化常规传代或低温保存。取第3~6代HUVECs用于后续实验。
1.2.2免疫荧光染色法鉴定细胞 取细胞爬片,4%多聚甲醛固定30 min,磷酸盐缓冲液(phosphate buffer saline,PBS)洗3次,每次5 min;滴加5%Triton X-100,室温下孵育15 min,甩干载玻片上的液滴,滴加封闭液,室温下孵育1 h;甩干载玻片上的封闭液,加CD31抗体50 μl,4 ℃孵育过夜;PBS洗3次,每次5 min;加入荧光二抗50 μl,室温下避光孵育1 h;PBS洗3次,每次5 min;加入50 μl DAPI染核10 min,PBS洗3次,每次5 min;抗荧光猝灭剂封片,荧光显微镜下观察并拍照。
1.2.3HUVECs源EXO的提取和鉴定 实验前将胎牛血清(fetal bovine serum,FBS)以100 000×g超速离心16 h以耗竭FBS源EXO。通过总EXO分离试剂盒(细胞培养基)分离HUVECs来源的EXO。将HUVECs在T75中培养48~72 h,收集培养液,2 000×g离心30 min,弃去细胞和碎片。将上清液与1/2体积的总EXO分离试剂在4 ℃下孵育过夜。将混合物在4 ℃下10 000×g离心1 h。每毫升上清生成的EXO沉淀用10 μl生理盐水重悬,并采用纳米粒子跟踪分析、透射电子显微镜观察EXO的浓度和大小形态,采用Western blot实验进行EXO标志物鉴定。BCA检测EXO蛋白质量浓度约为2 μg/μl。
1.2.4EXO-KV11的合成和鉴定 FITC标记的KV11(CP05)与EXO在4 ℃下避光孵育过夜。通过配备488 nm激发光的Apogee A-50微流式细胞仪检测EXO负载KV11的效率。Apogee参考混合珠由折射率为1.42且直径为180、240、300、590、880、1 300 nm非荧光二氧化硅微球和折射率为1.59且直径为110 nm和500 nm的绿色荧光乳胶球组成。使用Apogee参考混合珠进行校正,样品上样进行检测,采样速度为0.75 μl/min,样品体积不小于150 μl,采样时间为180 s。EXO浓度和荧光阳性事件数(n)根据样品体积、细胞仪流速自动测量。采用中角光散射和488 nm荧光触发通道,并定义带有FITC荧光、直径为30~180 nm的颗粒为EXO-KV11(FITC)阳性事件。
1.2.5大鼠角膜碱烧伤诱导CNV模型的建立 采用2.5%异氟醚麻醉大鼠。直径为3 mm的圆形滤纸片浸于1 mol/L NaOH溶液中30 s,吸水纸吸去多余液体,烧灼大鼠角膜中心30 s(第0天),用15 ml生理盐水充分清洗结膜囊以去除残余的NaOH溶液。采用随机数字表法随机将碱烧伤角膜大鼠分为EXO-KV11组30只、KV11组30只和生理盐水组30只(本课题组体外实验结果表明,单纯EXO组与生理盐水组指标差异无统计学意义,因此动物实验排除了单纯EXO这一对照组)。从碱烧伤后第1天开始,各组分别每隔1 d给予结膜下注射100 μl EXO-KV11(25 μg)、KV11(25 μg)或生理盐水。在第1、4、7、14天,裂隙灯显微镜下观察CNV生长情况并拍照。
1.2.6大鼠CNV相对荧光面积定量分析 参照文献[25]中的方法对裂隙灯显微镜下的角膜照片进行CNV定量分析。测量角膜缘血管长度(L)和角膜钟时数(C),CNV面积=C/12×3.141 6[r2-(r-L)2],其中r=3 mm,为大鼠角膜半径。为了进一步精确计算CNV面积,通过FITC-dextran心室灌注、角膜血管造影计算角膜荧光面积与角膜总面积的比值来定量分析CNV相对荧光面积[26]。采用氯胺酮(80 mg/kg)/噻拉嗪(10 mg/kg)麻醉大鼠,左心室灌注25 mg/ml FITC-dextran 1 ml;1 min后,摘取眼球并在4%多聚甲醛溶液中固定30 min。眼球后节组织分离后将大鼠角膜平均剪成4瓣平铺在玻片上,荧光显微镜下观察并拍照。采用Image Pro Plus 6软件检测CNV荧光面积与角膜总面积的比值,定量分析CNV相对荧光面积。
1.2.7苏木精-伊红染色观察各组CNV管腔数量 每组选取6只大鼠,于14 d过量麻醉处死后摘取眼球,4%多聚甲醛固定24 h,置于55%乙醇中过夜,梯度乙醇(60%、70%、80%、90%、100%)脱水,二甲苯透明5 min,浸蜡1 h,石蜡包埋,4 μm厚连续切片,37 ℃烤片过夜。按照试剂盒说明书进行苏木精-伊红染色,观察各组角膜形态和基质CNV数量。
1.2.8免疫组织化学法检测大鼠角膜组织中CD31的表达分布 每组取8只大鼠,将组织石蜡切片置于60 ℃烤箱中烤片2 h,PBS浸洗后放入0.01 mol/L枸橼酸盐缓冲液,100 ℃水浴30 min修复抗原;自然冷却后于3%H2O2溶液中室温孵育10 min,10%山羊血清溶液中室温封闭30 min;滴加兔抗CD31一抗(1∶500),4 ℃孵育过夜;PBS浸洗3次,滴加山羊抗鼠HRP标记二抗(1∶100),室温孵育30 min;PBS浸洗3次,滴加适当比例的HRP标记链霉卵白素,室温孵育30 min,滴加DAB显色液显色15 s~3 min,显微镜下观察组织呈褐色,立即放入水中中止反应,采用苏木素染液复染核。切片用中性树脂封片后于显微镜下观察并拍照。
1.2.9Western blot法检测VDAC1和内质网应激、自噬及凋亡相关蛋白表达量 每组取5只大鼠,HUVECs和角膜组织的蛋白通过RIPA裂解液提取。制备好的蛋白样品通过SDS凝胶电泳后电转到0.22或0.45 μm的NC膜上,封闭液封闭1.5 h,分别加入CD63、VDAC1、PERK、p62、LC3B、caspase 3或β-actin(均1∶1 000稀释)抗体,4 ℃下孵育过夜;TBST洗3次后分别用相应二抗常温下避光孵育1 h,在Odyssey Clx显影仪上显影。采用ImageJ软件定量分析条带,以β-actin为内参,目的蛋白相对表达量=目的蛋白灰度值/β-actin灰度值;LC3B蛋白表达量=LC3BⅡ灰度值/LC3BⅠ灰度值。
1.3 统计学方法

2 结果
2.1 HUVECs形态观察及表型鉴定
原代HUVECs传代培养至第3~6代,细胞形态均匀一致,呈铺路石样。免疫荧光检测结果显示,第3代HUVECs高表达内皮细胞标志物CD31(图1)。
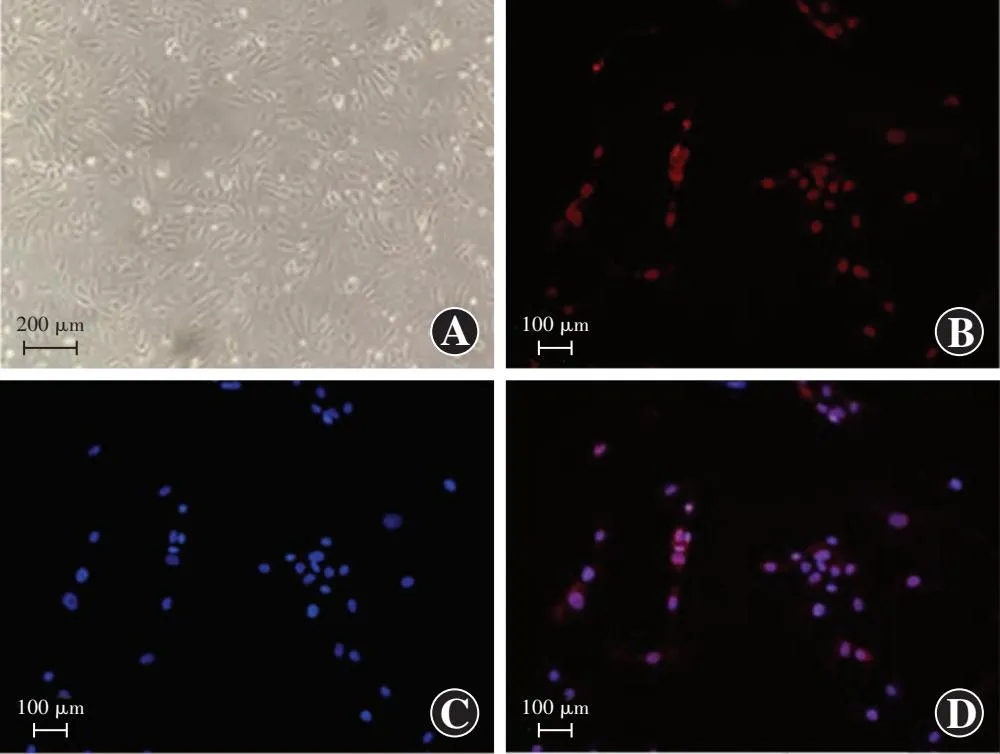
图1 HUVECs形态及CD31表达 A:第3~6代HUVECs呈铺石路样形态(×100,标尺=200 μm) B:HUVECs CD31染色阳性(×400,标尺=100 μm) C:DAPI染色见细胞核居于细胞中央(×400,标尺=100 μm) D:图B和C的融合图(×400,标尺=100 μm)Figure 1 Morphological observation of HUVECs and expression of CD31 A:The paving-stone pattern of primary HUVECs at passage 3-6 under a microscope (×100,scale bar=200 μm) B:HUVECs positive for CD31 staining (×400,scale bar=100 μm ) C:DAPI staining showed that the nuclei were in the center of cells (×400,scale bar=100 μm) D:Emerged images B and C (×400,scale bar=100 μm)
2.2 EXO的鉴定及其与KV11(CP05)的结合效率
通过透射电子显微镜、纳米粒径分析仪和Western blot法鉴定EXO,结果显示提取的EXO为双面凹的杯状囊泡(图2A);平均直径为127 nm,浓度为(2.15×109±6.55×107)particles/ml(图2B);EXO标志蛋白CD63阳性(图2C)。Apogee流式检测不同浓度比(EXO∶KV11=2∶1、1∶1、1∶2、1∶4)下EXO负载KV11的效率,结果表明当EXO∶KV11=1∶4(6.25 μg/ml∶25 μg/ml)时,结合效率最佳,为87.5%,后续实验采用此浓度(图2D)。
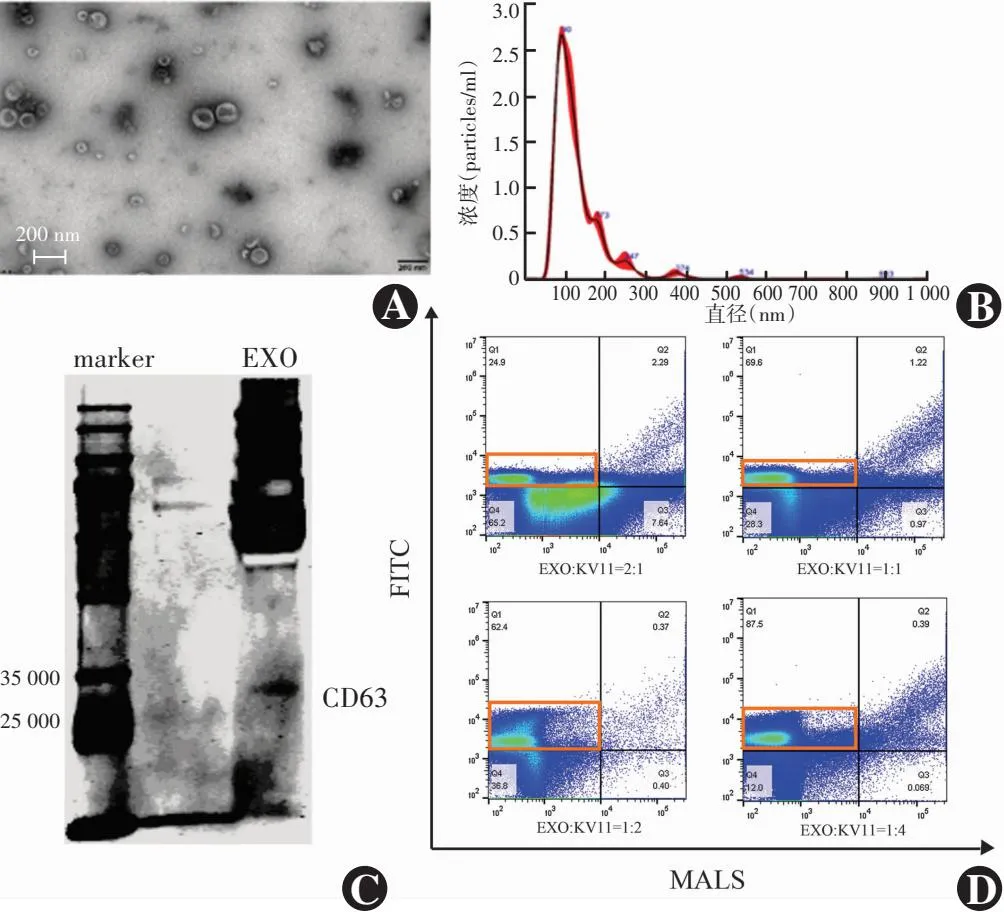
图2 外泌体的形态及其与KV11(CP05)的结合效率 A:HUVECs来源的外泌体透射电子显微镜图像(×100 000,标尺=200 nm) B:纳米粒径分析HUVECs来源的外泌体大小分布 C:Western blot分析HUVECs来源外泌体中CD63蛋白表达 D:Apogee流式检测外泌体与FITC标记的KV11(CP05)不同浓度比下结合形成EXO-KV11(FITC)的效率[橙色方框圈出EXO-KV11(FITC)阳性事件] EXO:外泌体Figure 2 Morphology of exosomes and its binding efficacy with KV11 (CP05) A:Transmission electron microscopy image of HUVECs-derived exosomes (×100 000,scale bar=200 nm) B:Nano-particle size analysis of the size distribution of HUVECs-derived exosomes C:Expression of CD63 protein in HUVECs-derived exosomes by Western blot D:Apogee flow system analysis for the efficiency of exosomes binding to FITC-labeled KV11 (CP05) at different concentration ratios (orange box indicated EXO-KV11 (FITC) positive events) EXO:exosome;KV:kringle V
2.3 各组CNV不同指标及CD31表达情况比较
2.3.1各组大鼠角膜碱烧伤后不同时间点裂隙灯显微镜下CNV形成比较 碱烧伤1 d,各组角膜中央基质混浊,球结膜充血,角膜组织几乎无新生血管长入;碱烧伤4 d,可见各组新生血管芽从角膜缘长入角膜;碱烧伤7 d,EXO-KV11组CNV面积小于KV11组和生理盐水组;碱烧伤14 d,EXO-KV11组和KV11组CNV面积均小于生理盐水组,EXO-KV11组CNV面积小于KV11组(图3)。碱烧伤后7 d和14 d,各组CNV面积总体比较差异均有统计学意义(F=4.613、15.590,均P<0.05),其中碱烧伤后7 d,EXO-KV11组CNV面积小于KV11组和生理盐水组;碱烧伤14 d,EXO-KV11组和KV11组CNV面积均小于生理盐水组,EXO-KV11组CNV面积小于KV11组,差异均有统计学意义(均P<0.05)(表1)。

表1 各组大鼠角膜碱烧伤后7 d 和14 d CNV面积比较 (,mm2)Table 1 Comparison of CNV area after corneal alkali-burn injury in rats on days 7 and 14 among various groups (,mm2)
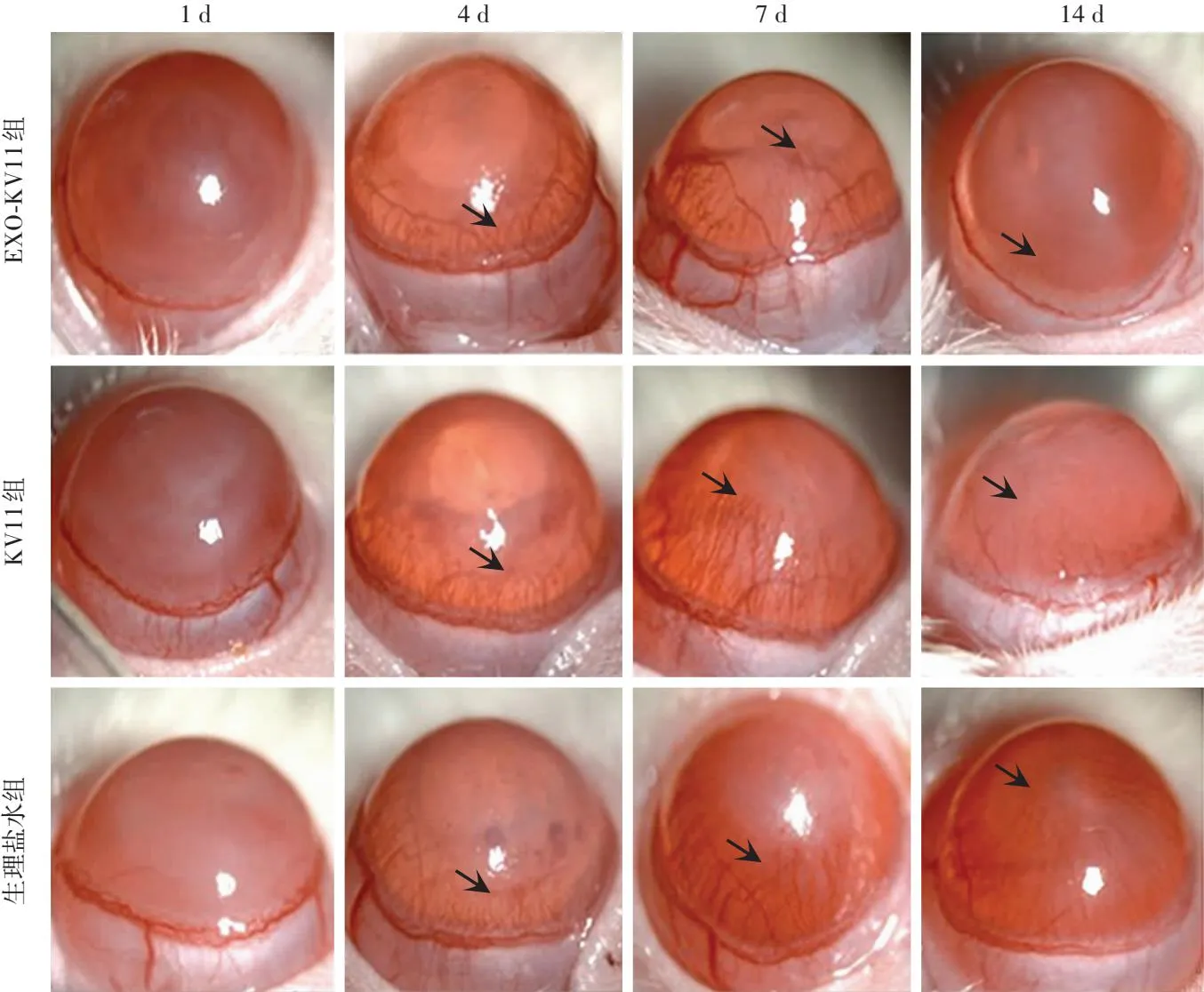
图3 各组大鼠碱烧伤后不同时间点裂隙灯显微镜下图像(×16) 碱烧伤1 d,各组大鼠角膜中央基质混浊,球结膜充血,角膜组织几乎无新生血管长入;碱烧伤4 d,各组新生血管芽从角膜缘长入角膜;碱烧伤7 d,EXO-KV11组CNV面积小于KV11组和生理盐水组;碱烧伤14 d,EXO-KV11组和KV11组CNV面积均小于生理盐水组,EXO-KV11组CNV面积小于KV11组 箭头示CNV EXO:外泌体Figure 3 Slit-lamp images of rat eyeballs at different time points after corneal alkali burns in each group (×16) On day 1 after alkali burn,cloudy central corneal matrix and congested bulbar conjunctiva were seen,and almost no new blood vessels grew in corneal tissue.On day 4 after alkali burn,neovascularization buds grew from the corneal limbus into the cornea could be seen in each group.On day 7 after alkali burn,the CNV area was smaller in EXO-KV11 group than in KV11 and normal saline groups.On day 14 after alkali burn,the CNV area was smaller in EXO-KV11 and KV11 groups than in normal saline group,and was smaller in EXO-KV11 group than in KV11 group The arrows showed CNV EXO:exosome;KV:kringle V
2.3.2各组大鼠CNV相对荧光面积比较 角膜碱烧伤后14 d,生理盐水组新生血管已长入角膜中央,CNV荧光面积最大,新生血管密集,迂曲扩张;KV11组CNV相对荧光面积较生理盐水组小,新生血管密度较稀疏,迂曲扩张程度较轻;EXO-KV11组CNV面积最小,新生血管密度稀疏,迂曲扩张程度最轻。角膜荧光铺片定量分析结果显示,生理盐水组、KV11组和EXO-KV11组CNV相对荧光面积分别为(8.3±1.7)%、(5.2±1.6)%和(3.4±0.7)%,总体比较差异有统计学意义(F=11.735,P<0.01),其中KV11组和生理盐水组CNV相对荧光面积均大于EXO-KV11组,生理盐水组CNV相对荧光面积大于KV11组,差异均有统计学意义(均P<0.05)(图4)。
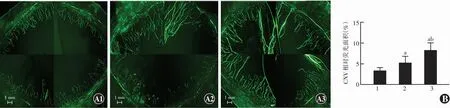
图4 各组CNV相对荧光面积比较 A:各组碱烧伤后14 d角膜荧光铺片(FITC-dextran ×40,标尺=1 mm)(A1:EXO-KV11组;A2:KV11组;A3:生理盐水组) B:CNV荧光面积与角膜总面积之比的定量分析 F=11.735,P<0.01.与EXO-KV11组比较,aP<0.05;与KV11组比较,bP<0.05(单因素方差分析,LSD-t检验,n=8) 1:EXO-KV11组;2:KV11组;3:生理盐水组 CNV:角膜新生血管Figure 4 Comparison of CNV fluorescence area among various groups A:Corneal fluorescence flat mounts on day 14 after alkali burn in different groups (FITC-dextran ×40,scale bar=1 mm) (A1:EXO-KV11 group;A2:KV11 group;A3:normal saline group) B:Quantitative analysis of the ratio of the CNV area to the total cornea area F=11.735,P<0.01.Compared with EXO-KV11 group,aP<0.05;compared with KV11 group,bP<0.05 (One-way ANOVA,LSD-t test,n=8) 1:EXO-KV11 group;2:KV11 group;3:normal saline group CNV:corneal neovascularization
2.3.3各组大鼠角膜组织形态学特征比较 碱烧伤后14 d,生理盐水组基质内可见大量新生血管管腔;KV11组基质内新生血管管腔数量较生理盐水组少;EXO-KV11组角膜结构趋于正常,少见新生血管管腔(图5)。
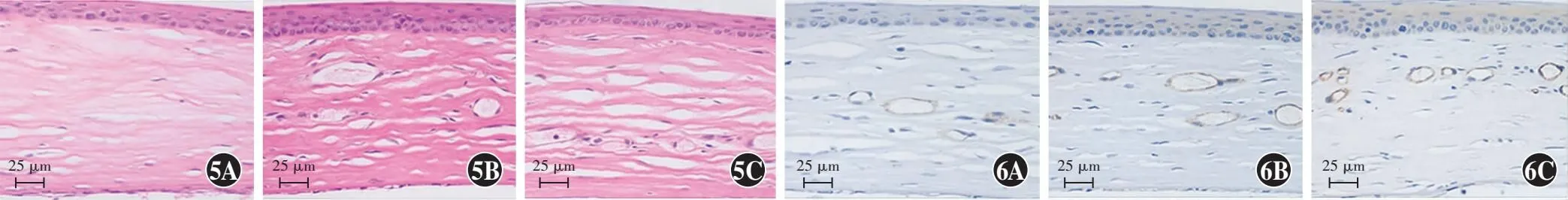
图5 各组大鼠角膜组织形态学特征比较(HE ×200,标尺=25 μm) A:角膜基质纤维趋于正常,少见血管管腔 B:角膜基质纤维紊乱,可见新生血管管腔 C:角膜基质纤维严重紊乱,可见大量新生血管管腔 图6 各组CD31表达情况比较(DAB ×200,标尺=25 μm) A:EXO-KV11组可见少量CD31阳性细胞围成的管腔 B:KV-11组CD31阳性细胞围成的管腔增多 C:生理盐水组可见大量CD31阳性细胞围成的管腔 CD31阳性细胞呈棕褐色Figure 5 Comparison of corneal histomorphologic characteristics of rats among various groups (HE ×200,scale bar=25 μm) A:Corneal stromal fibers seemed normal,and vascular lumen was rare B:Corneal stromal fibers were disturbed,and neovascular lumens were visible C:Corneal stromal fibers were seriously disturbed,and a large number of neovascular lumens were seen Figure 6 Comparison of CD31 expression among different groups (DAB ×200,scale bar=25 μm) A:A few lumens surrounded by CD31-positive cells were seen in the EXO-KV11 group B:More lumens surrounded by CD31-positive cells were seen in the KV-11 group C:A large number of lumens surrounded by CD31-positive cells were seen in the normal saline group Brown color for CD31-positive cells
2.3.4各组CD31表达情况比较 角膜免疫组织化学染色结果显示,碱烧伤后14 d,生理盐水组角膜基质内可见大量CD31染色阳性细胞,细胞围成大小不一的管腔结构;KV11组角膜基质内CD31染色阳性细胞围成的管腔数量较生理盐水组少,EXO-KV11组较KV11组少(图6)。
2.4 各组VDAC1和内质网应激、自噬及凋亡相关蛋白表达量比较
Western blot检测结果显示,EXO-KV11组、KV11组、生理盐水组和正常对照组大鼠角膜组织中VDAC1、PERK、p62、cleaved caspase 3相对表达量总体比较差异均有统计学意义(F=35.960、8.947、17.791、101.168,均P<0.01),其中EXO-KV11组VDAC1、PERK、p62、cleaved caspase 3相对表达量高于KV11组和生理盐水组,差异均有统计学意义(均P<0.001)。各组LC3BⅡ/LC3BⅠ蛋白相对表达量总体比较差异无统计学意义(F=0.445,P=0.727)(表2,图7)。

表2 各组大鼠角膜组织中VDAC1和内质网应激、自噬及凋亡相关蛋白表达量比较()Table 2 Comparison of the expression levels of VDAC1,endoplasmic reticulum stress and apoptosis-associated proteins in rat cornea among various groups ()
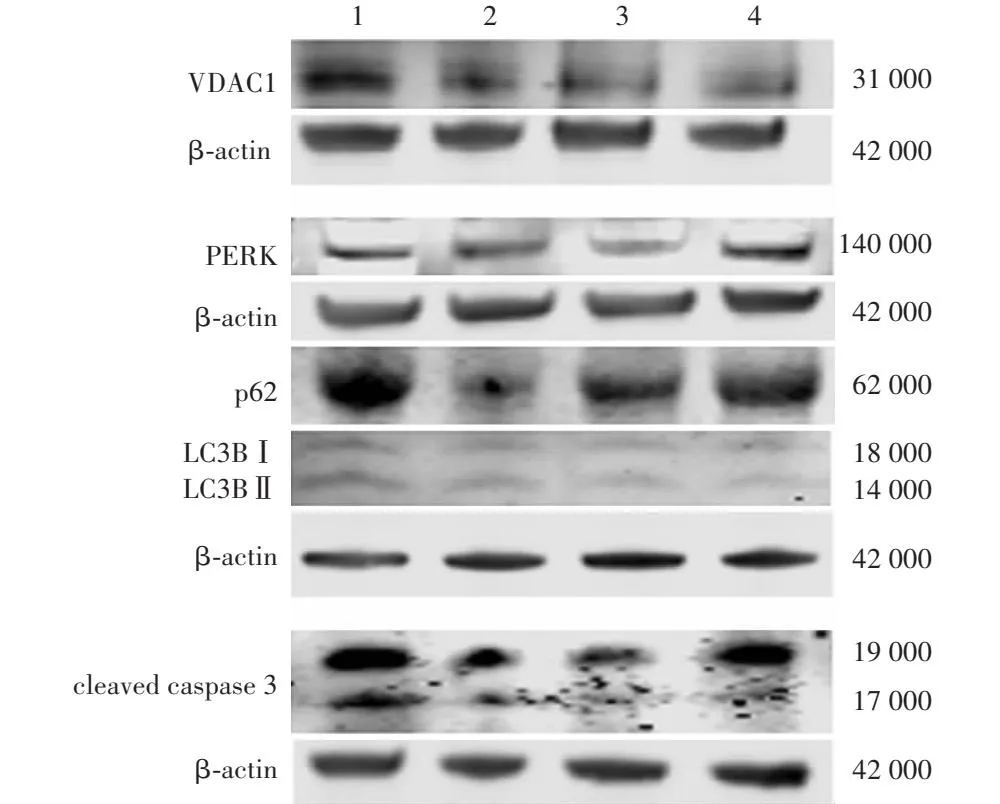
图7 Western blot检测角膜碱烧伤后各组角膜组织中VDAC1、PERK、p62、LC3BⅡ/LC3BⅠ、cleaved caspase 3的表达 1:EXO-KV11组;2:KV11组;3:生理盐水组;4:正常对照组 VDAC1:电压依赖性阴离子通道1;β-actin:β-肌动蛋白;PERK:蛋白质激酶R样内质网激酶;p62/SQSTM1:自噬接头蛋白1;LC3B:自噬微管相关蛋白轻链3B;cleaved caspase 3:活化半胱氨酸蛋白酶3Figure 7 Expressions of VDAC1,PERK,p62,LC3BⅡ/LC3BⅠ,and cleaved caspase 3 in corneal tissue after corneal alkali burn in different groups by Western blot 1:EXO-KV11 group;2:KV11 group;3:normal saline group;4:normal control group VDAC1:voltage-dependent anion channel 1;PERK:protein kinase R-like endoplasmic reticulum kinase;p62/SQSTM1:sequestosome-1;LC3B:microtubule-associated proteins 1A/1B light chain 3B
3 讨论
CNV可造成严重的视力损害,目前临床上已有的CNV治疗方式均存在一定不足[27],仍需进一步研究抗CNV药物。
近年来,大量研究表明EXO作为天然发生的细胞外囊泡可以增加药物递送效率和稳定性[28-29]。有研究发现,CP05可以通过非共价键方式与EXO 4次跨膜蛋白CD63结合,通过多肽与CP05的融合可以使EXO负载多肽[30]。因此,本研究将CP05与KV11体外融合,并与EXO孵育形成EXO-KV11,结果显示当EXO∶KV11=1∶4(6.25 μg/ml∶25 μg/ml)时,结合效率最佳,为87.5%,说明KV11能够通过CP05与EXO高效结合。本研究中裂隙灯显微镜下眼前节照相定量分析结果表明,EXO-KV11能够早于KV11抑制CNV;角膜荧光铺片、CD31免疫组织化学染色和苏木精-伊红染色结果显示,EXO-KV11对CNV的抑制效果优于KV11。
既往研究已证实,线粒体VDAC1是纤溶酶原来源KV的受体,KV通过激活VDAC1诱导血管内皮凋亡[31-32]。VDAC1定位于线粒体外膜,调节线粒体和细胞其他部分的代谢和能量交流,在线粒体介导的凋亡中起重要作用。其中,VDAC1参与内质网-线粒体交流,调节自噬和炎症[33]。目前尚不明确KV11是否是KV结构域与VDAC1作用的有效激活片段。本研究结果显示,EXO-KV11能显著促进VDAC1、内质网跨膜感受器PERK的表达,活化凋亡蛋白caspase 3,表明EXO-KV11在CNV中能够激活VDAC1,促进内质网应激和血管内皮细胞凋亡。
研究发现,自噬在内质网应激激活下起到促生存的作用[34],LC3BⅠ转化为膜结合形式的LC3BⅡ表明自噬流的进行,自噬中晚期标志蛋白p62的表达水平增加表明自噬溶酶体降解过程受阻,自噬流受阻[35]。本研究结果显示,EXO-KV11增加p62表达,而EXO-KV11组LC3BⅡ/LC3BⅠ比值与生理盐水组比较差异无统计学意义,表明EXO-KV11阻滞自噬中晚期降解过程,自噬流受阻。因此,EXO-KV11诱导内质网应激导致错误折叠蛋白的堆积和自噬流消化错误折叠蛋白这一途径的阻滞,导致内皮细胞稳态障碍,从而发生凋亡。值得注意的是,在抑制CNV中,KV11的表现与EXO-KV11截然不同,KV11不能改变VDAC1和PERK表达,表明KV11在CNV中不能激活VDAC1,不能通过PERK激活内质网应激;KV11下调了p62的表达,但KV11组LC3BⅡ/LC3BⅠ的比值与生理盐水组比较差异亦无统计学意义,表明KV11可能是从与EXO-KV11不同的途径改变了自噬流的进程。同时,KV11活化caspase 3,促进了血管内皮细胞的凋亡。
综上所述,本研究结果表明EXO-KV11通过激活VDAC1和阻滞自噬流等相关途径抑制CNV,且EXO-KV11的抑制效果优于单独的KV11短肽。尽管关于EXO-KV11抑制视网膜新生血管的实验已有开展[24],但EXO-KV11对于新生血管的抑制机制仍不明确。鉴于VDAC1是KV的受体且VDAC1在线粒体-内质网交流及线粒体介导的凋亡中起到重要作用,以上结果提示EXO-KV11抑制CNV的作用机制可能与VDAC1的激活相关,内质网应激和自噬也参与其中,这为新生血管性眼病的治疗靶点研究提供了新的思路和实验基础,VDAC1有望成为抑制新生血管的新靶点。本研究仍存在一定局限性,如EXO作为运输药物的载体,进入细胞后的运输是否会影响药物本身的作用途径尚不明确,正如本研究发现EXO-KV11和KV11在内质网应激和自噬方面不同的分子机制,仍需进一步研究。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明陈文倩:设计实验、实施研究、统计分析、起草文章;杜玮:设计实验、对文章知识性内容进行审阅和智力性内容修改;于文贞:直接参与选题、酝酿和设计实验、对文章的知识性内容作批评性审阅及定稿
