进展期年龄相关性黄斑变性成像模式及应用专家共识(2024)
2024-03-15进展期年龄相关性黄斑变性成像模式及应用专家共识2024专家组国际转化医学会眼科专业委员会中国医药教育协会眼科影像与智能医疗分会
《进展期年龄相关性黄斑变性成像模式及应用专家共识(2024)》专家组 国际转化医学会眼科专业委员会 中国医药教育协会眼科影像与智能医疗分会
邵毅,复旦大学附属眼耳鼻喉科医院,上海 200031;迟玮,中山大学中山眼科中心,广州 510060;张少冲,暨南大学附属深圳眼科医院,深圳 518040
1 《进展期年龄相关性黄斑变性成像模式及应用专家共识(2024)》制定背景
年龄相关性黄斑变性(age-related macular degeneration,AMD)是与衰老相关的黄斑区视网膜结构的退行性改变,其主要危害是中心视力进行性丧失。早期AMD对视力影响较小,主要表现为细胞外沉积物蓄积、色素移行进入视网膜、玻璃膜疣增大以及视网膜色素上皮(retinal pigment epithelium,RPE)发生色素减退和色素沉着。进展期AMD是病变的中晚期改变,其临床表现以外层视网膜萎缩和变薄、RPE丢失以及黄斑新生血管(macular neovascularization,MNV)为主[1],包括地图样萎缩和湿性AMD等,严重危害患者的中心视力,表现为中心暗点和/或严重的视物变形,双眼先后发病者会导致患者视觉功能严重受损,使其无法阅读、识别人脸或驾驶汽车。进展期AMD分为新生血管性(湿性)和萎缩性(干性)AMD。临床实践发现,这些病变可以同时存在于同一眼中,分析进展期AMD的具体分类、严重程度和疾病预后是临床诊疗中的关键问题。
目前,检测、量化和监测进展期AMD的眼底成像模式包括彩色眼底照相(color fundus photography,CFP)、眼底自发荧光(fundus autofluorescence,FAF)、眼底近红外反射(near-infrared reflectance,NIR)、眼底光学相干断层扫描成像(optical coherence tomography,OCT)、荧光素眼底血管造影(fundus fluorescein angiography,FFA)和吲哚菁绿血管造影(indocyanine green angiography,ICGA)等。近年来发展的眼底成像模式,如眼底光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)、炫彩眼底成像(multicolor fundus photography,MFP)、广角照相成像(widefield photography,WFP)和多光谱成像(multispectral imaging,MSI)等也广泛用于进展期AMD的成像检查。这些成像模式的优化选择对于进展期AMD的诊断评价、量化分析和治疗监测至关重要,并可能会影响患者的成本-效益评价。
目前,关于上述多个视网膜成像模式在进展期AMD诊疗中的选择和联合应用方法尚未达成共识,进展期AMD的成像面对的主要挑战是成像方案的选择和图像分析算法技术的研究。鉴于此,进展期年龄相关性黄斑变性成像模式及应用专家共识(2024)(简称“共识”)专家组就进展期AMD的各种成像模式进行了系统性分析和讨论,在认真复习国内外大量文献及对大量临床病例进行分析的基础上评估了各种成像模式的优缺点,对进展期AMD诊疗中各种成像模式的选择应用提出推荐意见。
2 《进展期年龄相关性黄斑变性成像模式及应用专家共识(2024)》制定方法
基于目前进展期AMD存在的成像模式问题,中国医药教育协会眼科影像与智能医疗分会组织眼科临床医学专家、眼科临床影像专家于2022年7月成立共识撰写组,于2022年7月6日对全国进展期AMD成像的研究者进行调查,收集并整理相关领域中涉及的进展期AMD的成像问题及相关技术在临床应用中面临的困难。由于进展期AMD的成像模式尚未形成统一的、可遵守的共识,本共识专家组在认真学习国内外进展期AMD的成像模式、研究文献的基础上,召开线下和线上会议,针对收集的进展期AMD的成像方案问题进行充分讨论和论证。由执笔小组成员撰写《共识》初稿,初稿形成后通过电子邮件和微信方式由各位专家独立阅读并提出修改意见,分别提交《共识》撰写组核心成员,修改意见经过整理并通过微信、邮件方式和线上会议进行讨论和归纳。《共识》在修改期间充分接受参与专家的建议和指导,最终达成《共识》终稿,旨在指导进展期AMD成像模式的临床应用。本共识制定过程历时1年余。
3 进展期AMD的成像模式及应用建议
3.1 CFP在进展期AMD诊疗中的作用和应用
CFP作为记录眼底异常的传统方法,是在许多新型成像技术出现之前用于临床研究的基础手段[2-3]。CFP可获取视网膜的大体图像,根据不同的机器和成像方式输出不同视场角度的成像,可早期发现进展期AMD患者大范围视网膜病变的表现,如出血、积液、渗出、萎缩和纤维化等。CFP检查在AMD患者的管理中具有操作简单的优势。此外,CFP数码图像提供后处理分析的可能性,为量化分析进展期AMD相关特征的算法提供了良好的数据资料。CFP的广泛应用和图像积累都将成为AMD早期发现、治疗监测和人工智能研究的重要基础。
未来研究中继续使用CFP对于建立新旧模式搜集临床数据的可比性十分必要。通过CFP可以检测、量化和监测与AMD相关的多种表型改变,包括玻璃膜疣、视网膜结晶沉积、色素改变、脂质析出、萎缩和纤维化,以及新生血管性病变,如出血、积液和渗出(图1,2)。然而,与其他成像方式相比,CFP的对比度较低,在识别或量化分析萎缩性病变与其他AMD相关病变方面具有一定的难度。
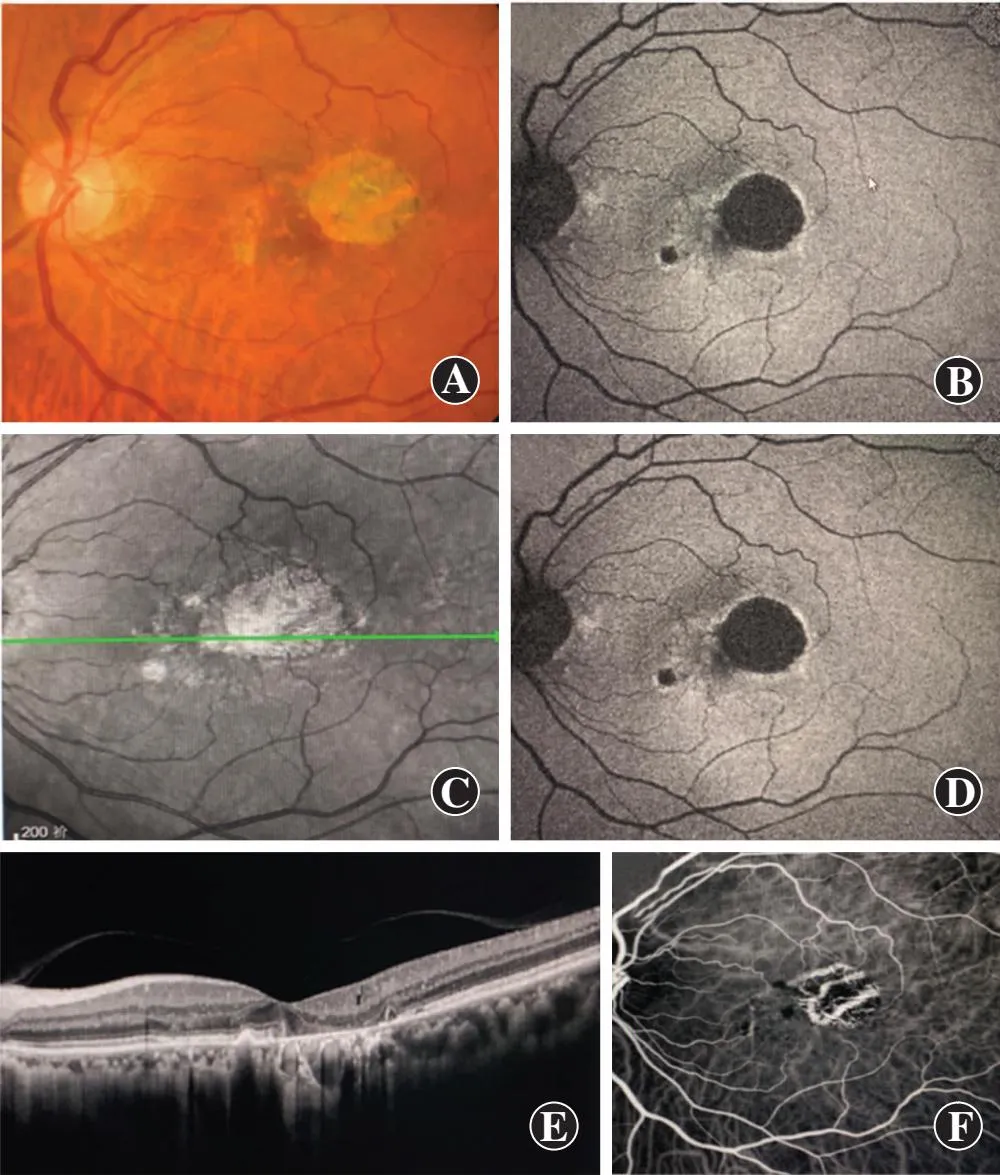
图1 1例65岁左眼GA患者多模态成像 黄斑中心凹结构尚可,无NV A:CFP B:FAF C:NIR D:绿光FAF E:同区域SD-OCT视网膜横截面影像 F:ICGA
基于国内外文献及临床实践,本专家组认为,CFP难以精确划定病变边界(尤其在较小和多灶病变时),导致其在量化地图状萎缩(geographic atrophy,GA)区域方面也受到限制,但对于出血和局部色素改变的进展期AMD相关表型变化,CFP仍然是首选的成像手段。
3.2 FAF在进展期AMD诊疗中的作用和应用
FAF能够显示RPE层脂褐素的含量与分布,主要反映RPE细胞的功能及代谢情况。观察眼底疾病不同时期FAF的分布情况及其强度变化有助于病变的早期诊断、动态疗效监测及疾病预后评价。FAF对进展期AMD视网膜萎缩区域的信息检测、量化评价和监测管理具有重要价值。在萎缩区域内,RPE和脂褐素(含有引发FAF的主要荧光载体)丢失,使萎缩部位的FAF信号强度明显降低(图1)。FAF信号强度的降低与视网膜敏感度下降甚至丧失有关[4-5],提示病变区域结构-功能的异常。目前,FAF已用于多项关于进展期AMD患者GA相关的临床试验。值得注意的是,在新生血管性AMD患者中,FAF降低和视野暗点之间的相关性并不确切,但是此类患者接受抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物治疗后黄斑区的FAF融合暗区与视力、对比敏感度和阅读速率降低高度相关[6-7]。
基于上述研究结果及临床实践,本专家组推荐FAF用于与萎缩性AMD相关眼底病变的鉴别诊断,并可根据GA病变进展情况进行分级。
陶 勇 首都医科大学附属北京朝阳医院
FAF对识别进展期AMD成像固然重要,但也存在挑战。一方面,当GA的边界靠近或累及中心凹时,识别GA边界的难度增加[9]。另一方面,在GA和MNV共存的情况下,仅使用FAF很难区分萎缩和纤维化病变区域,出血或硬性渗出灶可进一步导致FAF信号减弱。需要注意的是,某些萎缩区域内残留的RPE细胞节段或基底物质沉积可被488 nm波长的光所激发而产生FAF信号,通常需要结合多种成像模式来区分萎缩、纤维化、出血或硬性渗出等表现[10]。FAF和NIR以及FFA的联合分析有助于实现对GA的精确识别和评估[11]。
如图1所示,与CFP相比,FAF影像在GA和非萎缩区的视网膜之间对比度更强,但靠近黄斑中心凹的萎缩灶边界被黄斑区色素遮盖,故影像模糊。NIR结合FAF可以精确划分黄斑中心凹区域萎缩病灶的边界。绿光激发的FAF受黄斑色素的影响较小,可清晰显示靠近黄斑中心凹的萎缩灶边界。SD-OCT可显示视网膜的横截面形态,可以观察到高反射信号的玻璃膜疣和GA。
3.2.2定量FAF 传统的FAF方法难以对FAF强度进行量化,近年来,为了解决这一难题,研究者们研发了新的定量眼底自发荧光(quantitative fundus autofluorescence,qAF)方法。qAF结合荧光内参通过计算可变激光功率和探测器灵敏度,从而实现对FAF的定量评估。持续获得高质量、可靠的眼底荧光图片是量化分析FAF的前提,这就要求拍摄时注重以下操作细节:均衡的照明、良好的对焦、相机与视轴对齐以及避免虹膜遮挡等。此外,屈光介质对FAF激发光的吸收会减弱源自视网膜和RPE的FAF强度,因此晶状体和玻璃体混浊可能会影响测量结果。黄斑中心凹周围的qAF强度与黄斑色素量呈负相关。规范化研究表明,qAF水平随着年龄的增长而显著增加,女性的qAF值偏高,并且可能存在种族差异。目前,qAF技术也用于遗传性视网膜疾病的鉴别诊断[12-14]。此外,对qAF在AMD诊疗中的临床应用也进行了一些研究,如对萎缩区外和萎缩区内的qAF信号强度进行定量分析,亦有研究发现在某些GA亚型的经典图像中观察到FAF呈灰白色而非黑色表现。另有研究提出,qAF与评价视觉功能的检测结果,如视觉电生理学和微视野检查相关。
本专家组认为,目前尚缺乏qAF用于诊断进展期AMD的循证证据,更严谨的结论仍有待大规模的纵向研究加以验证。
3.3 NIR在进展期AMD诊疗中的作用和应用
NIR-SLO成像采用750~840 nm的可见光谱光源进行成像,该波长可将受检者的不适感降至最低。NIR图像不受屈光介质混浊和黄斑区色素干扰及吸收的影响。黄斑区色素在成像过程中对比度高,故NIR与蓝光FAF成像相比,对涉及黄斑中心凹区域的萎缩更容易分辨(图1)[11]。NIR成像最初为指导OCT采集的工具,后来发展成为一种独立输出的成像技术。近年来,NIR图像已演化成大多数OCT/SLO设备中独立输出的图像而广泛用于眼科临床。NIR图像为FAF提供了有价值的补充信息,可一并纳入进展期AMD的成像方案中。现有证据表明,NIR图像对网状假性玻璃膜疣检测的灵敏度较高。基于上述研究结果,本专家组讨论认为,目前还缺乏单独使用NIR检测萎缩性AMD的系统研究,其敏感性和特异性有待验证,但有条件的医疗机构可将NIR用于进展期AMD诊疗的医疗实践中,作为该疾病诊断和治疗监测中的观察指标,并进一步验证该技术在临床中的应用价值。
基于上述研究结果,也鉴于FAF的特性及其在诸多临床研究中的验证,本专家组建议,FAF图像应被纳入非新生血管性及新生血管性AMD的成像方案,以便对进展期AMD患眼视网膜萎缩病变的发生和进展进行动态监测。
3.4 OCT在进展期AMD诊疗中的作用和应用
OCT是一种非接触、无创、高分辨率的眼底检查技术。与目前临床常规的其他眼底成像方式相比,谱域OCT(spectral domain OCT,SD-OCT)实现了活体观察视网膜和RPE横截面及各层平面的可视化[15]。扫频源OCT(swept-source OCT,SS-OCT)设备光源的波长更长,在轴向上有更好的组织穿透性,通过增强深度成像采集技术,可以捕捉脉络膜组织结构的细节[16]。同时,SS-OCT具有更高的扫描频率和更宽的扫描区域,采集时间缩短。该设备配备眼球追踪功能,有利于注视功能较差眼的图像采集。此外,某些设备已实现解剖跟踪定位功能,支持与基线图像对照随访。OCT设备可以快速获得单线扫描(B-scan)以及密集多线扫描模式合成的“体积扫描”(C-scan),后者可以用来提取黄斑平面en face图像(图2)。然而,扫描间隔越密集,采集时间越长。因此,临床工作中通常需要根据特定的研究问题设定扫描模式。SD-OCT的C扫描功能可对特定的视网膜层面进行直接观察,为CNV活动的早期诊断提供了新的方法,有利于早期确定湿性AMD的复发,及早进行干预治疗。研究表明,SD-OCT扫描可发现RPE/Bruch膜复合体断裂、外层视网膜管样结构的存在、外周视网膜解剖破坏和局部SD-OCT信号强度降低等改变,能够预测AMD萎缩进展、识别前期病变[17]。OCT检查不仅有助于AMD的病情分期,而且也可以在一定程度上反映疾病的预后[18-21]。OCT检查发现椭圆体带和外界膜信号不连续,尤其是出现较强反光带时,或者出现视网膜内套管样结构时提示患者的视力预后不佳[22]。视网膜水肿时,若OCT显示病变区域呈现高密度影,则说明病灶以纤维组织为主,抗VEGF类药物对其疗效欠佳[23]。同时,脉络膜厚度也可以反映治疗的效果,厚度越厚,疗效越佳[24]。

图2 1例57岁女性右眼新生血管性AMD黄斑区萎缩患者的多模态成像 已接受抗VEGF药物玻璃体注射 A:CFP B:FAF C:MFD D-F:FFA G-I:ICGA J-K:SD-OCT L:OCTA显示成熟血管
结构性OCT的en face模式可以提供一种新的模式来分析和定量萎缩区域(图2)。与SLO成像相比,SD-OCT设备虽然提供纵切面编码图像,但横向解剖分辨率较低(当前共聚焦SLO为5 mm,SD-OCT设备为15 mm)。为了准确地对SD-OCT体积扫描数据集进行分级,需要对体积扫描中的所有单独线扫描或不同的en face平面扫描进行评估,由于AMD不同的病理变化可能导致OCT局部反射条带扭曲,因而可能需要复杂软件来自动分割图像解决这一问题。虽然研究者在这一领域已经取得了实质性进展,但AMD病理变化导致的自动分割错误仍可能使人工调整更加耗时。
白雪皑皑,冬月盈盈,黄粱有梦,万花有因。这十六字真言并非虚谈,说的就是冬至日午夜的星象,合乎王积薪所记媪妇谱,世外的旅客,可据此找到往万花谷的道路。少年们随两位老人往天上看,各自手攀棋盘与树枝,仰着头,一时也看得心神俱醉。
二是有机物排放造成的水资源污染。外源性污染中存在的有机物主要有植物性营养元素氮、磷以及好氧有机物等,这些有机物含有大量的碳水化合物、蛋白质、油脂、磷和氮。将含有这些成分的有机物排放到水资源中,会使水中存在的微生物发生降解反应,进而降低水中氧气含量,严重时还会出现水体富营养化现象,这不仅破坏了水产生物的生长环境,还会造成大量生物因缺氧而死亡。
体积扫描(SD-OCT或SS-OCT)应覆盖至少6 mm×6 mm的区域(应根据GA的预期大小进行更大范围或重叠扫描),在非新生血管性和新生血管性AMD临床试验中,单线扫描之间的距离应≤120 μm,可以通过平均多次线性扫描以降低噪声干扰,根据研究目的改变扫描密度和多次扫描的平均值。
进一步,通过对2017年不同读者实际参与采访工作的程度进行初步分析,得到如图1所示的结果。由图可知,研究生读者对采访工作的参与程度与借阅需求极度不对称(荐购书目册次与借阅册次比值小于0.05);由于我馆采访模式的设置,教职工对采访工作的参与程度较高;本专科生与全英语实验班的参与程度处于较低水平。
目前各种SD-OCT设备在临床上广泛应用,然而,有关数据兼容性(例如医学数字成像和通信)和采集设置的行业标准尚未得到制造商的统一认可,这也影响了不同设备检查结果之间的可比性,导致成像数据库的碎片化,并限制了不同设备的数据整合的可能性。
本专家组建议,OCT技术已被广泛用于评估和量化AMD萎缩灶,是对AMD中新生血管进行分级和监测的重要工具,在诸多大规模AMD临床试验中发挥着不可或缺的作用。但值得注意的是,OCT扫描的间隔必须足够小,以便不遗漏有意义的病理特征,如玻璃膜疣、网状假性玻璃膜疣(图1)和色素迁移。
3.5 眼底血管造影和血管成像技术在进展期AMD诊疗中的作用和应用
眼底血管造影检查是一类常用的眼底检查技术,包括FFA和ICGA,二者对进展期AMD血管性和色素性的病理改变有高效的识别能力,同时在进展期AMD的诊断中也有重要的意义。
3.5.1FFA FFA已成为检测和分级MNV的标准,其对AMD确切的病变划分可能因染料渗漏而边界模糊。闪光照相眼底成像和SLO已广泛用于非新生血管性和新生血管性AMD的大规模临床试验中[25-26],并能针对图像中的病变区域进行准确的量化评估[27-29]。SD-OCT可作为FFA的补充手段用于追踪新生血管随时间变化的活动度。但FFA是一种耗时、有创的侵入性检测方法,荧光素的体内注射和强发射光的应用可能会使患者感到不适或增加变态反应的风险[8]。
基于上述临床研究和实践,本专家组建议,FFA作为检测和分级MNV的标准,推荐使用FFA诊断湿性AMD。在非新生血管性AMD临床试验中,应在基线检查时将FFA纳入研究方案,以排除并发性MNV的存在。在新生血管性FFA成像检查时应覆盖黄斑中心凹区域,影像也应包含造影后期10 min阶段。AMD基线试验中,建议在基线检查、定期随访(大约每6个月1次)和研究结束时进行FFA检查。
3.5.2ICGA ICGA提供了关于脉络膜血管和血流的更多信息[30]。与荧光素钠相比,吲哚菁绿与血浆蛋白结合的亲和力更强,因与脉络膜毛细血管的微小渗漏相关,可以更详细地显示脉络膜血管病变(图2)[31]。ICGA有助于视网膜脉络膜吻合处和息肉状脉络膜血管病变的诊断[32-33]。
为了保证旅游数据的准确性和科学性,文中所涉及的旅游经济统计数据均来自2011年、2014年和2017年《河南省统计年鉴》及相关年份的河南省各市国民经济和社会发展统计公报。其中,城市旅游经济收入是指旅游经济总收入,包括国内旅游收入和入境旅游收入两部分,为保证单位统一,本文将入境旅游收入按照当年汇率由美元转化成人民币单位。公路里程数据来源于河南省主要城市间公路里程表。
本专家组建议,ICGA成像有助于研究进展期AMD的病理过程及对萎缩性和新生血管性等进展期AMD的鉴别诊断[34-36]。然而,ICGA是一种侵入性有创方法,且ICGA后期图像的采集程序耗时,对于进展期AMD可优先采用其他非侵入性方法进行鉴别诊断,只有在研究者认为有必要时,才将ICGA纳入新生血管性AMD基线临床试验方案中。在萎缩性AMD中,如果对萎缩的原因仍存在疑问需要进行鉴别诊断,可选择ICGA成像,如Stargardt病中可见“萎缩暗区”,即萎缩区下方没有发现染料蓄积,但在进展期AMD中则出现进展期着染[34]。
3.5.3OCTA OCTA是基于运动对比度进行血流检测的方法,运动对比度可以从随时间变化的相位/多普勒频移或由于血细胞运动导致的体素内信号振幅得出[37-41]。与传统的眼底血管造影相比,OCTA的优势是深度分辨率和无创性[42]。研究已经证实,OCTA可用于AMD中新生血管的细节表征检测(图2)[43-46],分辨非渗出性1型新生血管[47-48]。OCTA还可以对进展期AMD萎缩灶内部和边缘的脉络膜不同层次损害进行分析[49]。凭借其能够显示脉络膜和脉络膜毛细血管细微结构的优势,OCTA常用于代替ICGA以区分不同类型的黄斑区萎缩灶[50]。OCTA是基于眼底血管中存在流动的血细胞、对同一横断面多次成像计算出血流信号并重建出眼底血管的影像,无法像FFA检查一样提供有无渗漏的血管壁完整性信息,但在OCTA中仍然保留着结构信息,并可以通过反映的液体聚集状态提示是否发生渗漏。此外,相应的OCT结构en face图像可能有助于揭示共存的异常血管结构[48]。
OCTA的临床价值和最佳应用模式仍在开发中,已被广泛用于非新生血管和新生血管AMD的研究,其应用前景极具潜力。我们建议有条件的医疗机构在医疗实践中可跟踪相关技术研究的发展和方法,应用该技术对进展期AMD进行检测,为了获得有价值的OCTA数据集,需要获得密集的、高质量的SD-OCT或SS-OCT扫描图像。传统的OCT设备进行OCTA检测常受采集时间和采集场地的限制,而使用SS-OCTA仪器可以使采集时间更快、视场更宽、脉络膜成像更深。该技术虽然受到眼球运动和视网膜血管投影的限制,但随着技术研发的进步,这些限制可以在未来得到解决。
3.6 MFP在进展期AMD诊疗中的作用和应用
MFP是由3种不同波长的共焦扫描激光器同时拍摄视网膜后合成伪彩色复合图像的成像技术[51]。3种不同波长的激光分别为蓝光(488 nm)、绿光(515 nm)和近红外光(820 nm)。不同波长的光对视网膜组织的穿透深度不同,以揭示不同深度的视网膜细节信息。蓝激光反射图像主要显示内层视网膜和玻璃体视网膜界面,绿激光反射图像主要显示视网膜血管、出血和渗出,NIR激光反射图像主要显示外层视网膜和脉络膜结构,3种图像色彩的信息整合形成MFP图像。与CFP相比,MFP图像是由来自不同波长的信息组成的复合“伪彩”图像,而不是由来自可见光光谱信息组成的图像。对于进展期AMD中的GA,MFP可清晰显示萎缩区域(图2)[52-53],并可弥补其他AMD成像模式的局限性,显示萎缩性和新生血管性进展期AMD的影像特点。由于MFP的激光反射特性,该技术可观察到视网膜出血和纤维化等表现,但仅通过MFP可能无法区分细微出血和色素性病变(图2)。另外2种波长(蓝色和绿色)是否会增加或掩盖NIR图像信息尚有待研究,这也可能提示在某些条件下单个波长分量图像可能比复合材料具有可视化优势。由于使用高强度广谱激光,可以在非扩瞳状态下通过扫描获取MFP图像。然而,非扩瞳状态获取的图像信号质量,尤其是蓝色激发光的反射图像,可能会受屈光介质混浊和小瞳孔的影响。
本专家组认为,由于目前成像技术的局限性,MFD可作为观察萎缩性和新生血管性AMD临床研究的一种选择,但其具体实用性仍有待证实,目前仍不是进展期AMD诊疗必须采用的技术。
3.7 WFP在进展期AMD诊疗中的应用
与传统眼底照相成像模式相比,WFP可显示更大范围的视网膜情况,视场延伸到100°以上。目前常用的WFP成像设备有Optos设备(英国Optos公司)和Zeiss Clarus 500 (德国Carl Zeiss Meditec公司)。SLO技术推动了WFP成像仪的临床应用,该技术适用于FAF、FFA和ICGA等成像采集。WFP的原理是通过2个或多个离散激光光源进行照明而获得彩色图像,根据光源的配准,提供可能具有人眼外观异常颜色区域的伪彩图像。Optos设备系统配备了一个内部椭球镜头,可以实现高达200°的视野,覆盖眼底范围的80%。然而,椭球镜头的使用会在采集的图像外围产生畸变,此外,上方及下方成像视野可能受到眼睑和睫毛的遮挡。更大的视场是以牺牲空间分辨率和对比度为代价的,为了避免这一缺陷,Carl Zeiss Meditec研制出一种具有广角采集功能的彩色眼底相机,其优势是提供眼底的真彩色图像,一张图像的视野为133°,通过6张照片拼图可达267°。以往的研究表明,WFP的黄斑区域特征分级可与传统CFP结果相似[54]。WFP的优势是可以观察并监测与AMD相关的外周异常病变[55],这些异常在70%的AMD患者中都有发现,包括周边视网膜玻璃膜疣、RPE脱色素、外周网状色素变性和/或萎缩斑。
本专家组认为,WFP可能使研究者对AMD眼底病变有更全面的了解,在非新生血管性和新生血管性AMD的临床试验中有探索性应用价值。
3.8 MSI在进展期AMD诊疗中的应用
MSI基于不同波长光线在眼底组织结构之间的穿透力不同、眼内不同结构对光线的吸收光和反射光差异的原理,通过用多个单色LED光源分别拍摄不同深度的眼底结构,并对眼底不同层次组织的单色光谱反射图像进行采集后合成单色光灰度图像。该成像方法根据其吸收光谱实现了从视网膜内界膜到脉络膜结构不同层次的可视化[56-58],吸收光谱较强的结构显得较暗,而吸收光谱较弱的结构则显得较亮。图像处理可以进一步突出视网膜结构吸收光谱之间的差异。不同部位的眼底组织色素分布数量以及色素的光属性决定了眼底各组织结构的成像特点,多光谱成像可被血红蛋白、黑色素和黄斑色素选择性吸收[56,59],如波长在600 nm以上的光谱用于显示RPE黑色素,而稍长的波长用于显示脂褐素。光谱形成的灰度图反映不同空间位置的色素物质光谱特性和光学特征。MSI的相对局限性是LED系统光谱照相系统易受到晶状体散射的影响,需要相对透明的屈光介质,对于角膜混浊、白内障以及瞳孔过小者会影响图像质量,人工晶状体容易形成伪影[60]。
MSI基于差分光吸收来评估视网膜和脉络膜的透射功能,上述因素的任何形态或功能变化都可能影响差分光吸收以及眼底的透射功能。有研究发现,新生血管性AMD患者的差分光吸收水平低于早期AMD患者,降低了AMD病变中视网膜血管的组织氧饱和度,这是影响差分光吸收的一个重要因素[61-62]。MSI作为一项视网膜脉络膜en face无创成像技术,相比于CDP或SLO可以获得更多的视网膜信息,同时可实现无损伤下观察脉络膜的形态改变,目前已用于多种疾病的辅助诊断。短波长可见光图像提供视网膜组织结构信息,用于观察黄斑水肿、视网膜前膜、视网膜神经纤维层改变以及浅层出血、硬性渗出、棉絮斑等病灶;超过600 nm的中波长光谱以及红外波长光谱增强了RPE-脉络膜毛细血管层复合体结构显示强度;800 nm以上的长波长光谱可实现脉络膜血管层面的图像显影,可有效观察RPE色素紊乱、RPE萎缩性改变以及脉络膜各项相关病理改变[60,63-64]。
MSI在识别RPE形态改变,观察RPE黑色素变化等方面要优于传统CFP,更容易显示干性AMD、GA和新生血管性AMD中存在的RPE黑色素的破坏,尤其是色素的聚集。无创下直接观察RPE中黑色素的变化,有助于临床医生预测视网膜的病理发展方向,对检测、量化和监测AMD的进展提供指导,规避危险因素并提供治疗策略。相关文献指出,RPE黑色素破坏结合玻璃膜疣的出现意味着5年内发展成为新生血管性AMD的风险将增加5倍[64-65]。
总的来说,MSI技术通过对RPE黑色素的无创检查,是监测进展期AMD进展的有效工具,但目前临床上应用较少。专家组认为有条件的医疗机构应关注该技术在进展期AMD诊疗中的应用价值,对了解疾病的病理机制有重要作用。
眼科影像技术的进展增强了我们全面评估进展期AMD的能力。进展期AMD包括GA和湿性AMD等,严重危害患者视力。目前,检测、量化和监测进展期AMD的基本眼底成像模式包括CFP、FAF、NIR、OCT、FFA和ICGA等,当前先进的眼底成像模式也广泛用于进展期AMD,包括OCTA、MFP、WFP以及MSI等,在疾病的诊断、治疗监测管理、预后预测、发病机制研究等方面发挥着重要作用,进展期AMD成像模式的优化选择对于防治进展期AMD的研究至关重要,并可能会影响相关临床诊疗的时效和成本。
研究了一种基于固定式相机对动态目标的三维重建,使用了动态目标提取和目标跟踪算法[3]提取目标图像区域,并采用GMS特征匹配算法[4]进行图像特征匹配,将传统的三维重建拓展应用到更多的摄像情形,无需如Kinect等专业立体视觉成像设备,使用固定式的摄像设备就能对动态目标物体进行三维重构.对固定式图像采集设备采集到的图像信息增强可视化的同时,也为动态目标重建提供一种新的解决方法。
本共识专家组对进展期AMD的各种成像模式进行了系统性讨论,基于不同检测方法的原理及临床实践,评估了各种成像模式的优缺点,并对每种成像模式在进展期AMD未来研究中的作用进行了系统总结。眼底成像技术一直在朝着更大的视野范围、更多的解剖层次方向不断实现新的突破和发展,这些最新的眼底成像技术未来会给进展期AMD带来更详尽的成像模式。眼底影像技术一方面有助于眼底疾病的诊断,另一方面在探索疾病本质的过程中可对疾病的病理机制提供全新认识。然而,面对如此多的眼底影像学检查方法,眼科医生有责任合理选择敏感性、特异性高的检查方法,避免医疗资源浪费,并尽可能降低患者的医疗负担。同时我们也要注意单一模式成像往往不能获得进展期AMD最佳成像结果,多模式成像是目前检测、量化和监测进展期AMD的最优方法。
本专家组根据目前国际最新临床指南(专家共识)和诊断标准,在充分评估了各种成像模式的优缺点后得出以下推荐意见:初次就诊怀疑AMD患者,推荐使用CFP、OCT和OCTA进行疾病的筛查,其中如需对新生血管性AMD进行确诊则推荐采用OCTA+FFA+ICGA检查方法的组合,在进展期AMD治疗随访过程中推荐采用OCTA成像方法,完成规范疗程后患者的复查推荐采用FFA+ICGA的结合,GA病灶推荐采用CFP+FAF+OCTA影像检查的组合。
形成共识意见的专家组成员:
执笔组专家
眼科影像专家
邵 毅 复旦大学附属眼耳鼻喉科医院
迟 玮 中山大学中山眼科中心
杨卫华 深圳市眼科医院 深圳市眼病防治研究所
(4)通过对过程数据及结果的分析,发现该地下水源热泵系统在节能上和实际使用中存在着节能效果不足,故需要通过进一步的研究使节能效果有所改善。
黄锦海 复旦大学附属眼耳鼻喉科医院
刘祖国 厦门大学眼科研究所
直接征收行为因直接干涉了投资者的财产所有权,因而对直接征收的认定标准较为明确;而以间接方式影响投资者财产权的间接征收行为具有隐蔽性,认定间接征收较为困难,由此亦引起了较多的案件纠纷。
3.2.1基于闪光眼底照相机和扫描激光检眼镜的FAF 目前有2种类型的FAF成像系统,即闪光眼底照相机成像系统和扫描激光检眼镜(scanning laser ophthalmoscopy,SLO)成像系统。基于SLO的系统具有较高的图像对比度、分辨率和成像质量,可避免眼前节结构,如晶状体对FAF成像的干扰,但该系统不能集成到传统的眼底照相机中,因此需要配备额外的FAF采集设备[8]。鉴于SLO-FAF成像效果更佳,因而其在大多数临床研究中被用作采集FAF图像的首选方法。SLO-FAF成像最初由引入的蓝光激发,信号质量受晶状体核性混浊、玻璃体混浊和瞳孔散大等多种因素影响,且蓝色激发光可能会给患者带来不适感。此外,黄斑色素对蓝光的阻断会减弱黄斑中心凹处的FAF信号强度。蓝光激发FAF存在技术上的限制,尚无法用于临床实践。相比之下,绿色光源的波长(532 nm)长于蓝光,不易受屈光介质混浊和黄斑色素的影响,因而用于共聚焦SLO器件集成中,但相关验证性研究仍较少。因此,基于眼底照相机的FAF是基于绿色光~橙色光范围(510~610 nm)。
陈 蔚 温州医科大学附属眼视光医院
蜜蜂是对人类有益的昆虫类群之一,为农作物、果树、蔬菜等各种农作物传粉增产。人类食物的三分之一直接或间接地依靠昆虫授粉,而这三分之一中的80%是由蜜蜂完成授粉任务。蜜蜂是各种作物的最理想授粉昆虫,被誉为“农业之翼”。与会专家和嘉宾一致认为,与人工授粉相比,蜜蜂授粉往往产量更高,质量更好,还能促进农药减量。推广蜜蜂授粉是农作物增产提质和助力农业绿色发展的重要手段,要加大宣传力度,倡导保护和科学利用蜜蜂,推广蜜蜂授粉及配套技术,推动绿色农业发展,实现生态与市场价值共赢。
孙悟空虽没练习过画圈,但却无师自通,用金箍棒在地上画个圈,不仅又圆又大,金光闪闪,而且还能保护圈里的师傅不受妖怪侵害,这猴子果然了得。可惜那唐僧耳朵根子软,不辨真假,听了妖精几句好话,就忘了悟空叮嘱,刚一出圈,便成了妖精的战利品。
娄 岩 中国医科大学
语文学习,学生不仅要从课堂内获取知识,还要把课堂外的时间充分利用起来。教师还要指导孩子有目的地读书,使他们在“课外”的大海洋中汲取能量。作为小学生,在起始阅读阶段该读哪些书虽然没有明确的规定,但教师可以根据学生的认知特点给他们推荐适合他们年龄特征和认知水平的书籍,甚至给不同兴趣爱好的孩子推荐不同类型、不同书目的书,指导阅读,并提出阅读的相关要求,如指导制作《读书卡》、开展读书会等。以丰富的书籍内容作为阅读的载体,扩大阅读面,拓展视野,提高阅读能力。
胡 亮 温州医科大学附属眼视光医院
李世迎 厦门大学附属翔安医院
张 慧 昆明医科大学第一附属医院
谈到研究会的发展离不开航天710所(以下简称710所),因为710所是研究会的发起者、建设者和研究会重要研究活动组织者、参与者及资源的提供者,研究会是710所面向社会经济领域重要窗口和科研平台,710所是研究会依托单位。
陆成伟 吉林大学第一医院
苏兆安 浙江大学医学院附属第二医院
康刚劲 西南医科大学附属医院
黄晓丹 浙江大学医学院附属第二医院
刘 昳 南京中医药大学附属南京市中医院
计 丹 中南大学湘雅医院
接 英 首都医科大学附属北京同仁医院
邓志宏 中南大学湘雅三医院
田 磊 首都医科大学附属北京同仁医院
从一个名不见经传的印后加工设备制造企业成长为国内印刷
