重组大肠杆菌全细胞催化法生产N-乙酰神经氨酸
2024-03-15杨海泉夏媛媛陈献忠
郑 蝶, 杨海泉, 夏媛媛, 沈 微, 陈献忠*
(1. 江南大学工业生物技术教育部重点实验室,江苏 无锡 214122;2. 江南大学生物工程学院,江苏 无锡 214122)
唾液酸是一系列9-碳单糖及其衍生物的统称,最初从牛下颌唾液腺黏蛋白中分离得到[1]。 N- 乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac)是唾液酸的主要种类之一,主要以低聚糖、糖脂或者糖蛋白的形式存在[2-5]。 Neu5Ac 参与细胞识别、信号转导、肿瘤发生等多个生理过程[6-8],Neu5Ac 还可以作为合成抗流感病毒药物的前体[9-11],由于其具有重要的生物学功能,Neu5Ac 在医药和生物技术产业上的需求不断增加[12]。
Neu5Ac 可以通过天然产物中提取、化学合成、微生物发酵、 酶法合成和全细胞生物催化来制备。Neu5Ac 传统的生产方法主要从天然原料中获得,如燕窝、牛奶或鸡蛋等[13],由于这些天然产物中唾液酸含量低,不适合进行大规模生产。 化学合成法反应条件苛刻,后期的分离纯化复杂,无法满足工业化生产的要求[14]。 利用发酵法生产Neu5Ac 成本较低,但产量不高,而且副产物较多,还未见有工业化生产报道[15]。 酶法生产Neu5Ac 具有转化率高、反应时间短的优点,但由于酶法合成还需要进行细胞破碎和酶的纯化等操作,且N-乙酰葡萄糖胺-2-差向异构酶需要ATP 作为活化剂,从而限制了生产规模的扩大[16-20]。 全细胞催化法是利用完整的细胞作为催化剂将底物转化成产物,本质上也是利用生物体内酶的催化作用[21]。全细胞催化法因其操作简便、经济高效、产物易分离提纯等优点,是一种较好的生产Neu5Ac 的方法[22]。
2011 年,Tao 等采用一锅法将AGE 和NanA 两种酶在大肠杆菌内共表达, 以GlcNAc 和丙酮酸为底物催化合成Neu5Ac,不仅提高了生产效率,简化了工艺流程,还具有一定的经济优势[23]。2013 年,Lin等构建了共表达基因AGE和NanA的重组大肠杆菌E. coli△nanTEK/pNA, 催化N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc) 和丙酮酸合成240 mmol/L 的Neu5Ac[24]。 许杨等对工程菌E. coli△nanTEK/pNA 的细胞培养条件以及催化过程进行优化,以600 mmol/L GlcNAc 和800 mmol/L 丙酮酸作为底物, 在30 ℃下转化16 h 得到294.4 mmol/L Neu5Ac,GlcNAc 转化率可以达到49.1%[25]。 Chen 等利用基因工程技术平衡了AGE 和NanA 两种酶的表达, 然后通过代谢工程改造底物和产物运输途径,进一步利用生物信息学方法和蛋白质工程分别提高了两种酶的活性,最终利用构建的新型生物催化剂得到351.8 mmol/L 的Neu5Ac,GlcNAc 转化率高达58.6%[26]。 2019 年,Zhao 等在枯草芽孢杆菌(Bacillus subtilis)中共表达基因AGE和NanA,通过启动子优化、关键酶筛选、N 端编码序列工程促进关键酶表达和阻断副产物途径,开发了一种有效的食品级Neu5Ac 生产方法,Neu5Ac 的产量达到68.75 g/L,GlcNAc 转化率为55.57%[27]。
目前全细胞催化法生产Neu5Ac 均以纯度较高的GlcNAc 为底物,考虑到Neu5Ac 的生产成本和市场竞争性,不利于规模化生产。 作者探索了通过发酵法生产GlcNAc 和生物催化法生产Neu5Ac 工艺偶联的可行性。利用实验室前期构建的高产GlcNAc重组菌和全细胞催化剂E. coli△NTE/pET28a-(T7-shnal)-(tac-slr)进行工艺组合催化生产Neu5Ac,并进一步优化催化条件,建立分离纯化工艺,获得高纯度的Neu5Ac,为Neu5Ac 工业化生物催化生产提供依据。
1 材料与方法
1.1 材料与试剂
高产GlcNAc 的重组大肠杆菌ATLWX、重组E.coli△NTE/pET28a-(T7-shnal)-(tac-slr):作者所在实验室构建并保存;丙酮酸:上海麦克林生化科技有限公司;Neu5Ac、GlcNAc 和N-乙酰甘露糖胺(ManNAc):Sigma 公司; 酵母粉和蛋白胨: 英国OXOID 公司;凝胶阴离子树脂HZ-201:上海华震科技有限公司;其他药品和生化试剂:国药化学试剂有限公司。
种子培养基(组分g/L):蛋白胨10,酵母粉5,氯化钠5;pH 7.0。 平板培养基加琼脂20。
发酵培养基(组分g/L):葡萄糖10,(NH4)2SO46.17,KH2PO47,Na2HPO47,柠檬酸2,MgSO4·7H2O 3。
微量元素(组分mg/L):CaCl2·2H2O 60,MnSO4·H2O 10,ZnSO4·7H2O 3,FeSO4·7H2O 50,ALCl3·6H2O 5,Na2MoO4·2H2O 3,CoCl2·6H2O 0.1,CuSO4·5H2O 0.1,硼酸0.5。
LB 培养基(组分g/L):酵母粉5,蛋白胨10,NaCl 10。
1.2 仪器与设备
5 L 机械搅拌玻璃发酵罐: 上海百仑生物科技有限公司;高效液相色谱安捷伦1260:德国安捷伦公司;超净工作台(SW-CJ-2FD):苏州净化集团安泰公司; 自动高压蒸汽灭菌锅(MLS-3750): 日本SANYO 公司;台式高速冷冻离心机(4K-15):德国Sigma 公司;蛋白电泳仪:美国Bio-Rad 公司;紫外可见分光光度计(UV-2000):尤尼柯(上海)仪器有限公司;pH 计(FE28-Meter):梅特勒-托利多仪器有限公司;恒温振荡培养摇床(HYG-A):江苏太仓市实验设备厂;生物传感分析仪(SBA-40C):山东省生物研究所。
1.3 实验方法
1.3.1 重组E. coli ATLWX 发酵生产N-乙酰葡萄糖胺
1)一级种子液培养 从平板挑取单菌落接种至含有对应抗性的20 mL LB 培养基中,于32 ℃摇床中200 r/min 培养12 h。
2)二级种子液培养 种子培养液培养后,以接种体积分数1%转接到含有对应抗性的50 mL LB培养基中,34 ℃、200 r/min 培养6 h 至OD600为2.5~3.3。
3)分批补料发酵培养 二级种子液以接种体积分数16%接入5 L 发酵罐,装液量2.5 L,发酵温度34 ℃,葡萄糖的初始添加量10 g/L,发酵过程中待初始糖浓度低于2 g/L 时, 手动补加体积分数70%的葡萄糖, 控制残糖在2~5 g/L, 当OD600达到55 后,升温至37 ℃,控制残糖在0.2~0.5 g/L,发酵过程中通过自动补加氨水调节pH 为6.9,关联转速从200 r/min 到850 r/min。 调节溶氧在体积分数10%左右, 发酵过程中每隔一定时间取样测定葡萄糖质量浓度和细菌生长情况。
1.3.2 产物和中间产物的检测 GlcNAc、ManNAc和Neu5Ac 浓度的测定:采用高效液相色谱测定,样品前处理方法及检测方法参照文献[28]。
1.3.3 N-乙酰葡萄糖胺发酵液的处理 发酵得到的发酵液经过离心除菌后, 于-20 ℃冰箱保存,备用。
1.3.4 重组菌的培养及诱导 将-80 ℃甘油管保存的大肠杆菌在卡那霉素(50 mg/L)抗性LB 固体平板上划线,接种单菌落到20 mL 含有对应抗性的培养基中,37 ℃、200 r/min 培养10 h。 取1 mL 种子液转接到50 mL 含有对应抗性的培养基中, 在37 ℃摇床中继续培养至OD600为0.6~0.8 时,加入1 mmol/L IPTG,然后在28 ℃低温诱导8 h。
1.3.5 SDS-PAGE 验证重组蛋白质表达 诱导结束后,离心收集菌体。加一定量的H2O 调节OD600为2.0, 加入5×SDS 凝胶加样缓冲液后混匀,100 ℃加热10 min,10000 r/min 离心3 min。 取10 μL 上清液电泳,考马斯亮蓝R250 对样品染色,染色50 min后, 脱色液脱色3 h, 用含有空载体pET-28a 的E.coli BL21(DE3)作为对照。
1.3.6 全细胞催化制备Neu5Ac 重组菌经诱导后, 用冷冻离心机在4 ℃、7000 r/min 离心5 min,收集菌体, 用pH 7.5,100 mmol/L Tris-HCL 缓冲液洗涤2 次,再次收集菌体。
将收集的菌体重悬于含有0.28 mol/L GlcNAc、一定浓度的丙酮酸、一定浓度的表面活性剂、pH 为6.5,100 mmol/L Tris-HCl 缓冲液的转化体系中,转化温度为30 ℃, 每隔一定时间取样并用NaOH 调节pH 为7.5。
1.3.7 全细胞催化制备Neu5Ac 的条件优化 分别在不同菌体,OD600(10、20、30、40、50)、不同丙酮酸浓度(0.83、1.10、1.38、1.65、1.93、2.20 mol/L)、不同初始pH(6.0、6.5、7.0、7.5、8.0)、不同Triton X-100 的添加量(体积分数0、0.2%、0.4%、0.6%、0.8%、1.0%)和不同温度(20、30、37、40、50 ℃)条件下进行全细胞转化,通过高效液相色谱检测Neu5Ac 的产量。
1.3.8 Neu5Ac 的分离纯化
1)Neu5Ac 溶液的制备 将反应转化液离心除菌后,先用活性炭进行脱色,然后用醋酸调节至pH 4.5 左右,上清液过阴离子树脂柱。
2)阴离子交换树脂处理步骤 分别用1 mol/L NaOH 溶液和去离子水冲洗树脂, 直至流出液pH值为8~9,接着用1 mol/L 的HCl 溶液、去离子水冲洗树脂, 直至流出液pH 值为5~7, 继续用1 mol/L的NaOH 溶液活化树脂层, 将树脂转为氢氧根型,最后用去离子水洗至pH 为7~9。
3)阴离子树脂对Neu5Ac 溶液的动态吸附洗脱将处理好的阴离子树脂HZ-201400 mL 以湿法装入层析柱, 将待纯化的含Neu5Ac 的样品溶液调节pH 至4.5 上样,上样后用1 个柱体积的去离子水洗去无法结合的物质, 然后用0~0.65 mol/L 甲酸线性洗脱,洗脱液用EP 管收集,每管7 mL,用HPLC 检测收集样品中Neu5Ac 的浓度。
4)Neu5Ac 晶体的制备 洗脱液经旋转蒸发浓缩至Neu5Ac 质量浓度为150 g/L 左右,加入7 倍体积的异丙醇,4 ℃放置2 d,使Neu5Ac 结晶。 通过真空泵抽滤液体,得到的晶体用60 ℃烘箱烘至质量恒定。
2 结果与分析
2.1 重组菌E. coli/pET28a-(T7-shnal)-(tac-slr)的诱导表达
诱导表达重组菌E. coli/pET28a-(T7-shnal)-(tac-slr)后,SDS-PAGE 电泳见图1。相比对照菌株,重组菌在约40000、33000 处有较粗的条带, 说明两个重组蛋白AGE 和NanA 均成功表达。

图1 重组菌E. coli/pET28a-(T7-shnal)-(tac-slr) 表达AGE 和NanA 蛋白质电泳分析Fig. 1 SDS-PAGE analysis of expression of AGE and NanA by recombinant E. coli/pET28a-(T7-shnal)-(tac-slr)
2.2 制备N-乙酰葡萄糖胺发酵液
以E. coli ATLWX 作为出发菌株, 在5 L 发酵罐中补料分批发酵生产N-乙酰葡萄糖胺。 葡萄糖的初始质量浓度为10 g/L, 发酵温度为34 ℃时,重组E. coli 在10 h 后葡萄糖几乎消耗完, 之后开始补加葡萄糖,控制残糖质量浓度在2~5 g/L。 当发酵16 h 时,OD600达到55,提高发酵温度至37 ℃,控制残糖质量浓度在0.2~0.5 g/L;发酵34 h 后菌体浓度趋于稳定,产量增长变缓;当发酵45 h 时,菌体浓度OD600达到135,GlcNAc 产量达到61 g/L, 发酵过程中pH 随着时间缓慢增加,见图2。

图2 重组E. coli ATLWX 发酵生产GlcNAcFig. 2Production of GlcNAc by fermentation of recombinant E. coli ATLWX
2.3 以GlcNAc 发酵液为底物进行全细胞催化
重组菌E. coli ATLWX 发酵得到的发酵液经过离心除菌后,于-20 ℃冰箱保存备用。为进一步测定E. coli 全细胞催化含有GlcNAc 的发酵液合成Neu5Ac 的能力,收集诱导后的菌体,以0.28 mol/L(约60 g/L)GlcNAc 为底物,加入0.74 mol/L 丙酮酸钠和质量分数0.2% Triton X-100 进行全细胞转化。由图3 可以看出,当反应36 h 时,Neu5Ac 产量达到44.5 mmol/L,转化率为16.18%,表明以含有GlcNAc的发酵液为底物进行全细胞转化是可行的。
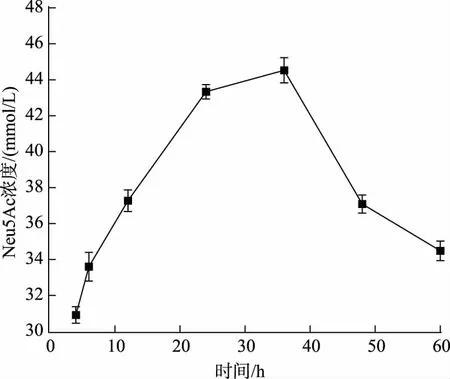
图3 重组E. coli 全细胞催化GlcNAc 发酵液合成Neu5Ac Fig. 3 Synthesis of Neu5Ac from GlcNAc using recombinant E. coli whole cells
2.4 以发酵液为底物进行全细胞催化的条件优化
2.4.1 细胞浓度对Neu5Ac 的影响 在实际应用中为了保证一定的生产效率和经济效益,因此,需要控制菌体浓度在合适范围内[29]。 在转化液初始pH为7.5, 反应温度为30 ℃,GlcNAc 浓度为0.28 mol/L,丙酮酸浓度为0.74 mol/L,Triton X-100 的体积分数为0.2%,菌体OD600分别为10、20、30、40、50 的条件下进行全细胞催化反应。 从图4 可以看出,转化体系OD600在10~30 时,Neu5Ac 产量随菌体浓度的增大而增加,主要是因为菌体浓度越高,酶量越多,对应产量就会越高,当菌体浓度大于30 时,产量反之减少,主要是因为菌体浓度过高,转化体系黏度增大, 影响了底物和产物的传质, 当转化体系菌体OD600为30 时,Neu5Ac 产量最高,达到42.8 mmol/L,转化率为15.57%,因此,选择菌体浓度OD600为30进行后续实验。
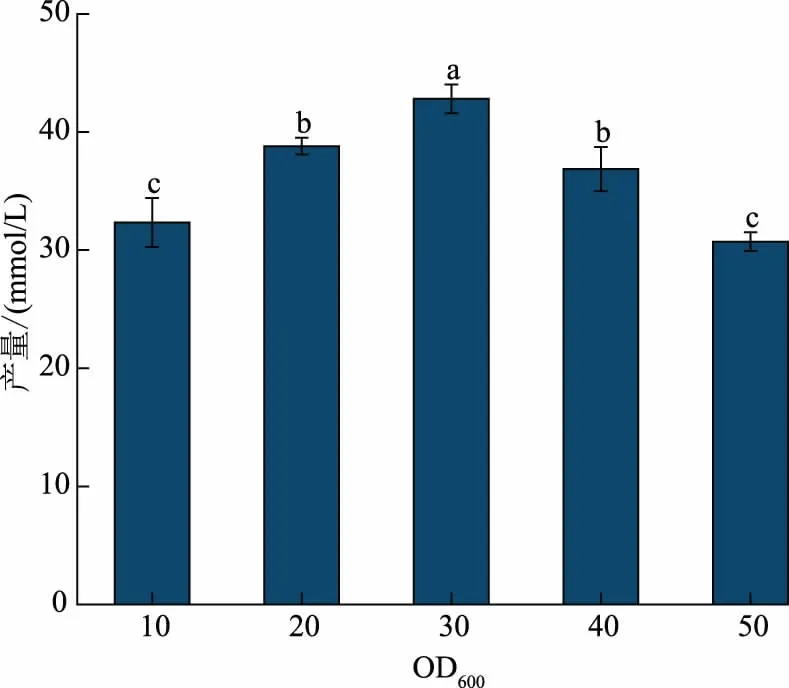
图4 菌体OD600 对重组E. coli 全细胞催化合成Neu5Ac 的影响Fig. 4 Effects of cell concentration on synthesis of Neu5Ac using recombinant E. coli whole cells
2.4.2 丙酮酸浓度对Neu5Ac 的影响 丙酮酸是全细胞催化的底物之一,因此,其浓度高低对Neu5Ac的合成有影响。 保持其他条件不变的情况下,控制丙酮酸浓度分别为0.83、1.10、1.38、1.65、1.93、2.20 mol/L (GlcNAc 和丙酮酸浓度比分别为1∶3、1∶4、1∶5、1∶6、1∶7、1∶8)进行全细胞催化反应,考察不同丙酮酸浓度对合成Neu5Ac 的影响。从图5 可以看出,当丙酮酸浓度为1.10 mol/L 时,Neu5Ac 的转化率仅有17.27%; 当丙酮酸浓度增加到1.65 mol/L 时,产量为75.9 mmol/L,转化率提高到27.6%;继续增加丙酮酸浓度,产量几乎不变,这可能是因为高摩尔浓度的丙酮酸会抑制N-乙酰葡萄糖胺-2-差向异构酶的活性[30],从而导致产量不再增加。由于添加过量的丙酮酸不仅会发生底物抑制作用, 还会增加后期的分离纯化难度,因此,选择1.65 mol/L 的丙酮酸进行后续实验。

图5 丙酮酸摩尔浓度对重组E. coli 全细胞催化合成Neu5Ac 的影响Fig. 5 Effects of pyruvate concentrations on synthesis of Neu5Ac using E. coli whole cells
2.4.3 转化液起始pH、 表面活性剂添加量对Neu5Ac 的影响 pH 可以通过影响酶的活性来影响Neu5Ac 的合成,因此,作者考察了不同转化液起始pH 对合成Neu5Ac 的影响。 保持其他条件不变,在转化液初始pH 分别为6.0、6.5、7.0、7.5、8.0 的条件下进行全细胞催化反应,结果见图6(a)。 随着pH的升高,Neu5Ac 的产量先增加后减少,当pH 为6.5时, 产量最高, 达到97.16 mmol/L, 转化率为35.33%, 说明偏酸性的条件更有利于Neu5Ac 的合成。原因可能是细胞质的pH 为中性,在微酸性条件下,由于细胞膜内外pH 不同产生的电位差,促进了ATP 合成[31],ATP 又可以作为N-乙酰葡萄糖胺-2-差向异构酶的活化剂进一步促进Neu5Ac 的合成,因此,后续选择转化液起始pH 为6.5 进行实验。 表面活性剂可以改变细胞膜的通透性从而有利于底物的进入和产物的流出,因此研究了不同表面活性剂的添加量对全细胞催化合成Neu5Ac 的影响,结果如图6 (b)。 当Triton X-100 添加质量分数小于0.4%时,对Neu5Ac 的合成影响不大;当Triton X-100 添加质量分数0.4%时, 产量最高, 达到102.5 mmol/L,转化率为37.3%;继续提高Triton X-100 添加量,Neu5Ac 的产量略微有所下降, 可能是由于Triton X-100 质量分数的增加导致转化体系中的含氧量降低,从而降低了重组大肠杆菌的生理活性[32],因此,选择表面活性剂添加质量分数0.4%进行后续实验。

图6 转化液起始pH、 表面活性剂添加量对重组E. coli 全细胞催化合成Neu5Ac 的影响Fig. 6 Effects of initial pH,concentrations of surfactant added on synthesis of Neu5Ac using E. coli whole cells
2.4.4 温度对生产Neu5Ac 的影响 温度对酶活也有一定的影响,因此作者考察了不同温度对全细胞合成Neu5Ac 的影响。 保持其他条件不变, 分别在20、30、37、40、50 ℃下进行全细胞催化反应。 从图7可以看出,在温度低于30 ℃时,Neu5Ac 的产量随温度的升高而上升, 温度为30 ℃时产量最高,为103.4 mmol/L,转化率为37.6%。 温度超过30 ℃时,产量随温度的上升而下降。 当反应温度为50 ℃时,产量只有27.3 mmol/L。 由此可见, 反应温度对Neu5Ac 的合成影响较大。 这可能是由于温度过高,酶的空间结构发生改变,导致酶活力下降。 因此,后续采用30 ℃进行全细胞催化。
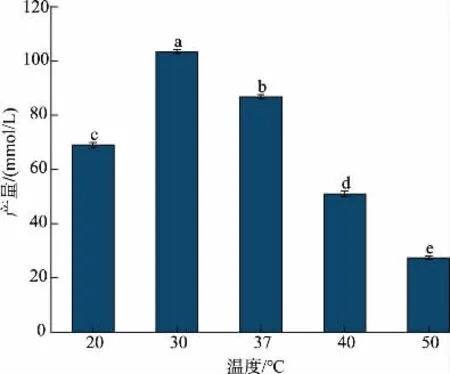
图7 温度对重组E. coli 全细胞催化合成Neu5Ac 的影响Fig. 7 Effects of temperature on synthesis of Neu5Ac using E. coli whole cells
2.5 正交实验优化全细胞催化生产Neu5Ac 条件
在单因素实验基础上,综合考察各种因素对生产Neu5Ac 的影响,选择菌体OD600、丙酮酸浓度、表面活性剂添加质量分数3 个因素进行三因素三水平正交实验,各因素水平安排见表1。

表1 全细胞催化条件优化正交实验因素水平Table 1 Factor levels of whole cell catalytic conditions optimized orthogonal test
对正交实验结果进行极差分析,通过极值的大小可以反映出各因素对Neu5Ac 产量的影响程度。通过表2 可知, 菌体浓度对Neu5Ac 产量的影响最大,其次为表面活性剂的添加量,丙酮酸浓度对产量影响最小,结合表3 的方差分析结果,确定三因素的最佳组合为A2B1C3,即菌体浓度为30,丙酮酸浓度为1.38 mol/L,表面活性剂添加质量分数0.4%。采用此条件进行全细胞催化实验, 反应48 h 后,Neu5Ac 产量为(141±3) mmol/L,转化率为(51.27±1.09)%。

表3 方差分析结果Table 3 Variance analysis results
2.6 全细胞催化在发酵罐上进行放大
为高效利用重组E. coli/pET28a-(T7-shnal)-(tac-slr)全细胞催化生产Neu5Ac,按照正交实验优化后的条件,在发酵罐中进行全细胞催化反应的放大。在5 L 发酵罐中,催化条件为:反应温度为30 ℃,初始pH 为6.5,GlcNAc 浓度为0.28 mol/L, 丙酮酸浓度为1.38 mol/L,Triton X-100 添加质量分数0.4%,菌体OD600为30,进行全细胞转化,并用高效液相色谱检测转化液中各组分浓度。 从图8 可以看出,在反应前期,随着反应的进行,底物GlcNAc 浓度不断下降,产物Neu5Ac 浓度逐渐上升;反应70 h时,Neu5Ac 产量最高, 为180 mmol/L, 转化率为65.45%,比优化前提高了49.27%。

图8 在5 L 发酵罐中重组E. coli 全细胞催化合成Neu5AcFig. 8 Synthesis of Neu5Ac using E. coli whole cells in 5 L fermentor
2.7 Neu5Ac 的分离纯化
全细胞转化后的转化液经过脱色处理后,将浓度为42 mmol/L 的Neu5Ac 溶液在阴离子树脂上进行上样,先经过水洗脱,然后用0~0.65 mol/L 的甲酸线性洗脱,洗脱曲线见图9(a)。 随着甲酸浓度的增加, 洗脱液中Neu5Ac 的浓度也不断增加, 含有Neu5Ac 的洗脱液主要集中在0.8~1.1 L, 甲酸摩尔浓度在0.1~0.6 mol/L 时, 洗脱液中Neu5Ac 浓度较高。 因此,后续实验选择0.6 mol/L 的甲酸作为洗脱液。

图9 Neu5Ac 的洗脱曲线及Neu5Ac 标品和结晶样品的HPLC 图谱Fig. 9 Elution curve of Neu5Ac and HPLC chromatogram of Neu5Ac standard and crystal sample
将含有Neu5Ac 的洗脱液进行浓缩和结晶处理后,得到Neu5Ac 晶体0.44 g,结晶回收率为42.5%,将纯化得到的Neu5Ac 样品和Sigma 公司的Neu5Ac 标品用HPLC 分析,Neu5Ac 标样和样品出峰时间一致,纯度为98.3%,见图9(b)。
3 结语
全细胞催化法作为一种操作简单、 副产物少,且反应条件温和、污染低的生产方法,相比其他生产工艺具有明显优势,更适合大规模生产。 现阶段,全细胞生物催化法生产N-乙酰神经氨酸需要添加昂贵的N-乙酰葡萄糖胺作为前体物, 为了降低成本, 作者以含有N-乙酰葡萄糖胺的发酵液为底物进行全细胞催化,通过对催化条件进行优化,在菌体OD600为30、丙酮酸添加量为浓度1.38 mol/L、转化液起始pH 为6.5、Triton X-100 的添加质量分数为0.4%、 反应温度为30 ℃的条件下,Neu5Ac 的产量可以达到180 mmol/L,转化率达65.45%,比优化前提高了49.27%。反应后的转化液经脱色后过阴离子树脂,洗脱液经浓缩、结晶后得到了较为纯净的Neu5Ac,HPLC 检测分析其纯度为98.3%,该生产工艺经济、高效,为Neu5Ac 连续工业化生产提供了参考。 本研究中全细胞催化生产Neu5Ac 在70 h 产量达到最高,转化过程中随着时间的延长,细胞的活性和理状态也会发生改变。 因此,可以通过优化转化液的组成提高细胞的生理活性来进一步提高Neu5Ac 的产量。
