在线固相萃取-高效液相色谱法快速测定果汁中的苯并咪唑类残留量
2024-03-15何瑞雪
◎ 何瑞雪,彭 芸,游 靖,何 玥,曾 玮
(1.珠海市食品药品检验所,广东 珠海 519000;2.安捷伦科技(中国)有限公司,广东 广州 510000)
多菌灵、甲基硫菌灵和噻苯达唑是常见的苯并咪唑类杀菌剂,具有高效性和广谱性,常用于果蔬的病虫害防治[1-3]。这些物质在美国、加拿大、欧盟等国家和地区已被禁止在食品中使用,但我国并未禁止使用,《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2021)给出了这3 种物质在各类食品中的最大残留限量。
目前有多种方法对果蔬中多菌灵、甲基硫菌灵和噻苯达唑残留物进行分析,包括表面增强拉曼散射法[4]、荧光光谱法[5]、高效液相色谱法[6]、液相色谱-串联质谱法[7]等。为了降低基质效应,农药残留物的检测往往需要一定的前处理方法。常用的前处理方法有液液萃取[8]、传统固相萃取[9]、分散固相萃取[10]、在线固相萃取[11-12]等。液液萃取溶剂消耗量大,传统固相萃取样品量需求大,而在线固相萃取样品消耗小且可以重复使用吸附剂,可以实现自动化和低成本的工作流程[13]。
本研究通过高效液相色谱仪搭载在线固相萃取装置,建立了检测果汁中多菌灵、甲基硫菌灵和噻苯哒唑含量的方法。本方法节省了样品前处理时间和前处理所需的试剂与耗材,无须用到液质联用仪即可达到质谱检测的灵敏度,节省了仪器成本。此外,萃取小柱经在线活化后可反复使用,解决了离线固相萃取处理耗时长、成本高的问题。
1 材料与方法
1.1 材料与试剂
多菌灵标准物质,1 000 μg·mL-1,含量≥99%,北京坛墨质检科技有限公司;甲基硫菌灵标准物质,1 000 μg·mL-1, 含量≥99%,First Standard; 噻苯哒唑标准物质,1 000 μg·mL-1,含量≥99%,First Standard;乙腈、甲醇,色谱纯;实验室用水为超纯水。
1.2 仪器与设备
安捷伦1260 infinity Ⅱ在线固相萃取-液相色谱仪,二极管阵列检测器,10 mm 流量池,荧光检测器,美国安捷伦公司;SIGMA 3K15离心机,曦玛离心机(扬州)有限公司;milli-Q IQ 7000 超纯水系统,德国默克密理博公司。
1.3 实验方法
1.3.1 色谱条件
色谱柱:Poroshell HPH C18(100 mm×4.5 mm,2.7 μm); 萃取柱:PLRP-S(4.6 mm×12.5 mm,15 ~20 μm);柱温:30 ℃;进样量:20 μL;上样泵流动相:水-甲醇;分析泵流动相:水-甲醇;流速:0.5 mL·min-1;切阀时间:5.0 min 萃取柱切换到二维,6.5 min 萃取柱切换到一维;二极管阵列检测波长:280 nm;荧光检测波长:激发波长280 nm、发射波长315 nm;运行时间:20 min;后运行时间:2 min。上样泵梯度:0 ~2 min,20%甲醇;2 ~6 min,甲醇20% →90%;6 ~10 min, 甲醇90% →100%;10 ~16.5 min, 甲醇100%;16.5 ~16.6 min, 甲醇100% →20%。 分析泵梯度:0 ~5 min,15%甲醇;5 ~9 min,甲醇15% →50%;9 ~13 min,甲醇50%→100%;13 ~15 min,甲醇100%;15 ~18 min,甲醇100%→15%。
1.3.2 在线固相萃取-高效液相色谱分析流程
在线固相萃取过程主要包括活化、进样、净化、反冲、分析5 个过程。样品组分由进样器引入在线固相萃取柱上纯化和富集,干扰物则从柱上流出并排至废液中,分析柱处于清洗和平衡的状态;切换六通阀后,分析泵流动相将目标化合物从在线固相萃取柱上反冲到分析柱上,此时在线固相萃取柱和分析柱形成串联通路;待目标化合物全部转移后,再次切换六通阀,使在线固相萃取柱和分析柱处于分离状态,目标化合物在分析柱上进行分离和定量分析,在线固相萃取柱则进行清洗和平衡过程,等待下一次进样。
1.3.3 标准溶液的配制
标准储备液配制:准确移取多菌灵标准物质(1 000 μg·mL-1)、噻苯哒唑标准物质(1 000 μg·mL-1)、甲基硫菌灵标准物质(1 000 μg·mL-1)各100 μL 到10 mL 棕色容量瓶中,用水稀释至刻度,-20 ℃冰箱避光保存,该混合标准储备液浓度为10 μg·mL-1。
系列标准工作液配制:准确移取混合标准储备液(10 μg·mL-1)0.05 mL、0.10 mL、0.20 mL、0.50 mL、1.00 mL 和2.00 mL 到10 mL 棕色容量瓶中,移取1 μg·mL-1的标准溶液0.05 mL、0.10 mL 到10 mL 棕色容量瓶中,用水稀释至刻度,-20 ℃冰箱避光保存,分别配成系列1混合标准工作液浓度为0.005 μg·mL-1、0.050 μg·mL-1、0.100 μg·mL-1、0.200 μg·mL-1、0.500 μg·mL-1、1.000 μg·mL-1和2.000 μg·mL-1;系列2 混合标准工作液浓度为0.01 μg·mL-1、0.05 μg·mL-1、0.10 μg·mL-1、0.20 μg·mL-1、0.50 μg·mL-1、1.00 μg·mL-1和2.00 μg·mL-1。
1.3.4 样品前处理
果汁样品经过9 000 r·min-1离心5 min,过0.22 μm微孔滤膜后,进高效液相色谱仪测定。
2 结果与分析
2.1 色谱条件的优化
2.1.1 上样泵流动相及梯度选择
上样泵的主要作用是纯化和富集目标化合物,在洗脱过程中能尽快使目标化合物洗脱至分析柱中,同时又不影响目标化合物在分析柱上的分离。为确定上样泵的条件,在不接分析泵和分析色谱柱的情况下,标准物质进样后直接洗脱至检测器检测。PLRP-S 在线固相萃取小柱采用聚合物型反相吸附剂,支持逆流,适用范围广,通过实验考察了甲醇、水作为上样流动相时3 种化合物的保留情况。结果显示,多菌灵、甲基硫菌灵以及噻苯哒唑均能有效保留,洗脱过程采用高比例甲醇进行洗脱,3 种农药均能在1.5 min 内有效洗脱,由此确定洗脱至分析柱过程的切阀时间,完成分析后在线固相萃取小柱进行清洗和平衡过程,等待下一次进样。
2.1.2 分析泵流动相及梯度选择
为使多菌灵、甲基硫菌灵以及噻苯哒唑3 种物质达到良好的分离效率,采用3 种物质的单标和混合标准工作液对分析泵参数进行优化。分别采用水、体积分数0.1%磷酸水溶液、离子对试剂(吸取7.00 mL磷酸于100 mL 水中,加入1.0 g 辛烷磺酸钠,溶解,加入10.00 mL 三乙胺,加水定容至1 000 mL)、0.02 mol·L-1乙酸铵水溶液、0.02 mol·L-1乙酸铵水溶液(加入体积分数0.1%甲酸)作为水相,甲醇和乙腈作为有机相,考察流动相对色谱分离效率的影响。结果表明,离子对试剂、0.02 mol·L-1乙酸铵水溶液作为流动相,3 种物质均不出峰;在0.02 mol·L-1乙酸铵水溶液的基础上加入体积分数0.1%的甲酸,3 种物质可出峰但色谱峰峰形宽;体积分数0.1%磷酸水溶液作为流动相体系,3 种物质可出峰,峰形对称,但混标多菌灵和甲基硫菌灵峰形重叠,调整流动相梯度均不能使多菌灵与甲基硫菌灵有效分离;水-乙腈作为流动相体系,3 种物质均不出峰;水-甲醇作为流动相体系,3 种物质可出峰,峰形窄且对称,且能达到较为理想的色谱分离效果,因此选择水和甲醇作为分析泵流动相。
2.1.3 检测器参数的优化
在相同的色谱条件下,采用3 种物质的单标和混合标准工作液对检测器参数进行优化。采用二极管阵列检测器于200 ~800 nm 波长下扫描,发现3 种物质在280 nm 处吸收强度较大,因此选择该波长进行检测。采用荧光检测器固定发射波长进行多激发波长检测,以及固定激发波长进行多发射波长检测的方法,得到激发波长280 nm、发射波长315 nm 的检测条件,但甲基硫菌灵在荧光检测器上无响应,色谱图见图1、图2。
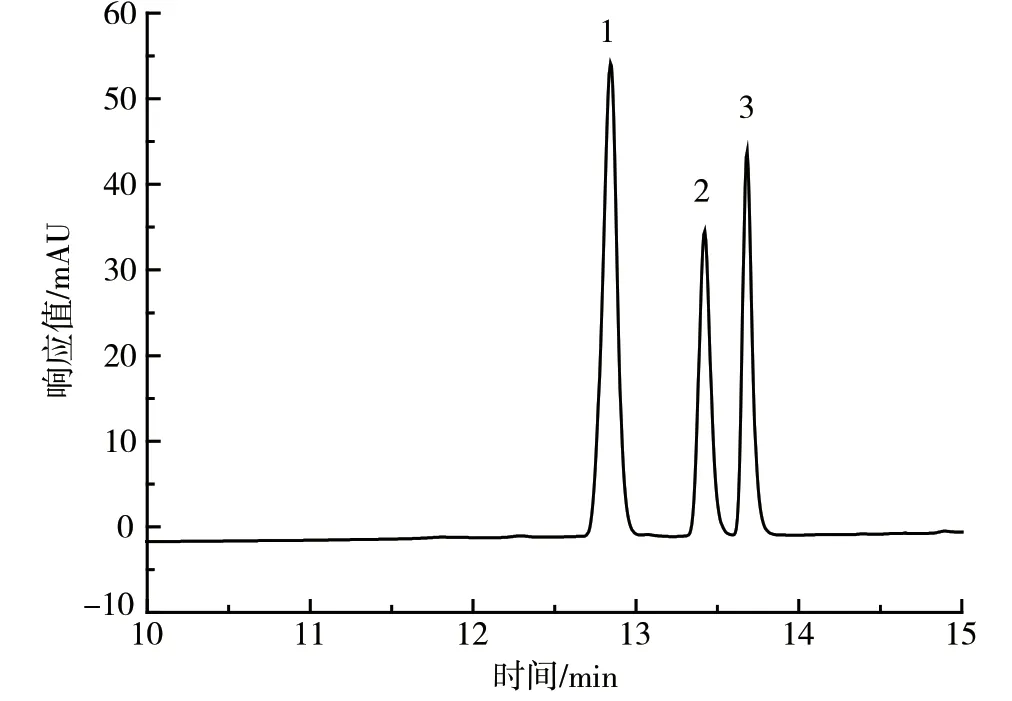
1—多菌灵;2—噻苯哒唑;3—甲基硫菌灵。图1 3 种化合物的色谱图(二极管阵列检测器)
2.2 线性范围和检测限
由表1和表2可知,采用二极管阵列检测器,多菌灵、甲基硫菌灵以及噻苯哒唑在0.01 ~2.00 μg·mL-1浓度范围内线性关系良好,检出限均为0.01 μg·mL-1;采用荧光检测器,多菌灵以及噻苯哒唑在0.005 ~2.000 μg·mL-1浓度范围内线性关系良好,检出限均为0.005 μg·mL-1,在荧光检测器上可得到更高的响应值和更低的检出限。

表1 3 种化合物的线性关系、检出限表(二极管阵列检测器)

表2 2 种化合物的线性关系、检出限表(荧光检测器)
2.3 回收率与精密度
采用加标回收实验来验证方法的准确性,在样品中分别加入4 个浓度水平的待测物,每个水平重复6 次,计算加标回收率及相对标准偏差,结果见表3和表4。采用二极管阵列检测器,在苹果汁和梨汁基质中,加标回收率在89.4%~106.9%,相对标准偏差在0.3%~4.5%;采用荧光检测器,在苹果汁和梨汁基质中,加标回收率在94.5%~101.6%,相对标准偏差在0.2%~5.4%,回收率和精密度均符合化学分析方法的要求。
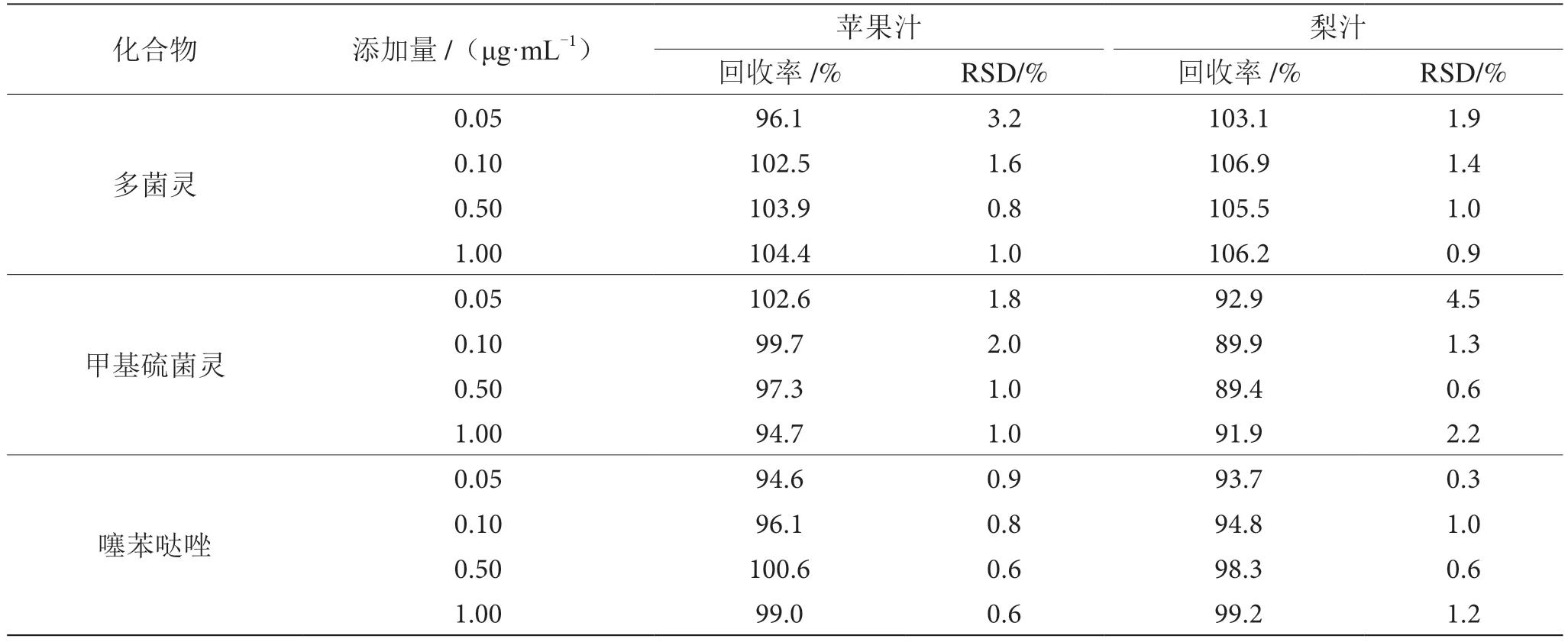
表3 二极管阵列检测器检测苹果汁和梨汁中3 种化合物的回收率和精密度表(n=6)
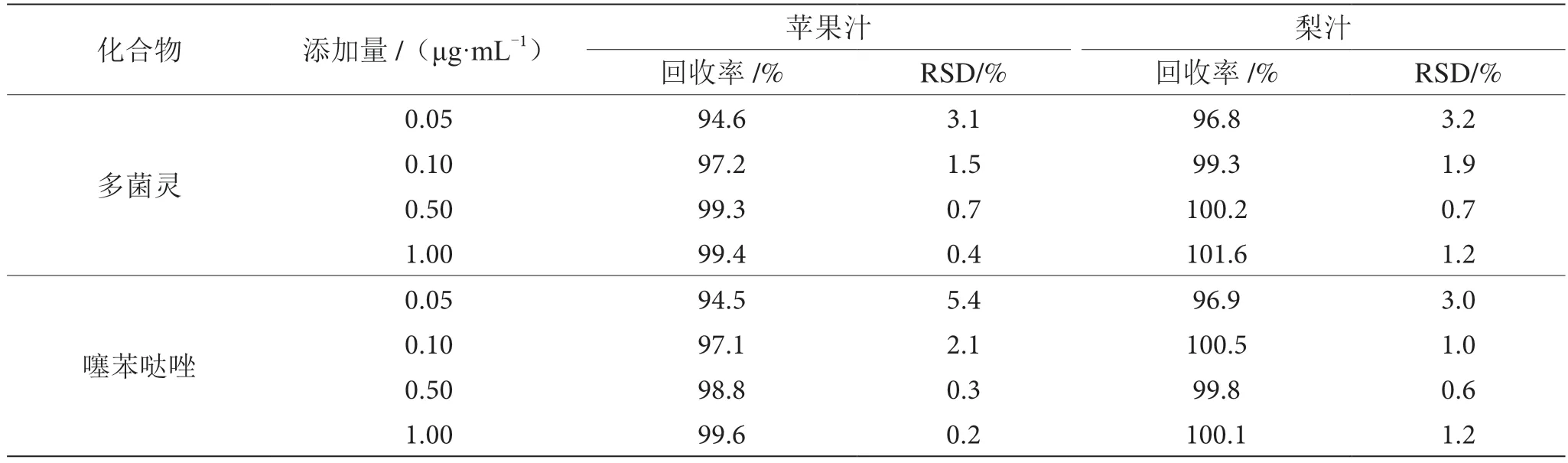
表4 荧光检测器检测苹果汁和梨汁中2 种化合物的回收率和精密度表(n=6)
3 结论
本研究建立了在线固相萃取-高效液相色谱法快速测定果汁中的多菌灵、甲基硫菌灵和噻苯哒唑残留量分析方法,样品经高速离心处理,直接进高效液相色谱仪,采用以聚合物为填料的PLRP-S 萃取柱进行净化和富集后,切换六通阀使目标物进入C18分析柱分离,采用甲醇-水为流动相,进行梯度洗脱,分别用二极管阵列检测器检测和荧光检测器检测。样品提取步骤是整个检测中至关重要的一环,影响着实验的准确性和精密度,该方法样品无须复杂的前处理,净化和富集过程完全由液相色谱仪在线固相萃取系统自动完成,与传统前处理方法相比,不仅避免了离线固相萃取前处理过程中复杂烦琐的步骤,减少了提取步骤中由人为因素导致回收率偏低和重复性差的情况,而且试剂消耗量小,降低了检测的经济成本,提高了检测的效益,为果汁中多菌灵、甲基硫菌灵和噻苯哒唑残留量的检测提供技术支持,也可为其他药物的快速检测提供参考依据。
