呋虫胺对映体对普洱茶中黑曲霉关键酶活性的影响
2024-03-15李凯茜杜丽娟叶艳萍毕亚楠李新宇刘宏程
◎ 李凯茜,杜丽娟,叶艳萍,毕亚楠,李新宇,刘宏程
(云南省农业科学院质量标准与检测技术研究所,云南 昆明 650205)
普洱茶是云南省名茶。目前,随着普洱茶在世界范围内销量上升,为增加原材料茶叶产量,化学农药被广泛用于农业病虫害防治,有研究指出农药的使用每年均可挽回35%的农药损失[1]。但是长期大量使用农药会造成农药残留,不仅会导致人和动物慢性中毒,致畸致残,还会导致环境中微生物生态平衡被破坏[2]。普洱茶的发酵过程中存在多种微生物,黑曲霉的数量始终处于优势地位,是普洱茶生产加工过程中的优势菌种,也是影响普洱茶风味品质的重要菌种[3]。黑曲霉产生的代谢产物1,2,3-三甲氧苯、2-二甲氧基-4-甲基苯等是普洱茶特征香气的主要成分之一,其产生的有机酸和酶等物质也对普洱茶品质有重要影响[4]。
新烟碱型农药是一类尼古丁相关的神经活性杀虫剂,是当前开发利用最成功的广谱杀虫剂[5]。目前,市面上运用较为广泛的新烟碱型农药有吡虫啉、呋虫胺、啶虫脒等[6]。呋虫胺是第三代新烟碱型杀虫剂,通过对昆虫的突出神经的阻断作用使昆虫死亡[7]。呋虫胺具有手性,包含了两个对映体S-(+)-呋虫胺和R-(-)-呋虫胺[8]。研究表明,呋虫胺不同对映体对昆虫的生物活性不同[9]。例如,S-(+)-呋虫胺对家蝇的生物活性是R-(-)-呋虫胺的3.0 ~3.4 倍[10]。在环境介质中,呋虫胺不同对映体的选择性代谢降解具有差异性[11]。陈秀等[12]发现在黄瓜中,S-(+)-呋虫胺的半衰期为8.3 ~11.7 d,R-(-)-呋虫胺的半衰期为7.6 ~10.8 d。
土壤中的微生物体及酶促成了元素循环和生态系统的新陈代谢,土壤中的酶大部分来自生物体,尤其是微生物体[13]。农药的施用可导致酶活性水平发生变化,农药自身的理化性质、施药次数和浓度都可能抑制或激活土壤酶活性[14]。目前,很多国家通过农药对土壤中微生物及酶活性的影响,对农药生态安全进行评价[13]。因此,研究农药对环境中微生物及酶活性的影响具有重要的意义。
本文以普洱茶中优势菌种黑曲霉为研究对象,研究在第三代新烟碱农药呋虫胺不同对映体干扰下,黑曲霉中几种新陈代谢关键酶类酶活性的变化情况,以期为后续新烟碱型农药应用于普洱茶的安全评价及新烟碱型农药的降解提供理论基础。
1 材料与方法
1.1 材料与试剂
普洱晒青毛茶,云南省农业科学院质量标准与检测技术研究所;马铃薯葡萄糖水(Potato Dextrose Broth,PDB)培养基;马铃薯葡萄糖琼脂(Potato Dxtrose Agar,PDA)培养基;孟加拉红(虎红)琼脂;NaCl(优级纯);呋虫胺外消旋体(Rac-(±)-呋虫胺)(>99%,上海勤路生物技术有限公司);S-(+)-呋虫胺(>99%,上海勤路生物技术有限公司);R-(-)-呋虫胺(>99%,上海勤路生物技术有限公司);谷胱甘肽S-转移酶检测试剂盒(Solarbio公司);漆酶活性检测试剂盒(Solarbio 公司);丙二酰基转移酶(Mal-onyl/Acetyltransferase,MAT)酶联免疫分析试剂盒(上海莼试生物有限公司);糖基转移酶(Glycosyltransferases,GTs)酶联免疫分析试剂盒(上海莼试生物有限公司)。
1.2 仪器与设备
PT1600E 匀质机(北京亚欧德鹏科技有限公司);BSA123S-cw 电子天平(德国Sartorius 公司);超纯水仪(美国Millipore 公司);HMJ-150 培养箱(上海跃进医疗器械厂);HZP-15 振荡培养箱(上海跃进医疗器械厂);SysteeVB-55 灭菌锅(德国Systee 公司);Alphaclean1300 超净工作台(力康科技有限公司);HHWS-150 恒湿恒温培养箱(上海跃进医疗器械厂);HC-2518R 冷冻离高速心机(安徽中科中佳科学仪器有限公司);TD5A-WS 高速离心机(湖南湘仪实验仪器开发有限公司);F619703-05 BP 系列精密单道可调移液器(加拿大BBI);BCD-256KT 冰箱(青岛海尔股份有限公司);722S 分光光度计(上海菁华科教仪器公司);1530-800824 酶标仪(德国thermoscientificg 公司);bx51 显微镜(olympus 公司)。
1.3 实验方法
1.3.1 黑曲霉菌株筛选
将普洱晒青毛茶在无菌环境中打碎,放入无菌生理盐水和装有小玻璃珠的三角瓶中,在振荡培养箱中28 ℃摇床振荡20 min,用无菌生理盐水将混合液进行10 倍、100 倍、1 000 倍稀释。分别取1 mL 各梯度稀释液涂布于初筛平板,28 ℃培养,挑取黑色或褐色呈菊花状、边缘呈半透明或白色的菌落进行反复分离纯化,当生长菌落形态特征一致时,用石碳酸复红染液染色,进行显微镜镜检,确定其是否纯化。纯化后的菌株用15%(V/V)的甘油于-20 ℃冰箱保存备用。
菌株鉴定委托生工生物工程(上海)股份有限公司。
1.3.2 黑曲霉菌株培养
将黑曲霉菌株分别接种至PDA 和PDB 培养基中,分别取1 mL 20 mg·L-1的Rac-(±)-呋虫胺、S-(+)-呋虫胺、R-(-)-呋虫胺稀释液均匀喷洒于培养基中,置于28 ℃培养箱培养28 d。试验进行3 次重复,每天观察菌落形态并记录。
1.3.3 酶活性测定
测定不同时间喷洒了不同呋虫胺对映体的黑曲霉在生长发育过程中的几种新陈代谢关键生物酶活性。①谷胱甘肽S-转移酶:采用谷胱甘肽S-转移酶检测试剂盒测定。②漆酶:采用漆酶活性检测试剂盒测定。③丙二酰基转移酶:采用丙二酰基转移酶酶联免疫分析试剂盒测定。④糖基转移酶:采用糖基转移酶酶联免疫分析试剂盒测定。
1.4 数据分析
采用软件Excel 2016 和SPSS 26.0 对实验数据进行处理和单因素方差分析,结果以3 次重复实验数据的平均值形式表示。
2 结果与分析
2.1 谷胱甘肽S-转移酶酶活性分析
谷胱甘肽S-转移酶(Glutathione S-Transferase,GST)是细胞体内解毒酶系统的重要组成之一,使机体响应多种环境胁迫、保护机体免受有毒物质的伤害[15]。GST 具有调控细胞生长发育、跨膜运输定位、参与还原过氧化物、保护细胞免受氧化损失等功能[16]。由图1 可知,在28 d 培养周期中,Rac-(±)-和S-(+)-呋虫胺培养基中生长的黑曲霉GST 活性相对低,尤其在培养后期(16 ~28 d),表明Rac-(±)-和S-(+)-呋虫胺相较于R-(-)-呋虫胺对真菌中的GST 有一定的抑制作用。在10 ~16 d,R-(-)-呋虫胺培养基中GST 酶活性数值增加较快,由0.059 9 U·mL-1增加到最大值0.074 1 U·mL-1,之后逐渐降低至0.061 3 U·mL-1。S-(+)-呋虫胺中酶活性在5 ~10 d增长较快,之后有一个较小的波动,在20 d 时增长至最大值0.066 0 U·mL-1,第28 d 降低至0.059 9 U·mL-1。Rac-(±)-呋虫胺中酶活性值与S-(+)-呋虫胺中的变化趋势基本一致。GST 可与外源性化学物质结合,使亲电化合物变成亲水物质,将潜在或具备毒性外源性化学物质降解并排出体外,防止其与细胞大分子共价结合对细胞造成机械性损伤[17]。因此GST 可与农药结合,使有机污染物分解失活并排出体外,从而降低农药对微生物生长的负面影响。前期农药的添加对GST 有一定的刺激作用,随着微生物对呋虫胺不同对映体的不断分解,GST 酶活性随着农药的减少而降低。
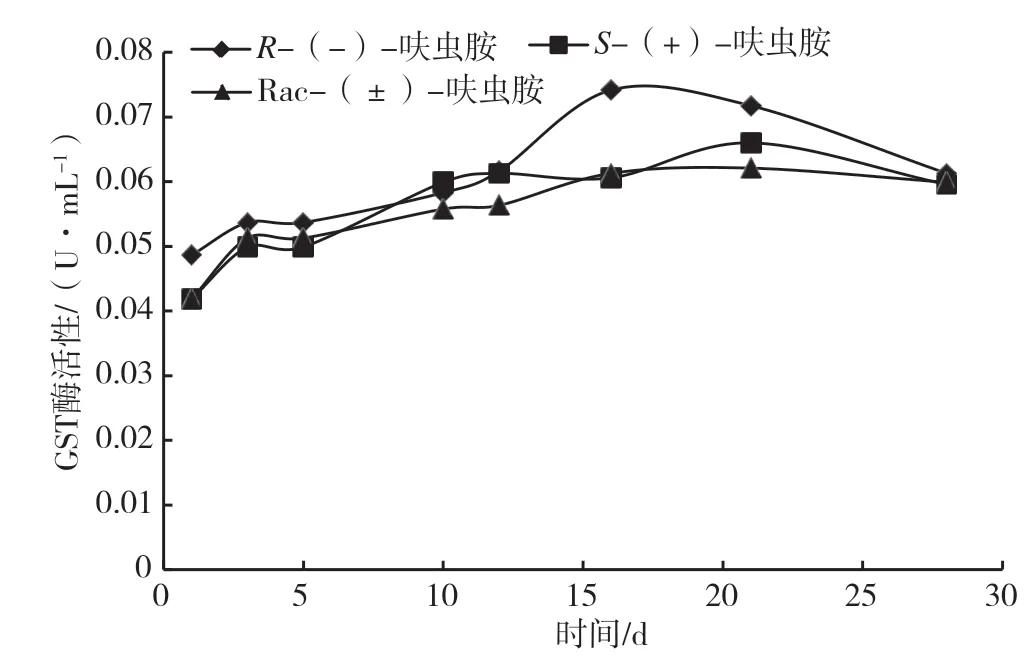
图1 不同培养基中黑曲霉的GST 酶活性图
2.2 漆酶酶活性分析
漆酶是一种多酚氧化酶,漆酶中的铜离子在底物催化过程中可传递电子,漆酶还可依靠小分子介质形成漆酶-介质系统,实现漆酶与底物的电子传递,氧化底物[18-19]。漆酶可催化的底物范围较广,不仅包括酚类化合物、芳香类化合物等[20],还包括难以氧化的非酚类物质,如多环芳香烃、有机磷农药、有机氯农药等[21]。由图2 可知,3 种培养基中的漆酶活性变化趋势相似,0 ~5 d 酶活性均快速升高,5 ~21 d 酶活性平缓升高,21 d 后酶活性明显下降。在0 ~10 d R-(-)-呋虫胺中生长的黑曲霉的漆酶活性值较其他培养基低,由1.111 U·mL-1上升至8.083 U·mL-1,在28 d 时降低到6.910 U·mL-1。这可能是培养初期,农药浓度较高,相较于呋虫胺其他对映体,R-(-)-呋虫胺对漆酶有明显抑制作用,随着菌株生长发育,培养基内农药被分解,农药浓度降低,R-(-)-呋虫胺对漆酶的抑制作用减弱。Rac-(±)-和S-(+)-呋虫胺培养基中的漆酶活性值变化趋势相似,Rac-(±)-呋虫胺中酶活性值先由1.573 U·mL-1上升至最大值7.867 U·mL-1,之后下降至7.126 U·mL-1。S-(+)-呋虫胺中酶活性初始值为2.499 U·mL-1,之后酶活性先上升后下降,在28 d 时降低至7.250 U·mL-1。
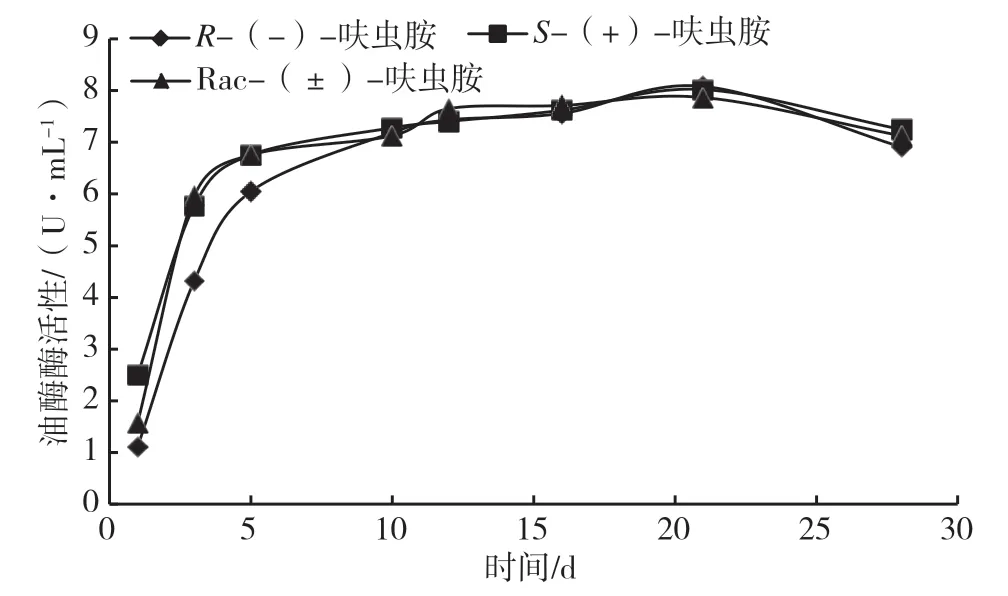
图2 不同培养基中黑曲霉的漆酶酶活性图
2.3 糖基转移酶酶活性分析
糖基转移酶(Glycosyltransferases,GTs)可将单糖共价连接到多种有机底物上,参与生命体内的糖代谢和糖基化反应,其催化底物包括糖、蛋白质、脂质等[22-23]。现有研究表明,GTs 在真菌细胞壁的合成中起到至关重要的作用,葡聚糖是细胞壁的重要组成部分,在葡聚糖合成过程中GTs 可通过对其结构的修饰,影响真菌细胞壁的结构和功能[24]。由图3 可知,Rac-(±)-呋虫中的黑曲霉GTs 酶活性值大体上高于S-(+)-和R-(-)-呋虫胺培养基中的GTs 酶活性值。在黑曲霉生长发育前中期,需要大量分泌GTs,参与细胞体内新陈代谢、细胞壁合成,因此酶活性明显上升。后期菌株生长繁殖减弱,新陈代谢减弱,酶活性逐渐降低。S-(+)-和R-(-)-呋虫胺培养基中,酶活性均在5 ~12 d 大幅增长,12 ~28 d 数值浮动较小,酶活性最大值分别为649.4 U·mL-1及631.2 U·mL-1,28 d 时酶活性分别为631.2 U·mL-1和608.4 U·mL-1。Rac-(±)-呋虫胺中GTs 酶活性值经历了两个大幅上升的阶段,0 ~5 d 其浮动较小,5 ~12 d 酶活性值攀升至650.9 U·mL-1,16 ~21 d 酶活性上升至最高点871.2 U·mL-1,28 d 时酶活性下降至748.8 U·mL-1。这可能是因为呋虫胺不同对映体对GTs 均有抑制作用,随着农药被分解,农药浓度下降,Rac-(±)-呋虫胺抑制作用较另外两个对映体明显减弱,酶活性上升。
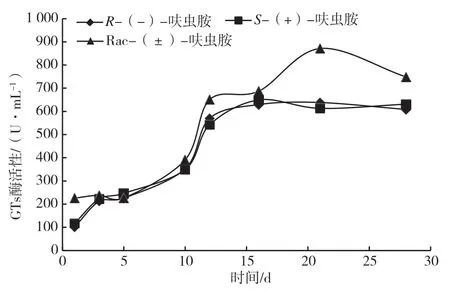
图3 不同培养基中黑曲霉的GTs 酶活性图
2.4 丙二酰基转移酶活性分析
丙二酰基转移酶(Malonyl Transferase,MAT)是细胞新陈代谢的关键酶类,其参与了脂肪酸的合成代谢,参与合成TAC 所需的乙酰辅酶A[25]。由图4 可知,在28 d 培养周期中,R-(-)-、S-(+)-和Rac-(±)-呋虫胺培养基的MAT 活性值变化趋势一致,无明显差异,均平稳上升,在16 d 后趋于平稳,维持在200 U·mL-1左右。

图4 不同培养基中黑曲霉的MAT 酶活性图
这可能因为MAT 参与了菌株的营养物质利用,黑曲霉菌株在液体培养基中的前中期生物量逐渐增大,能够通过分泌更多的酶类,加快有机质的降解,MAT 酶活性也随之呈上升趋势。后期随着培养基内营养物质的减少,菌丝生长速度开始下降,酶活性随之趋于平缓。MAT 酶活性在一定程度上可反映菌株活力。
3 结论
对普洱茶优势菌种黑曲霉进行分离纯化,分别接种于喷洒了R-(-)-呋虫胺、S-(+)-呋虫胺和呋虫胺外消旋体(Rac-(±)-呋虫胺)的培养基中进行培养,并测定不同时间不同培养基中黑曲霉在生长发育过程中的几种新陈代谢关键生物酶活性。结果表明,呋虫胺对映体对漆酶活性抑制作用的排序为R-(-)-呋虫胺>S-(+)-呋虫胺、Rac-(±)-呋虫胺,对谷胱甘肽S-转移酶抑制作用的排序为S-(+)-呋虫胺、Rac-(±)-呋虫胺>R-(-)-呋虫胺;对糖基转移酶抑制作用的排序为S-(+)-呋虫胺、R-(-)-呋虫胺>Rac-(±)-呋虫胺;对丙二酰基转移酶的抑制作用,R-(-)-呋虫胺、S-(+)-呋虫胺和Rac-(±)-呋虫胺无明显区别。呋虫胺不同对映体对同种酶活性影响存在差异性,下一步可进行呋虫胺不同对映体在不同酶条件下的降解情况及降解机制的深入研究。手性农药不同异构体对普洱茶中微生物及酶的影响有重要的意义,可为普洱茶安全评价和手性农药残留降解提供新的思路。
