过硫酸钾氧化降解呋虫胺的动力学研究
2016-09-05刘礼涛郑立庆
刘礼涛,郭 丽,郑立庆
(1. 新乡市环境保护监测站,河南 新乡 453000;2. 河南省环境监测中心,河南 郑州 450004;3. 河南师范大学 环境学院,河南 新乡 453000)
过硫酸钾氧化降解呋虫胺的动力学研究
刘礼涛1*,郭 丽2,郑立庆3
(1. 新乡市环境保护监测站,河南 新乡 453000;2. 河南省环境监测中心,河南 郑州 450004;3. 河南师范大学 环境学院,河南 新乡 453000)
采用热活化过硫酸钾的方法氧化降解呋虫胺废水,通过高效液相色谱仪检测其残留浓度,探讨过硫酸钾降解呋虫胺的反应动力学。结果表明,呋虫胺的氧化降解符合一级动力学模型,随着温度的升高和氧化剂浓度的升高其降解速率逐渐增加。在pH值=8.0、温度为70℃、过硫酸钾浓度为10 mmol/L时,呋虫胺的降解反应速率常数k为0.0303 min-1,半衰期(t1/2)为22.8761 min。呋虫胺降解的反应活化能Ea=133.489kJ/mol。
过硫酸钾;呋虫胺;动力学
1 实验部分
1.1 试剂与仪器
试剂:呋虫胺(湖北康宝泰精细化工有限公司,纯度95.8%,经重结晶提纯后使用),过硫酸钾(天津市化学试剂三厂,分析纯),H2SO4(洛阳昊华化学试剂有限公司,含量95%~98%),KOH(国药集团化学试剂有限公司,分析纯),KHCO3(天津大茂化学试剂厂,分析纯),KCl(汕头金砂化工厂,分析纯),乙醇(国药集团化学试剂有限公司,分析纯),叔丁醇(中国医药公司北京试剂站,分析纯)。
设备:Waters高效液相色谱仪(2998PDAD检测器,1525泵),色谱柱C18(4.6×150 mm,5 μm,USA),Milli-Q Reference 纯水系统(Millipore,USA),DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司),pHS-5型酸度计(杭州奥利龙仪器有限公司),CP214型电子天平(奥豪斯仪器上海有限公司)。
1.2 实验方法
反应体积为100 mL,呋虫胺初始浓度为100 mg/L。加入过硫酸钾后用KOH或H2SO4调节溶液pH,置于恒温水浴锅中,并开始计时,每隔一段时间,取5 mL样品立刻用冷水稀释至25 mL,终止反应,用HPLC分析样品中呋虫胺的残留浓度。
1.3 分析方法
样品中的呋虫胺用Waters高效液相色谱仪(HPLC)进行分析。具体条件为:流动相为甲醇(60%)和水(40%);检测波长为270 nm;流速为1 mL/min;进样量为20 μL;柱温为30 ℃,停留时间为2.6 min。如图1所示呋虫胺的标准曲线,根据所测的峰面积及呋虫胺标准曲线求各个时间点呋虫胺的浓度。

图1 呋虫胺的标准曲线
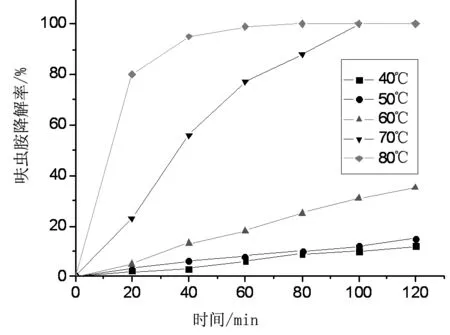
图2 不同温度对呋虫胺降解率的影响
2 结果与讨论
2.1 温度对呋虫胺降解率的影响
实验模拟呋虫胺废水的初始浓度为100 mg/L,过硫酸钾浓度固定为10 mmo/L,溶液初始pH值=8.0,控制实验的温度为40~80 ℃。
实验结果如图2所示。在不同温度条件下分别对反应进行动力学方程拟合,发现在各温度下,反应对一级动力学方程的拟合度最高,故热活化过硫酸钾降解呋虫胺的反应符合一级动力学反应规律。

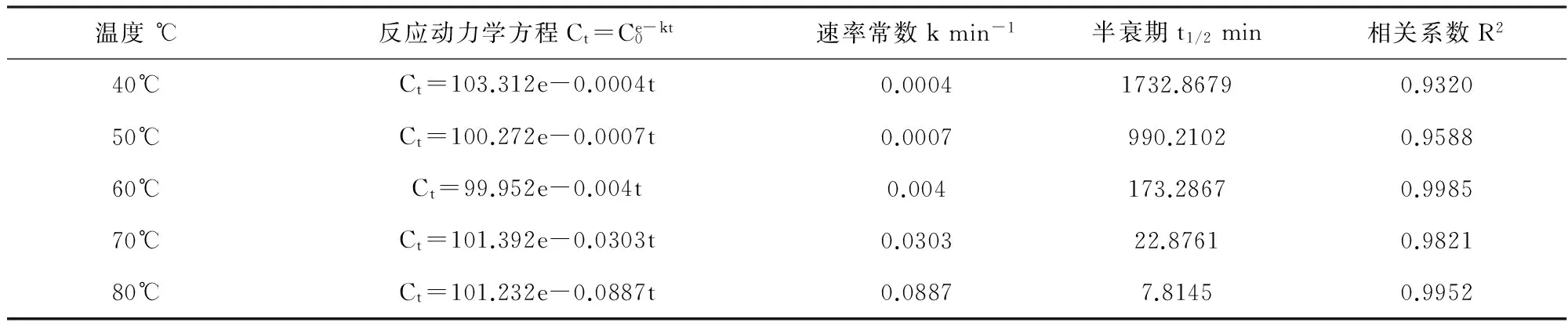
表1 不同温度下呋虫胺的降解动力学
2.2 过硫酸钾浓度对降解的影响
实验模拟呋虫胺废水的初始浓度为100 mg/L,添加不同浓度的的过硫酸钾,调整溶液初始pH值=8.0,控制实验的温度为70 ℃。实验结果如图3所示,过硫酸盐的浓度显著影响了呋虫胺的降解速率,呋虫胺的降解速率随着过硫酸钾浓度的升高而加快。当过硫酸钾浓度为2 mmol/L时,呋虫胺在60 min时的降解率仅仅达到13.78%;当过硫酸钾浓度增大到50 mmol/L时,呋虫胺在40 min时几乎已被完全降解。对数据进行分析可知,添加不同浓度的过硫酸钾时,呋虫胺的降解动态均符合一级动力学方程。由此可得到当温度为70 ℃时,呋虫胺在不同浓度的过硫酸钾条件下的降解动力学,具体数据如表2所示。当过硫酸钾浓度分别为2、4、6、8、10、25和50 mmol/L时,呋虫胺的水解半衰期分别是173.28、90.02、77.01、45.00、22.87、9.39和6.62 min。

表2 呋虫胺在不同浓度的过硫酸钾条件下的水解动力学
2.3 pH对降解的影响

表3 不同pH条件下过硫酸钾降解呋虫胺的反应动力学
实验模拟呋虫胺废水的初始浓度为100 mg/L,过硫酸钾浓度固定为10 mmo/L,调节溶液初始pH值分别为2.0、4.0、6.0、8.0、10.0、12.0,控制实验的温度为70 ℃。实验结果如图所示,在60 min时,呋虫胺在不同pH条件下的降解率达到了60.4%~72.6%,由表3可知,呋虫胺降解的半衰期为25.7675~31.7957 min,反应速率常数也比较接近,由此可以看出pH对于热活化过硫酸钾降解呋虫胺的影响很小,这与王诗宗在用过硫酸钾去除三氯乙烯(TCE)时[13]的结果类似,同时也表明了热活化过硫酸钾的方法可应用于广泛的pH环境下,这对于该方法的实际应用提供了理论依据。

图3 不同浓度的过硫酸钾对呋虫胺降解的影响
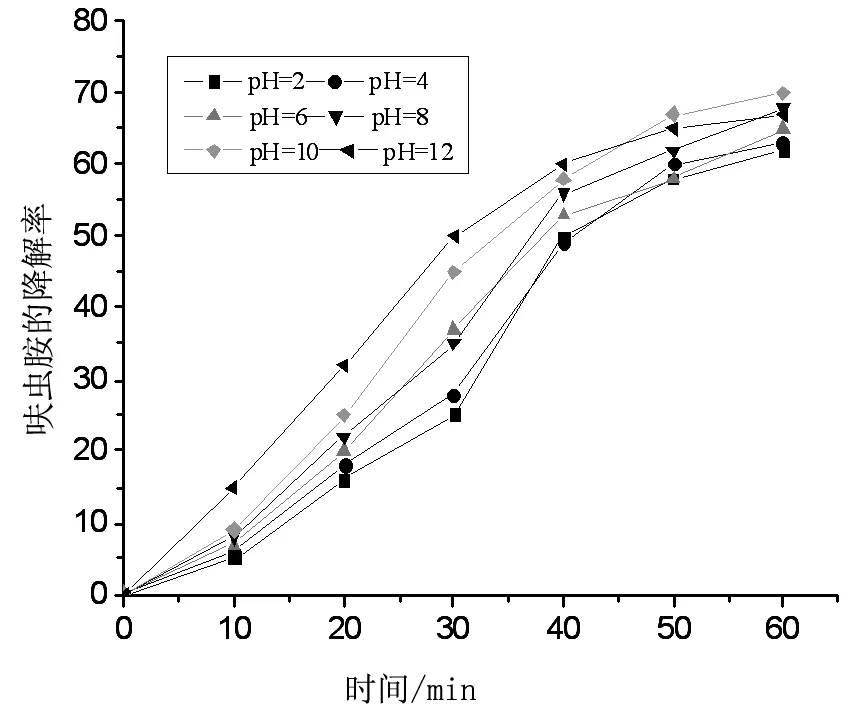
图4 pH对过硫酸钾降解呋虫胺的影响
3 结论
本文采用过硫酸钾的方法氧化降解呋虫胺废水,通过高效液相色谱仪检测其残留浓度,同时探讨过硫酸钾降解呋虫胺的反应动力学。实验发现,过硫酸钾降解呋虫胺的反应符合一级动力学方程,升高温度时呋虫胺的降解显著加快;同时,增加过硫酸钾的浓度,有利于呋虫胺的降解;pH对过硫酸钾氧化降解呋虫胺的影响较小,中性环境更利于降解。
[1] 刘安昌,张 良,谭珍友,等. 新型烟碱类杀虫剂呋虫胺的合成研究 [J].世界农药, 2009,31(2):22-23.
[2] 戴炜锷,蒋富国,程志明. 第三代烟碱类杀虫剂呋虫胺的合成 [J].现代农药,2008,7(6):12-24.
[3] Takeo Wakita. Molecular design of dinotefuran with unique insecticida proterties[J].J Agric Food Chem,2011, 59:2938-2942.
[4] Nauen R,Kintscher U E,Salgado V L,et al. Thiamethoxam is a neonicotinoid percursor converted toclothianidin in insects and plants [J]. Pestic Biochem Physiol,2003,76:55-69.
[5] Watanabe E,Baba K , Miyake S. Analytical evaluation of enzyme-linked immunosorbent assay for neonicotinoid dinotefuran for potential application toquick and simple screening method in rece samples [J]. Talanta,2011,84:1107-1111.
[6] 张磊磊. 呋虫胺的水解和光化学降解研究[D]. 新乡:河南师范大学,2014.
[7] Bennedsen L R,Muff J, Sogaard E G. Influence of chloride and carbonates on the reactivity of activated persulfate [J]. Chemosphere,2012,86 (11):1092-1097.
[8] Ghauch A,Tuqan A M. Oxidation of bisoprolol in heated persulfate/H2O systems:kinetics and products [J]. Chem Eng J,2012,197:483-492.
[9] Kambhu A,Comfort S,Chokejaroenrat C,et al. Developing slow-release persulfate candles to treat BTEX contaminated groundwater [J]. Chemosphere,2012,89 (6):656-664.
[10] Fang J Y,Shang C. Bromate formation from bromide oxidation by the UV/Persulfate process [J]. Environ Sci Technol, 2012,46 (16):8976-8983.
[11] Huang K C,Couttenye R A,Hoag G E. Kinetics of heat-assisted persulfate xiodation of methyl tert-butyl ether(MTBE) [J]. Chemosphere,2002,49 (4):413-420.
[12] Niu C G,Wang Y, Zhang X G,et al . Decolorization of an azodye Orange G in microbial fuel cells using Fe(II)-EDTA catalyzed persulfate [J]. Bioresource Technol,2012,126:101-106.
[13] 王诗宗,杨 琦,田 璐. 过硫酸钾去除水中的TCE [J]. 环境工程学报,2013,17(1):31-36.
(本文文献格式:刘礼涛,郭 丽,郑立庆.过硫酸钾氧化降解呋虫胺的动力学研究[J].山东化工,2016,45(12):25-27,30.)
Kinetics Study on Oxidative Degradation of Dinotefuran by Potassium Persulfate
Liu Litao1*, Guo Li2,Zheng Liqing3
(1.Xinxiang Environmental Protection Monitoring Station, Xinxiang 453000,China;2.Henan Province Environmental Monitoring Center, Zhengzhou 450004,China;3.Henan Normal University Environmental College, Xinxiang 453000,China)
In this paper, dinotefuran has been degraded by thermal activation of potassium sulfate method in waste water. The residual concentration of dinotefuran is determined by high performance liquid chromatography, moreover the reaction kinetics of dinotefuran is explored. The results show that the oxidative degradation of dinotefuran conforms to the first-order kinetic model, and the degradation rate increases gradually with temperature and oxidant concentration increased. Under pH 8.0, the reaction temperature of 70℃ and potassium sulfate concentration of 10 mmol/L, the rate constant k of dinotefuran degradation reaction is 0.0303 min-1and half-life (t1/2) is 22.8761 min. The reaction activation energy of dinotefuran degradation is 133.489kJ/mol.
potassium persulfate;dinotefuran; kinetics
2016-04-25
刘礼涛(1983—),河南郑州人,硕士研究生,新乡市环境保护监测站工作,主要从事环境监测和药物分析研究
X703
A
1008-021X(2016)12-0025-03
