微生物检测实验室环境菌库的建立及分析
2024-03-15周阿容林梦丹揭小玲郑孝贤王海龙方东升
◎ 詹 清,周阿容,林梦丹,揭小玲,郑孝贤,王海龙,方东升
(福建省微生物研究所,福建 福州 350007)
微生物检测实验室是否能避免潜在生物污染是其质量评估的重要指标之一[1],一旦检测环境发生微生物污染可能会造成检测结果不准确,检测机构在检出样品微生物超标或致病微生物污染时往往出现溯源难、应变慢等问题,因此检测机构应监测、控制环境条件,最大限度地降低微生物污染以保证检测结果的准确性[2]。王似锦等[3]提出了环境分离菌更能够反映样品或环境实际存在微生物的情况,利用环境分离菌可使检测结果对样品质量做出更客观和科学的评价。因此了解微生物检测环境的微生物负载情况,建立检测环境的微生物信息库,构建环境微生物分布图,对于检测机构排除实验过程中的污染隐患、减少假阳性微生物干扰和提高检测结果公信力具有重要意义[4]。目前,国内对药品生产和检验环境建立环境菌库方面的研究较多。例如,刘亚茹等[5]采用分子生物学鉴定方法对5 家制药企业洁净区微生物群落进行鉴定和分析,但在微生物检测实验室建立环境微生物菌库的研究相对较少。
本研究通过采集福建省微生物研究所(以下简称研究所)分析测试中心微生物检测实验室的环境微生物,结合微生物形态学特征与分子生物学技术对微生物进行鉴定和分类,初步构建了研究所分析测试中心微生物检测实验室的环境菌株信息库,为今后本实验室检测结果的溯源提供了方向,对检测实验室的污染控制和风险评估具有重要意义。
1 材料与方法
1.1 材料
胰酪胨大豆琼脂培养基、葡萄糖沙氏琼脂培养基(广东省环凯微生物科技有限公司);PCR 引物、2×TaqPCR Master Mix(生工生物工程股份有限公司);TSINGKE 植物DNA 提取试剂盒(通用型,货号:TSP 101,擎科生物科技有限公司)。
细菌采用16S rDNA 通用引物27 F 和1492 R,真菌采用引物ITS 1 和ITS 4,以上引物均购于生工生物工程股份有限公司,引物序列见表1。

表1 引物序列表
1.2 仪器
FKC-III 浮游菌采样器(苏州苏净仪器自控设备有限公司);PCR 仪(Biometra);电泳仪(上海百赛生物技术有限公司);HVE-50 高压蒸灭菌锅(HIRAYAMA);MIR-154-PC 低温恒温培养箱(松下健康医疗器械株式会社);CX 31 生物显微(OLYMPUS);NVT 6201ZH 电子天平[奥豪斯仪器(常州)有限公司];SW-CJ-1CU 洁净工作台(苏净集团苏州安泰空气技术有限公司)。
1.3 试验方法
1.3.1 采样与培养
依据《医药工业洁净室(区)浮游菌的测试方法》(GB/T 16293—2010)和《医药工业洁净室(区)沉降菌的测试方法》(GB/T 16294—2010)[6-7]布置采样点,连续12 个月对微生物检测实验室的不同部位和检测人员,分别通过浮游菌采样器法(采集环境浮游微生物)、空气沉降法(采集环境沉降微生物)和接触碟取样法(采集检测人员携带微生物)进行样本采集。采集完成后将样本置于 37 ℃和28 ℃恒温培养箱中,分别培养48 h 和5 d。
1.3.2 分离纯化
用无菌接种环挑取平板中非真菌菌落至TSA 平板,真菌菌落至SDA 平板分别进行两次以上平板划线分离纯化。
1.3.3 微生物鉴定
分离的微生物经纯化后进行革兰氏染色涂片镜检,初步判断所得菌株类型后采用分子生物学方法对菌株进行鉴定。
(1)基因组提取。用接种环取一环细菌,用50 μL双蒸水悬浮成液,振荡混匀后,放置在PCR 仪中,99 ℃加热15 min;6 000 r·min-1离心10 min 后取上清液,作为后续PCR 反应体系的DNA 模板。依据TSINGK 植物DNA 提取试剂盒(通用型)产品说明书提取真菌基因组。
(2)PCR 反应体系。DNA 模板5 μL,正反引物各2 μL,2×TaqPCR Master Mix 25 μL,用双蒸水补齐体系至50 μL。
(3)PCR 反应条件。95 ℃预变性,5 min;95 ℃变性,30 s;55 ℃退火,30 s;72 ℃延伸,1 min;循环35 次;72 ℃后延伸,10 min;10 ℃暂存。
(4)扩增产物测序及比对。将扩增产物进行琼脂糖凝胶电泳,选取电泳结果中条带单一、明亮的扩增产物送往铂尚生物股份有限公司进行测序,将测序序列结果在NCBI 网站上进行Blast 同源性比对,取同源性在98.65%以上的结果作为比对结果[8]。
2 结果与分析
2.1 环境微生物分布
2.1.1 时间分布情况
本研究连续12 个月对微生物检测实验室不同部位和检测人员进行了样本采集,每个月采集的菌株数如图1 所示。其中第一季度平均采集到73 株菌,第二季度平均采集到103 株菌,第三季度平均采集到98 株菌,第四季度平均采集到88 株菌。

图1 不同时间收集菌株数统计图
2.1.2 区域分布情况
通过连续12 个月的样本采集发现,不同月份的环境菌数量有所不同,但是种类并无显著差别,9 月采集到的环境菌数量最多,共收集到109 株环境菌,详见表2。其中非受控区域共采集到58 株菌,占全部菌株的53.21%;洁净室共采集到36 株菌,占全部菌株的33.03%;从检测人员身上共采集到15 株菌,占全部菌株的13.76%。
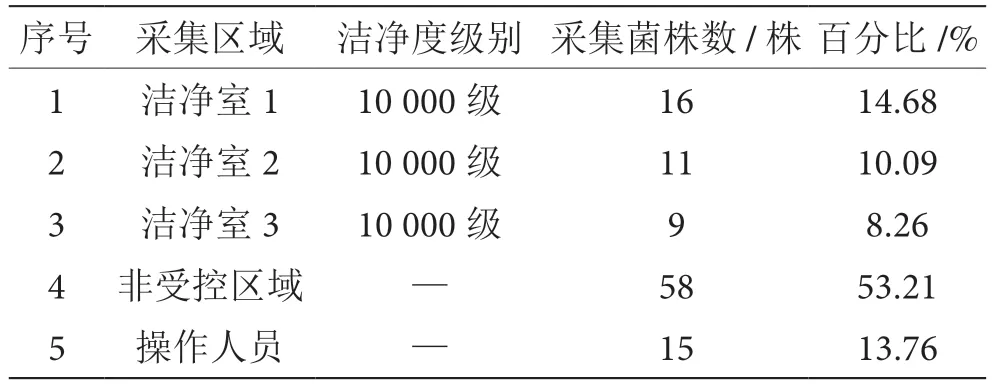
表2 9 月份样本采集各区域菌株分布情况表
2.2 菌株鉴定结果
结合微生物菌落形态和结构特征,对采集到的不同菌株进行16S rDNA 测序鉴定,根据鉴定结果将采集到的菌株分为7 个属,其中数量最多的葡萄球菌属占37.61%,芽孢杆菌属和微球菌属分别占24.77%和13.76%。详见表3。

表3 分离菌株的菌属分布及数量表
2.3 环境菌信息库的建立
根据采集到环境菌的培养特性、形态结构以及测序比对结果,将收集到的环境微生物进行归纳总结,详见表4。
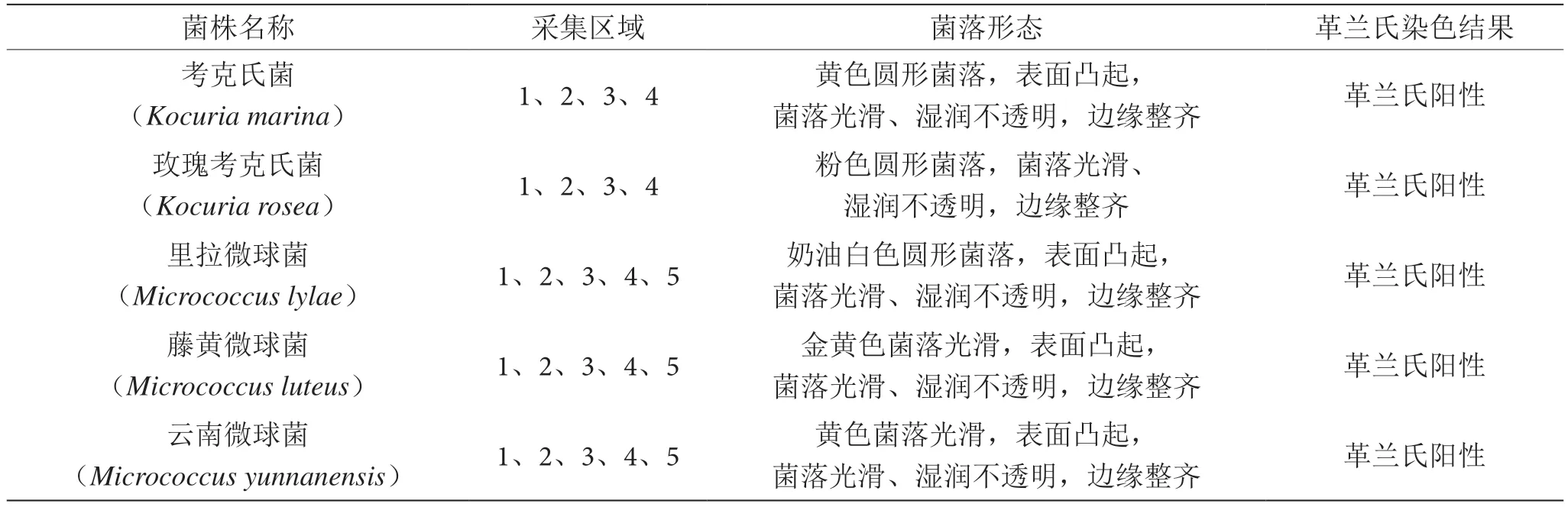
表4 环境菌信息统计表
3 结论与讨论
从连续12 个月采集获得菌株的结果分析,3—4 月采集获得的真菌数量较多,经分析认为,3—4 月为当地的梅雨季节,自然环境空气湿度较高,检测实验室环境湿度高于设定的限值,容易导致真菌繁殖,主要为曲霉菌属和青霉菌属,这两类真菌均能产生孢子,能在室内空气和灰尘中存活。因此在每年湿度较高的季节应注意控制洁净室的湿度,同时增加洁净室清洁消毒的频率,及时清洁与更换洁净区空气过滤器。9—10 月检测人员进出洁净室较为频繁,采集获得的细菌数量也较多,容易在人类皮肤上栖居的微生物,如葡萄球菌属和微球菌属在多个采样点均有发现,分析可能是由于检测人员的频繁活动或接触造成的污染。这也表明,检测人员身上容易携带的微生物是微生物检测实验室环境菌的主要来源之一,这与国内外相关报道基本一致[9-11]。因此,为降低人为污染的风险,应严格控制洁净区人员数量,强化检测人员的无菌意识,避免过多接触物料,规范进入洁净区的人员操作和清洁程序,同时在检测活动频繁时要及时制定更高频率的清洁消毒程序。从采集获得菌株的结果分析得知,检测环境中还存在多种芽孢杆菌,可选择消杀效能高的消毒剂,从而达到控制潜在污染微生物的风险。本研究通过连续12 个月对实验室不同部位进行采样收集,初步建立了研究所微生物检测实验室的环境菌库,但是建立环境菌库是一个动态管理的过程,后期需要进行日常监测追踪,不断更新和完善环境菌库溯源体系,当出现趋势变化或异常情况应及时采取有效整改措施。
