硅芯片纳米微流体技术与磁激活细胞分选法对胎儿有核红细胞富集效果的比较
2024-03-14杨晓樨赵营营马吉芳于政
杨晓樨 赵营营 马吉芳 于政
1辽阳市中心医院检验科,辽宁辽阳 111000;2陆军第79集团军医院检验科,辽宁盘锦 111000
近年来,随着“三孩”政策的实施,高龄孕妇数量不断增加,加上环境污染、饮食、生活习惯等因素的影响,新生儿出生缺陷的种类逐渐增多,且发生率不断上升,给家庭及社会带来了巨大的负担[1-2]。因此,对具有高危因素的胎儿进行产前筛查,及时发现严重致残、致死性疾病,适时终止妊娠对确保孕妇及胎儿安全,降低新生儿出生缺陷发生风险,减轻家庭及社会负担具有重要意义。传统有创产前诊断可通过羊水、脐带血穿刺、绒毛活检等侵入性方法获取胎儿遗传物质进行遗传分析,虽有较高的准确度,但这些手段均会对孕妇与胎儿产生一定损伤,增加感染、胎儿流产、早产等不良事件发生风险[3-5]。在此背景下,无创产前诊断逐渐成为国内外各研究团队的研究热点。胎儿有核红细胞(fetal nucleated red blood cells,FNRBC)被认为是用于无创产前检测的最佳胎源性细胞,含有胎儿全部的基因组,可自孕妇孕早期至分娩前持续稳定地存在于母体外周血中,且生命周期较短,不易受既往妊娠的影响,能较好地诊断出胎儿患病及缺陷情况,且不会对母体及胎儿产生创伤,具有较高安全性[6-7]。另外,与目前广泛应用的胎儿游离DNA检测相比,FNRBC适用于所有循环DNA可诊断的疾病、基因组序列突变导致的遗传疾病及线粒体相关的遗传性疾病,且不易受母体遗传背景的干扰及限制性胎盘嵌合体的影响,可诊断的疾病范围更广,且可提高产前诊断结果的准确性,具有广阔的应用前景。但母体外周血中的FNRBC数量极少,必须对其进行良好的分离富集,获得足够数量的FNRBC才能用于无创产前诊断[8]。目前,FNRBC富集方法较多,包括硅芯片纳米微流体技术、磁激活细胞分选法等,但临床对于FNRBC的最佳富集手段尚无确切定论。因此,本研究分析硅芯片纳米微流体技术与磁激活细胞分选法对FNRBC的富集效果,为临床优化FNRBC富集方案提供参考。
材料与方法
1 研究对象
选取2020年1月—2022年12月拟于医院进行产前筛查的112例孕妇为研究对象,年龄20~45岁,平均(35.29±4.12)岁;孕周12~22周,平均(16.52±2.29)周;孕次1~6次,平均(3.13±1.48)次;产次0~2次,平均(1.19±0.73)次。纳入标准:①单胎妊娠,均于本院建档;②具有高龄或超声软指标2个及以上异常、既往存在不良孕产史等胎儿染色体异常危险因素或妊娠期高血压、胎儿宫内生长受限等可能引起胎盘源性疾病危险因素;③孕周<23周,且胎母输血量<0.5 mL;④孕妇及家属均知情同意。排除标准:①伴有恶性肿瘤;②近3个月内存在输血史或免疫治疗史;③入组前已进行过无创产前检查或羊水穿刺;④伴有白血病、严重缺铁性贫血等血液系统疾病。本研究符合《赫尔辛基医学研究宣言》中相关内容,并通过医院医学伦理委员会审核批准(伦审批号:2019041)。
2 实验材料及仪器
纳米硅芯片(苏州汶颢微流控技术股份有限公司)、一次性采血针(山东朱氏药业集团有限公司)、抗凝管(乌鲁木齐福新医疗器械有限公司)、恒温箱(山东博科科学仪器有限公司)、培养基(杭州创新生物检控技术有限公司)、离心机(西安铭朗医疗设备有限公司)、磁激活细胞分选器(德国美天旎生物技术有限公司)、CD71阳性免疫磁珠(德国美天旎生物技术有限公司)。
3 样本采集
所有孕妇采血前脉搏、体温等均在正常范围内。孕妇取坐位,选择上肢合适静脉位置作为穿刺点,对穿刺点进行常规皮肤消毒后,通过一次性采血针进行穿刺,分别采集外周肘静脉血10 mL于抗凝管中;采血完毕后轻轻上下颠倒采血管5~10次,确保血液与抗凝剂充分混匀后置于4 ℃冰箱保存,并在4 h内送至实验室,分别通过硅芯片纳米微流体技术与磁激活细胞分选法对FNRBC进行富集。采血过程中相关人员均全程进行无菌操作。
4 FNRBC富集
4.1 硅芯片纳米微流体技术
取备用抗凝血3 mL放置于离心管中,将与CD71抗体偶联的多功能磁性上转换纳米材料悬浮液(200 μg/mL)置于其中,放置于37℃的恒温箱中进行血液中FNRBC的第一阶段的捕获,捕获时间1 h,此时纳米材料会捕获到FNRBC及残存的非FNRBC,离心(离心时间5 min,离心速率800 r/min)去除未结合的纳米复合材料,并将所得细胞沉淀重新分散于2 mL磷酸盐缓冲液(phosphate buffer saline,PBS)中,将此细胞悬液装载于注射泵中,以恒定流速(1 mL/h)通过纳米硅芯片,并同时在芯片底部加上恒定磁场(3 800高斯),使FNRBC被牢牢捕获于腔室底部。再将捕获到的FNRBC通过洗脱的方法自纳米硅芯片上脱离下来,置于细胞培养皿中进行培养,而后将培养基(dulbecco's modified eagle medium,DMEM)细胞悬液移入FNRBC培养皿中,并将培养皿放置于含有5%二氧化碳的37℃恒温细胞培养箱中进行免疫黏附2 h,取出培养皿上下缓慢摇匀,室温下进行离心(离心时间5 min,离心速率800 r/min),去除上清液后收集细胞沉淀,并加入1 mL的DMEM细胞液重新悬浮细胞沉淀,轻轻吹打混匀后备用。
4.2 磁激活细胞分选法
①密度梯度离心:取孕妇备用抗凝血3 mL,用1×PBS进行1∶1稀释,轻轻吹打混匀后待用;准备1个新的15 mL离心管,取密度梯度离心液,用巴氏滴管在新的离心管中加入3 mL密度梯度离心液,将稀释后的6 mL血液标本缓慢置于密度梯度离心液上方(注意操作过程中血液标本与离心液应有明显界限,尽可能避免血液标本与密度梯度离心液混匀重叠),将离心管置于离心机内,于22℃温度下进行离心(离心时间30 min,离心速率1 500 r/min)操作。离心结束后,离心液与血液自上而下分别为红细胞与粒细胞混合层,密度梯度离心液、单个核细胞层及血浆层等,用巴氏滴管小心吸出单个核细胞层及其上下各约10 mm高度离心液置于新的15 mL离心管中;于离心管中加入PBS/0.1%牛血清白蛋白(bovine serum albumin,BSA)溶液至离心管口,旋紧离心管盖,轻轻颠倒混匀后进行2次洗涤离心(离心时间5 min,离心速率1 500 r/min),收集离心后的细胞沉淀置于新的离心管中;于细胞沉淀中加入PBS/0.1% BSA溶液共5 mL重新悬浮细胞,轻轻吹打混匀备用。②磁激活细胞分选:于备用的悬浮细胞中加入40 μL CD71阳性免疫磁珠,混匀后于4 ℃温度下避光孵育15~30 min。组装mini-磁激活细胞分选系统,以500 μL的PBS/0.1% BSA溶液润洗磁激活细胞分选系统筛选柱,待留空后,将筛选的细胞上柱,并在筛选柱中加入1 μL的PBS/0.1% BSA溶液,拿离磁场,冲洗入试管内,标记为阳性细胞。PBS/0.1% BSA溶液对细胞沉淀洗涤离心(离心时间5 min,离心速率1 500 r/min)2次后收集细胞沉淀(即为富集的FNRBC),并加入1 mL PBS/0.1% BSA溶液重新悬浮细胞沉淀,轻轻吹打混匀备用。
5 质量控制
所有研究人员均经过专业化培训,熟练掌握硅芯片纳米微流体技术、磁激活细胞分选法的原理、具体操作方法等内容,并在考核合格后参与到研究工作中。且FNRBC的分离与富集均符合《全血与成分血质量要求》[9]的要求,制备过程均在实验室无菌操作间实施,并严格执行无菌操作规范(如操作人员进入实验室应穿戴无菌服、鞋套、帽子、口罩、手套,并进行全身消毒,不随意进出实验室、避免操作台上放置与试验无关的物品、FNRBC富集操作开始前使用紫外线灯照射无菌操作台30~60 min灭菌等)。以上处理的血样均2 000 r/min离心20 min,分别小心吸取白膜状的单个核细胞层以及下层,共16个样本,收集入不同离心管内,分别加入氯化铵溶血溶液至10 mL,与细胞悬液混合,使红细胞溶解,用吸管将混合细胞溶液吹打2 min,然后静置10 min,1 000 r/min离心l0 min。倾去上清液,用PBS液重复洗涤1次,800 r/min离心8 min。溶红细胞后的细胞沉淀均用l mL PBS液混悬,移入离心管中,计数收集细胞量(流式分析需106个细胞)后800 r/min离心5 min,获得所需的细胞沉淀。将细胞沉淀用200 mL PBS液混悬,加入FITC标记的抗CD7l抗体3 mL和用PE标记的抗GPA抗体3 mL,避光37℃孵育30 min,1 mL PBS液洗涤细胞两次。采用FAc.Sort型流式细胞仪(BD公司)检测,每份标本分析检测5 000~l0 000个细胞。先以未加抗体的裸细胞调零,设定电压,再行待测标本测试。
6 评价指标
6.1 形态学观察
观察两种方法所获得的富集FNRBC染色情况。分别将富集前的备用血液样本及两种方法富集所获得的细胞悬液各100 μL滴于载玻片上,自然干燥1 h后用80%乙醇固定、水洗、室温晾干,然后放置于37℃的酸性缓冲液中保温10 min,再次水洗、室温晾干;使用苏木素染液中染白细胞,45 s后用流水冲洗2 min,再用伊红染液中染1 min,流水冲洗3 min,晾干后置于显微镜下观察富集前及不同方法富集后FNRBC形态。
6.2 细胞计数
比较两种FNRBC富集方法所获得的总细胞量、FNRBC量及FNRBC比例。具体操作方法为:将两种方法富集所获得的晾干后的细胞悬液载玻片放置于显微镜下观察,计数总细胞量及FNRBC量。FNRBC比例为染色后计数2 000个总的细胞中所含的阳性FNRBC细胞数。
6.3 FNRBC富集时间
记录两组FNRBC富集所需时间。
6.4 无菌试验结果
取两种方法所获得的细胞悬液各10 μL,采用全自动细菌培养仪进行细菌培养,记录两组细菌培养阳性发生情况。
7 统计学方法
采用SPSS25.0软件处理数据,计量资料均经Shapiro-Wilk正态性检验,符合正态分布以表示,组间比较用配对样本t检验;计数资料用n和%表示,采用χ2检验,若期望值<5,行Fisher确切概率法检验;双侧检验水准α=0.05。
结 果
1 形态学
富集前,显微镜下可见FNRBC呈圆形或椭圆形,核圆形深染,胞质红色深染,并可见大量散在的混杂细胞;磁激活细胞分选法富集后可见混杂细胞有所减少,但仍有一定混杂细胞总量,FNRBC散在其中;硅芯片纳米微流体技术富集后可见视野中未见明显的混杂细胞残留,能明显见到FNRBC,且FNRBC比例有所上升。见图1。

图1 外周血FNRBC富集前、后苏木素-伊红染色结果(×400)
2 细胞计数
硅芯片纳米微流体技术进行FNRBC富集时所得的总细胞量较磁激活细胞分选法少,FNRBC量较磁激活细胞分选法多,FNRBC比例较磁激活细胞分选法高,差异有统计学意义(P<0.05)。见表1。
表1 两种方案的细胞计数结果对比()

表1 两种方案的细胞计数结果对比()
方案例数总细胞量(×107个/mL)FNRBC量(个/mL)FNRBC比例(×10-4)硅芯片纳米微流体技术1120.99±0.2937.52±4.040.20±0.05磁激活细胞分选法1121.99±0.2118.23±2.180.10±0.05 t 29.92845.65013.565 P<0.001<0.001<0.001
3 FNRBC富集时间及无菌试验结果
硅芯片纳米微流体技术对FNRBC的富集时间长于磁激活细胞分选法,差异有统计学意义(P<0.05);两种方案的无菌试验阳性发生率比较,差异无统计学意义(P>0.05)。见表2。
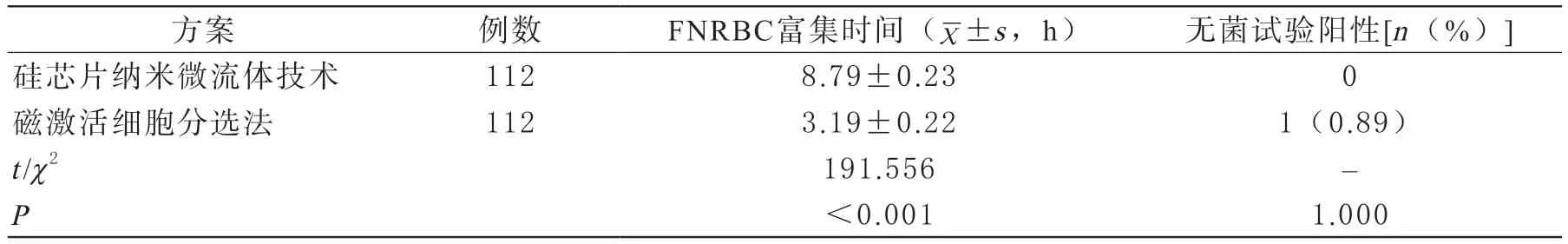
表2 两种方案FNRBC富集时间及无菌试验结果对比
讨 论
近年来,伴随着人口结构及疾病模式的转变,新生儿出生缺陷问题日益突出,已成为中国新生儿病死、儿童与成人残疾的主要原因之一[9-10]。产前诊断能够在孕妇妊娠期间对胚胎或胎儿先天畸形或遗传病等出生缺陷情况做出准确诊断,以便临床制定针对性预防措施,是降低新生儿出生缺陷的重要手段,也是优生优育的重要保障,其中无创产前诊断因其操作简单、安全可靠、筛查时间更早等优势应用较多[11-13]。目前,较多临床研究已经证实FNRBC不易受母体遗传背景的干扰及限制性胎盘嵌合体的影响,能准确反映胎儿各类遗传性疾病及生长缺陷情况,是用于无创产前诊断的最理想的靶细胞[14-16]。但有研究指出,通过FNRBC进行无创产前诊断时确保诊断结果准确的重要前提条件是足够数量的FNRBC[17]。因此,对孕妇外周血中FNRBC进行有效的分离、富集与纯化显得尤为必要。
硅芯片纳米微流体技术是在纳米电子微流硅芯片及微流体的作用下,将细胞依次滤过微通道,根据不同分选原理选择性捕获目标细胞的手段[18]。磁激活细胞分选法是将磁珠与单克隆抗体相结合后对细胞表面或细胞内的相对特异性抗原进行识别,并在外界磁场作用下将血液中带磁与不带磁的细胞分开,从而捕获目标细胞的手段[19]。上述两种方法在血液细胞捕获中均有较多应用,且具有较好的捕获效果。但目前较少有关于二者对孕妇外周血中FNRBC富集效果比较的相关研究报道。
本研究将硅芯片纳米微流体技术与磁激活细胞分选法分别用于FNRBC的富集中,结果发现,与磁激活细胞分选法相比,硅芯片纳米微流体技术去除混杂细胞的能力更强,且获得的FNRBC数量更多,对FNRBC的富集效果更好。分析原因在于,磁激活细胞分选法中首先通过密度梯度离心法对血液样本中的各成分细胞进行初步分离,通过分层液将FNRBC分开并收集,然后使用结合磁性颗粒的单克隆抗体CD71标记细胞,在外加磁场作用下将FNRBC进一步分离纯化,从而对FNRBC进行富集[20]。但文献报道,磁珠的大小对FNRBC的富集会产生一定影响。常规情况下所使用的磁珠粒径较大,比表面积较小,偶联容量较低,在富集FNRBC时对其的吸附能力较差,且多次离心操作存在引起细胞丢失或被破坏的风险,因此对FNRBC的富集数量较少[21]。且CHEN Y等[22]报道,磁激活细胞分选法难以彻底分离混杂细胞,所获得的总细胞量较多,但获得的FNRBC数量及纯度与其他方法相比均较低,本研究结果也与之相似。而硅芯片纳米微流体技术使用纳米硅芯片对FNRBC进行富集,结合特异性抗体修饰的纳米芯片直径较小,比表面积较大,对FNRBC的吸附能力与捕获效率相对较高,因此得到的FNRBC数量较多,对FNRBC的富集效果较好[23]。其次,纳米硅芯片上微流体通道的几何形状与目标FNRBC的大小与形状高度匹配,能够精准控制细胞流体,去除其他混杂细胞,减少捕获的总细胞量,提高获得的FNRBC比例[24]。周俊等[25]研究也指出,硅芯片纳米微流体技术两次捕获的FNRBC数量分别为(20.6±6.1)、(20.4±5.8)个/mL,明显高于既往其他方法所捕获的FNRBC数量,且相较于其他方法,硅芯片纳米微流体技术对FNRBC的富集效果更好,本研究结果也与上述研究结果相似。另外,谢建生等[26]发现,只要能够富集20个/mL及以上的FNRBC,通过巢式变异的聚合酶链反应基本能够得到扩增产物,满足后续产前诊断要求。而本研究中硅芯片纳米微流体技术两次捕获的FNRBC总量(37.52±4.04)个/mL虽略低于周俊等研究中两次捕获的FNRBC总量,但与HUANG等[27]研究中37.7个/mL的FNRBC数量相似,满足产前诊断所需FNRBC数量,而磁激活细胞分选法所富集的FNRBC总量(18.23±2.18)个/mL略低于20个/mL,可能会影响产前诊断准确性。由此可以看出,本研究中采用的硅芯片纳米微流体技术所富集的FNRBC数量对临床准确进行产前诊断更有价值。
本研究还发现,硅芯片纳米微流体技术对FNRBC的富集时间长于磁激活细胞分选法,两种方案的无菌试验阳性发生率无明显差异,提示两种方法富集FNRBC时均有较高的安全性,但与磁激活细胞分选法相比,硅芯片纳米微流体技术富集FNRBC的耗时较长。分析原因可能为,两种方法均全程在无菌环境中进行操作,且对操作人员的要求较高,因此获得的FNRBC受污染的风险较小。在FNRBC富集过程中,硅芯片纳米微流体技术需对FNRBC进行两次捕获,且捕获后的FNRBC还需在培养基中通过免疫黏附法进行进一步纯化,因此耗时较长。而磁激活细胞分选法对血液样本的离心时间及使用免疫磁珠吸附的时间均较短,收集的FNRBC沉淀仅需再次短时间离心进行纯化,因此总体耗时相对较短。
磁激活细胞分选法、硅芯片纳米微流体技术均是目前主要研究的FNRBC富集技术,前者在分选过程中存在的非特异性吸附会直接导致FNRBC的损失,且难以同时分选多个抗原标记的多种细胞群,应用相对局限。本研究结果证实,相较于磁激活细胞分选法,硅芯片纳米微流体技术或许更具研究价值,但值得注意的是,硅芯片纳米微流体技术仪器设备昂贵、技术复杂,对技术人员操作的要求较高,且检查费用较高,应用也有局限。但对于胎母输血量较小的孕妇来说,常规分离与富集技术无法富集足量FNRBC,而硅芯片纳米微流体技术可富集更多的FNRBC以满足后续产前诊断要求,增加产前诊断准确性。
综上所述,硅芯片纳米微流体技术与磁激活细胞分选法进行FNRBC富集所得样本受污染风险均较低,与磁激活细胞分选法相比,硅芯片纳米微流体技术去除混杂细胞的能力较强,且获得的FNRBC数量较多,对FNRBC的富集效果较好,但所需时间较长。
利益冲突所有作者均声明不存在利益冲突
