三江源区高寒草原退化对不同生长期土壤真菌群落的影响
2024-03-14杨明新陈科宇李成先黄青东智
杨明新,陈科宇,李成先,黄青东智,张 静,谷 强
(1.北京林业大学草业与草原学院, 北京 100089;2.中国地质调查局西宁自然资源综合调查中心, 青海 西宁 810000)
草地生态系统是我国面积最大的陆地生态系统类型,提供了重要的生态系统服务功能,如水源涵养、生物多样性维持、牧草生产、文化传承、地方和区域的旅游和休闲等[1-3]。但由于20 世纪对草地的不合理利用和过度开发加之全球气候变化的影响,我国大面积草原处于退化状态[4]。草地退化的主要表现为植被盖度和生产力下降、毒杂草比例增加,生态环境加速恶化,生物多样性减少,草地生态系统可提供的多种服务功能减弱,最终威胁区域生态安全[5-6]。草地退化不仅表现为植被群落的退化,土壤与土壤生物群落也会发生同步变化,并影响草地生态系统物质循环和能量流动过程[7-9]。因此,探究草地退化过程中土壤生物群落的变化规律,对于阐明退化对草地生态过程的影响,提高修复治理效率具有重要意义。
土壤微生物群落是陆地生态系统重要生态过程的主要驱动力,特别是土壤真菌群落在凋落物分解过程中发挥着重要作用[10]。但在草地退化过程中,由于植物群落和土壤环境的强烈变化,土壤真菌群落组成、结构和多样性通常在一定程度上发生改变,进而影响其群落功能及相关生态过程[11]。隋心等[12]在东北三江平原的研究表明,草甸退化显著改变了真菌群落的组成和多样性,并可能增强土壤中碳的释放。蔡晓布等[13]研究表明,草地退化会导致土壤真菌数量显著下降,进而影响土壤微生物碳氮含量和脲酶、磷酸酶活性。金志薇等[8]研究表明,草地退化后土壤微生物群落丰度显著降低,并且明显改变微生物群落结构。Luo 等[14]研究发现,草地退化降低了土壤真菌群落的复杂性以及生态系统的多功能性。此外,土壤真菌群落具有一定季节性,群落结构和多样性会随时间变化而发生改变[15]。Ullah 等[16]研究表明,季节变化导致的土壤真菌群落改变会影响相关酶的分泌,进而影响土壤碳循环过程。然而,目前鲜有研究关注草地退化对不同生长期土壤真菌群落的影响,限制了草地退化对土壤真菌群落生态过程影响的认识,特别是在草地退化风险较高的青藏高原地区。
青藏高原是世界上面积最大、海拔最高的单一地貌单元,被誉为“亚洲水塔”。而位于青藏高原腹地的三江源地区是我国重要河流上游的关键区,每年向下游供水约200 亿m3,是我国影响力最大的生态调节区之一[17]。高寒草原作为三江源区内主要生态类型之一,受全球气候变化和人类活动的综合影响,草原退化现象普遍,严重威胁区域生态安全[18-19]。因此,本研究以三江区高寒草原为研究对象,通过野外调查和高通量测序相结合,探究不同生长期草地退化对三江源区高寒草原土壤真菌群落的影响及其驱动因素,为预测草地退化对生态系统过程的影响提供数据支撑,同时为针对性制定土壤群落恢复治理措施提供科学依据。
1 材料与方法
1.1 研究区域概况
本研究区位于青海省三江源国家公园黄河源园区(97°01′20″~99°14′57″ E,33°55′05″~35°28′15″ N,平均海拔4 500 m)。区域内是典型的高原大陆性气候,具有冷暖交替、旱雨交替的特点,年均降水量303 mm,年均温-4 ℃。高寒草原是该区域主要草地类型之一,主要优势植物种为紫花针茅 (Stipapurpurea),常见伴生植物种有草地早熟禾 (Poa pratensis)、二裂委陵菜 (Potentilla bifurca)、多裂委陵菜 (P.multifida)、黑褐苔草 (Carex atrofusca)等。在20 世纪末期,由于气候变化、超载过牧以及鼠虫害等原因,黄河源区草地发生了严重的退化[20],虽然近年来政府部门实施了一系列的生态保护工程措施,草地退化得到有效的遏制,但研究区仍有部分草地还处于退化阶段,高寒草原退化后以火绒草(Lobularia maritima)、细叶亚菊(Ajania tenuifolia)、披针叶野决明(Thermopsis lanceolata)、沙生风毛菊(Saussurea arenaria)等杂类草为主[21]。
1.2 采样方法
在研究区内根据草原植被群落特征设置6 个1 km × 1 km 的样地(图1),其中以高寒草原区紫花针茅为优势种的样地视为原生草原,以高寒草原区沙生风毛菊、细叶亚菊、披针叶野决明、火绒草等杂类草为主的样地视为退化草原[19,22],原生草原和退化草原各3 个样地(表1)。于2021 年植物生长季初期(5 月19 日-21 日)、生 长 季 盛 期(8 月10 日-16 日)和生长季末期(10 月11 日-14 日)分别进行土壤真菌群落样品采集,在每个样地内随机选取植被群落、生境条件和利用方式相对一致的区域各设置4 个1 m × 1 m 重复样方,使用内径3 cm 土钻在样方内随机选择3 个点采集0-20 cm 土样混合后作为该样方的土壤样品。将土壤样品过2 mm 筛,去除植物残体、根系及石块,-20 ℃冰箱保存用于提取土壤真菌群落DNA。于8 月植物生长盛期进行植被群落调查及土壤理化特征样品采集,通过样方法测定植物群落不同植物种高度、盖度、频度,并记录样方内物种丰富度,然后将植物地上部分全部进行刈割后带回实验室用于测定植物群落生物量。在样方内采用环刀法采集土壤容重样品,随后用土钻采集的土壤样品一部分用于测定土壤含水率和有机质、有机碳、全氮、全磷、速效磷、铵态氮、硝态氮含量等理化指标。

表1 样地位置及植被群落特征Table 1 Locations of sampling sites and vegetation community characteristics
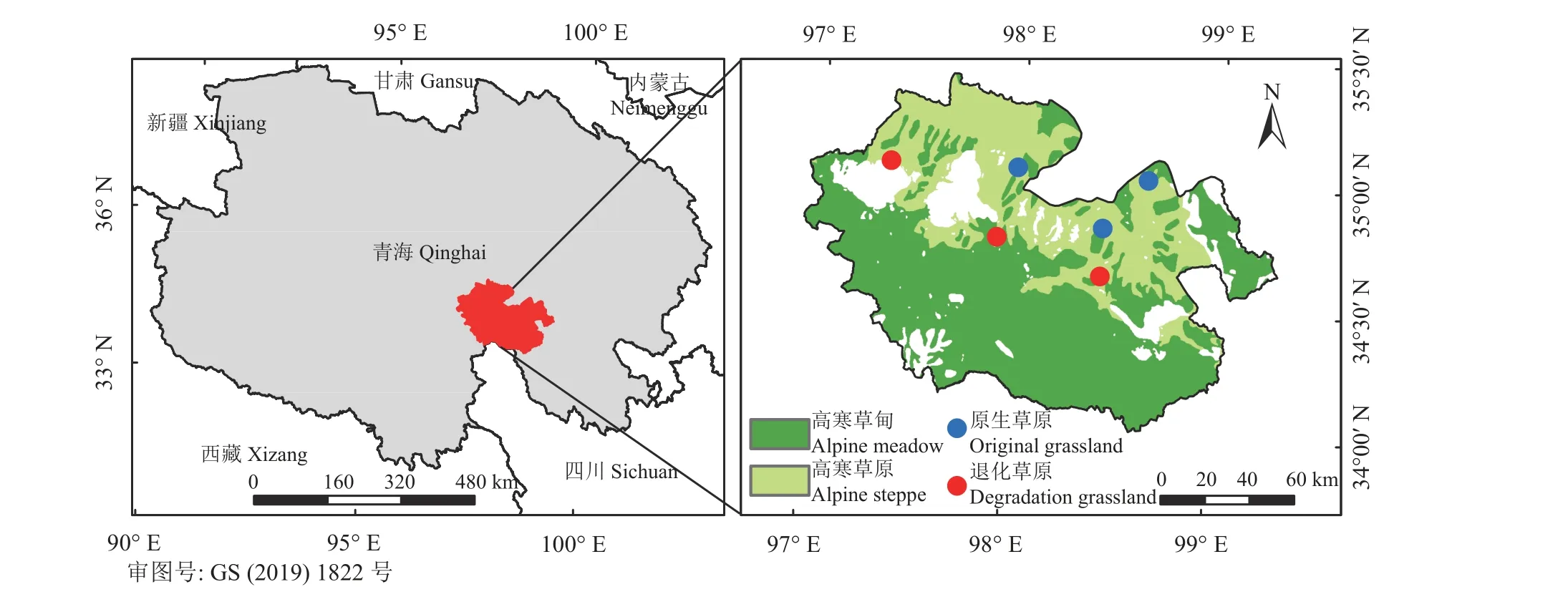
图1 研究区位置及样地分布图Figure 1 Location of the study area and distribution of the sampling sites
1.3 土壤理化特征测定方法
土壤容重及含水率均采用烘干法测定;土壤有机质含量采用重铬酸钾容量法-外加热法测定[19];土壤全氮、全磷、速效磷、铵态氮和硝态氮含量采用连续流动分析仪 (AMS Alliance, Proxima,法国)测定。
1.4 土 壤DNA 提 取、PCR 扩 增、illumina 测 序和数据处理
根 据 说 明,使 用DNeasy Powersoil Kit 试 剂 盒(Qiagen,德国)从0.25 g 土壤样品中提取DNA,使用NanoDrop 2000C 分光光度计 (Thermo Fisher Scientific,Inc., Waltham, MA, USA)测量DNA 的 浓度和质量。使 用ITS3 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATA TGC-3′)引物扩增 真 菌ITS 区[23]。PCR 扩 增 使 用BIO-RAD C1000 TouchTMThermal Cycler (BIO-RAD,美国) 完成,混合后的PCR 纯化产物,用TruSeq® DNA PCR-Free Sample Preparation Kit 建库试剂盒 (Illumina,美国) 进行标准建库,构建好的文库经过Qubit,文库合格后,使用Illumina 测序平台进行上机测序。
MiSeq 测序数据的处理由QIIME 1.7.0 (http://qiime.org/tutorials/tutorial.html)完成。根据样本条形码对原始序列进行排序,并使用QIIME 对序列进行质控(长度 > 300 bp,平均基础质量评分 > 30)。用UCHIME算法去除嵌合体序列[24]。序列通过QIIME 管道中包含的完全链接聚类方法进行聚类[25]。基于97%的序列相似性阈值,将序列聚类为操作分类单元 (OTUs)。在alpha 和beta 多样性分析中,每个样品都被提纯到具有最低读数的土壤样品 (50 254 条序列),并根据生成的物种观察稀释曲线,使用Ribosomal Database Project classifier 进行分类。
1.5 数据分析
基于植物群落高度、盖度、频度获得的重要值分别计算植物群落Shannon 多样性指数和Pielou 均匀度[26]。
重要值 (Important value, IV):
IV=(相对盖度+相对高度+相对频度)/3。
香浓维纳多样性指数 (Shannon-Wiener index, H):
均匀度指数 (Pielou J index, J):
式中:Pi为样方中第i种植物在群落中所占的重要值;S为种i所在样方的物种总数[27]。
使用SPSS 19.0 的单因素方差分析(One-way analysis of variance) 和 最 小 差 数 法(least significant different, LSD) 进行各项指标 (植物群落生物量、盖度、多样性,土壤理化特征,土壤真菌群落特征)的差异显著性检验。以OTUs 相对丰度表格作为输入数据,使用R version 3.4.0 计算Bray-Curtis 距离,采用基于Bray-Curtis 距离的非度量多维标度(nonmetric multidimensional scaling, NMDS) 评 估 真 菌 群 落 结构,并通过adonis 命令对不同退化程度和生长期的土壤真菌群落结构进行差异分析。使用SPSS 19.0的Pearson 相关性分析功能,分析植物群落和土壤理化特征与植物生长盛期真菌群落多样性的相关性。使用R version 3.4.0 进行消除趋势对应分析(detrended correspondence analysis, DCA),并 根 据 结果对原生和退化植物群落特征、土壤理化特征、真菌群落结构进行距离典型相关分析 (distance-based canonical correlation analysis, db-CCA),分析影响土壤真菌群落的主要因素。
2 结果与分析
2.1 植物生长盛期草原退化对植物群落和土壤理化特征的影响
在高寒草原生长盛期进行的植物群落调查结果显示,草原退化导致黄河源区植物群落生物量显著下降(P< 0.05) (表2),植物群落均匀度指数则显著上升(P< 0.05),植物群落盖度、丰富度和香浓维纳多样性指数并没有发生显著改变(P> 0.05)。
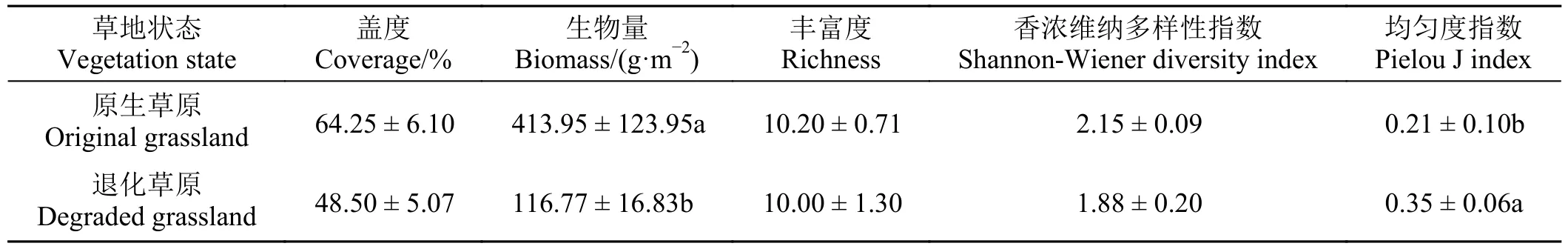
表2 草原退化对植物群落特征的影响Table 2 Effects of grassland degradation on plant community characteristics
在植物生长盛期,草原退化则显著增加了土壤含水率(P< 0.05) (表3),但是显著降低了土壤有机质和硝态氮含量(P< 0.05),对土壤容重、有机碳含量、全氮含量、全磷含量、速效磷含量以及铵态氮含量并没有产生显著影响(P> 0.05)。

表3 草原退化对土壤理化特征的影响Table 3 Effects of grassland degradation on soil physicochemical properties
2.2 草原退化对不同生长期土壤真菌群落组成的影响
从不同生长期的72 份土壤样品中合计测得真菌序列11 920 871 条,单个样品真菌序列数介于50 254~985 559,单个样品的平均序列数为165 567 条。除去未鉴定种,不同生长期高寒草原土壤真菌群落优势菌门均为子囊菌门(Ascomycota)和担子菌门(Basidiomycota) (图2)。

图2 草原退化对不同生长期土壤真菌群落组成的影响Figure 2 Effects of grassland degradation on fungal community composition during different growth periods
在原生草原,植物生长季初期和盛期的子囊菌门相对丰度显著高于生长季末期(P< 0.05) (图2),而生长季末期的担子菌门、被孢霉门(Mortierellomycota)和壶菌门(Chytridiomycota)的相对丰度均显著高于初期和盛期(P< 0.05)。在退化草原,植物生长季初期和盛期的子囊菌门相对丰度同样显著高于末期(P< 0.05),其他菌门的变化并不明显。
在生长季初期,草原退化导致子囊菌门的相对丰度显著下降(P< 0.05) (图2)。而在生长季盛期,草原退化导致子囊菌门和球囊菌门(Glomeromycota)的相对丰度显著下降(P< 0.05),对其余各菌门相对丰度的影响不显著(P> 0.05)。在生长季末期,草原退化则显著降低了子囊菌门和担子菌门的相对丰度(P< 0.05),对其余各菌门的相对丰度则没有产生显著影响(P> 0.05)。
2.3 草原退化对不同生长期土壤真菌群落多样性的影响
在同一生长期内,原生草原和退化草原真菌群落多样性差异不显著(P> 0.05) (表4),但是真菌群落多样性均随着植物生长而增加。具体表现为在原生草原和退化草原生长末期的香浓维纳多样性和OTU 丰度均显著高于初期和盛期(P< 0.05),而生长盛期和末期真菌群落Pielou 均匀度则显著高于初期(P< 0.05)。
NMDS 分析(Stress = 0.19)和adonis 分析表明,在原生草原和退化草原,植物生长初期、盛期和末期下的土壤真菌群落结构分别存在显著差异(P<0.05) (图3)。通过Bray-Curtis 距离对同一生长期不同退化程度的土壤真菌群落结构进行差异分析表明(表5),在同一生长期内,草原退化均导致土壤真菌群落结构发生显著改变(P< 0.05)。

表5 同一生长期不同退化程度的土壤真菌群落结构差异分析Table 5 Differential analysis of soil fungal community structure during different degrees of degradation in the same growth periods

图3 草原退化对不同生长期土壤真菌群落结构的影响Figure 3 Effects of grassland degradation on fungal community structure during different growth periods
2.4 植物生长盛期土壤真菌群落构成的影响因素
基于最小赤池指数(akaike information criterion,AIC)筛选环境因子后建立的db-CCA 分析表明,在原生草原(AIC = 211.26,总解释率66.55%),植物群落生物量和均匀度是显著影响不同生长期土壤真菌群落结构的主要环境因素(P< 0.05) (图4a);而在退化草原 (AIC = 111.11,总解释率81.65%),植物群落生物量和土壤有机质含量则是显著影响不同生长期真菌群落结构的主要环境因素(P< 0.05) (图4b)。
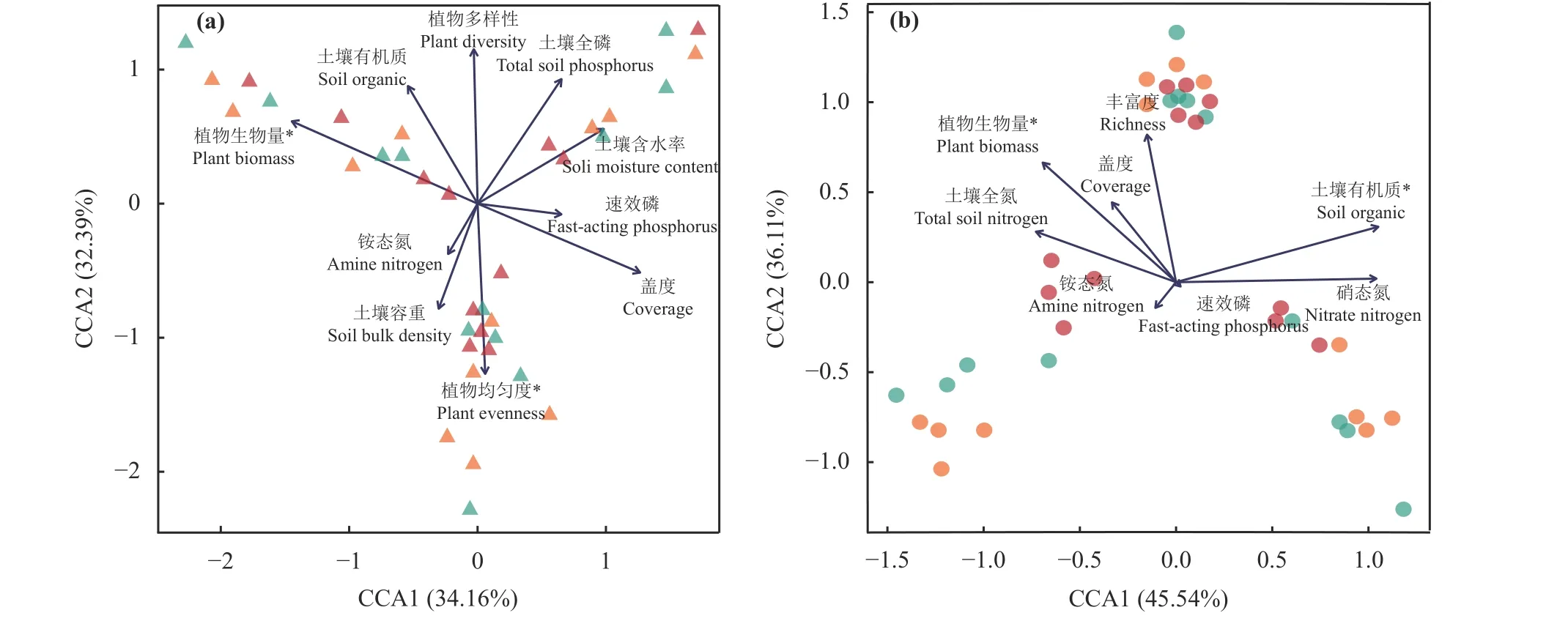
图4 环境因素与土壤真菌群落结构间的CCA 分析Figure 4 CCA of fungal community structure and environmental factors
3 讨论
3.1 不同生长期土壤真菌群落的变化
真菌是重要的土壤微生物类群,其群落组成通常决定了生态系统的资源利用效率及相关生态功能[28]。本研究中,不同生长期的原生和退化高寒草原优势菌门均为子囊菌门和担子菌门(图2),与青藏高原地区土壤真菌群落相关研究结果一致[10,29-30]。在高寒生态系统中子囊菌门和担子菌门是最普遍的优势真菌类群[31],较强的耐寒能力可能是其在高寒地区占据优势地位的主要原因。此外,植物生长季末期的子囊菌门相对丰度显著低于生长季初期和盛期,而担子菌门、被孢霉门和壶菌门的相对丰度均显著高于初期和盛期(图2)。高寒生境下植物和土壤微生物的生命活动均受到土壤养分含量的限制,为了缓解养分竞争压力,植物和土壤微生物对养分的吸收存在季节性分化的特征[32],即植物在春夏两季吸收养分以维持其生长发育,而土壤微生物则主要在秋季和冬季早期储存大量养分,并在次年春季受土壤冻融作用进行释放,为生长初期的植物提供养分来源,这种养分的“脉冲式”释放是高寒生态系统最大的养分输入过程[33]。因此,主要的优势菌门(子囊菌门)在植物生长末期相对丰度的下降,可能会影响土壤养分在非生长季来临前的贮存,进一步使土壤更加贫瘠,加剧草原退化。
本研究得出季节变化对土壤真菌群落多样性有着显著的影响,土壤真菌群落多样性均随着植物生长而增加,特别是相较于植物生长盛期和末期,在植物生长初期温度较低且有部分区域积雪覆盖,植物生理代谢活动尚不强烈,而植物生长末期随着根系以及枯落物的大量积累,微生物可利用养分增加,为真菌群落多样性创造了良好的条件,这可能是导致土壤真菌群落多样性初期较低、末期最高的主要原因[34]。
3.2 草原退化对土壤真菌群落的影响
草原退化在植物不同生长期均显著降低了子囊菌门的相对丰度(P< 0.05)。相关研究证实,子囊菌门相对丰度与土壤氮、磷含量显著相关[35],而放牧和土壤硝态氮含量会显著影响担子菌门的相对丰度[32,36]。本研究中,虽然除硝态氮外,退化草原土壤氮、磷含量与原生草原差异不显著,但整体上低于原生草原,且放牧和野生动物采食是导致黄河源地区草原退化的主要原因之一[20]。因此,放牧扰动和草原退化导致的土壤养分限制可能是引起植物生长盛期的子囊菌门和末期的子囊菌门、担子菌门相对丰度下降的主要原因。
生物多样性被认为是驱动生物群落生态过程和生态功能的重要因素[33,37]。本研究发现,在三江源高寒草原生态系统中,草原退化对土壤真菌群落的多样性影响并不显著,但整体上退化草原的真菌多样性低于原生草原 (表4)。退化未导致真菌群落多样性显著改变的研究结果与Li 等[38]一致。生态系统为群落提供的生态位通常是决定群落生物多样性的关键因素[10]。本研究中的退化草原样地均处于轻中度退化阶段,植物种类发生了明显改变,但丰富度和多样性变化不显著;除土壤含水率、有机质和硝态氮含量外,土壤理化特征整体变化也不明显,这些可能是真菌多样性未产生显著改变的原因。
3.3 土壤真菌群落的影响因素
探究退化草原真菌群落的影响因素,对于针对性制定合理的草原修复治理措施具有重要意义[38-39]。本研究中,在植物生长盛期,原生草原的植物群落生物量和均匀度对土壤真菌群落产生较大影响,而草原退化后植物生物量和土壤有机质对退化草原土壤真菌群落结构的影响更大。Xu 等[40]研究表明植物生物量在原生和退化草原均是显著影响土壤真菌群落结构的主要因素,与本研究结果相似。此外研究表明退化草地中土壤养分有效性是土壤微生物群落变化的驱动因素[32,38,41]。草原退化导致了植被地上、地下生物量的下降,植物生物量则直接决定了微生物主要碳源的凋落物量,在底物相对匮乏的生境中可利用资源有效性对土壤真菌群落结构的影响可能更强[42-43],特别是在退化草原土壤有机质含量对真菌群落的影响增强,也进一步强调了有机碳源对真菌群落结构的驱动作用。
4 结论
三江源区高寒草原土壤真菌群落优势菌门为子囊菌门和担子菌门,其中子囊菌门丰度在生长季初期达到最大,担子菌门丰度在生长季末期达最大,且不同生长期草原退化对土壤真菌群落多样性的影响不显著,但显著改变了真菌群落组成和结构。在原生草原植物群落生物量和均匀度显著影响土壤真菌群落结构,而在退化草原,植物群落生物量和土壤有机质含量则是土壤真菌群落结构的主要影响因子。因此,通过建植栽培草地、添加有机肥等措施提升植物群落生产力,能够缓解土壤真菌群落的养分限制,实现植被与土壤的同步治理,提升退化草原治理效率。
