不同处方美沙拉秦(嗪)肠溶片中相关杂质的分析
2024-03-14吴琦琦刘轶周明李帅李晓燕刘雁鸣文亮湖南省药品检验检测研究院长沙410001
吴琦琦,刘轶,周明,李帅,李晓燕,刘雁鸣,文亮(湖南省药品检验检测研究院,长沙 410001)
美沙拉秦(嗪),化学名为5-氨基-2-羟基苯甲酸[1-2],是临床治疗溃疡性结肠炎和克罗恩病的一线药物[3-4]。由瑞典PharmaciaAB公司开发,于英国TillotsLabs公司1985年首次上市。目前国内共有3家企业生产。本品已知杂质共有16种[5],大多含有硝基苯或氨基苯结构片段,具有潜在的基因毒性。通过基因毒性预测软件Derek和Sarah分析,其杂质A、杂质B、杂质C、杂质E、杂质I、杂质J、杂质M、杂质N、杂质S均为阳性,其中杂质A为对氨基酚,因可诱导DNA的断裂而具有明确的遗传毒性。《欧洲药典》对这些杂质进行了严格的控制;而国内现行质量标准有3个,部分标准缺失有关物质项,部分标准杂质检出能力差,可能会存在质量风险。溃疡性结肠炎和克罗恩病根治困难、易反复发作,一旦患病,往往需要长期服药[6]。因此,亟须对其首选药物——美沙拉秦(嗪)肠溶片上市后的安全性、有效性及质量可控性进行相关的评价性研究[7]。
1 仪器与试药
Agilent1260高效液相色谱仪、Agilent 1260 2D-6120二维液质联用仪(美国安捷伦公司);梅特勒托利多V20水分测定仪(瑞士梅特勒托利多公司);瑞士万通XP205电子天平(精度0.01 mg)。
美沙拉秦(嗪)肠溶片:企业1(51批次样品)、企业2(32批次样品)、企业3(32批次样品);甲醇为色谱纯,磷酸氢二钾、10%四丁基氢氧化铵水溶液为分析纯,水为纯化水。
2 方法
2.1 液相色谱条件
色谱柱为Agilent1 C18柱(250 mm×4.6 mm,5µm);流动相A为磷酸盐缓冲液(取磷酸氢二钾4.35 g,加水溶解并稀释至1000 mL,用磷酸调pH值至7.2)-TBAH溶液[取10%四丁基氢氧化铵水溶液80 mL,加水稀释至200 mL,用硫酸溶液(1→2)调节pH值至7.5]-甲醇-水(250∶50∶100∶600);流动相B为磷酸盐缓冲液-TBAH溶液-甲醇-水(250∶50∶500∶200),按表1梯度洗脱,流速为1.0 mL·min-1;柱温为40℃;检测波长为240 nm;进样量为10 μL。
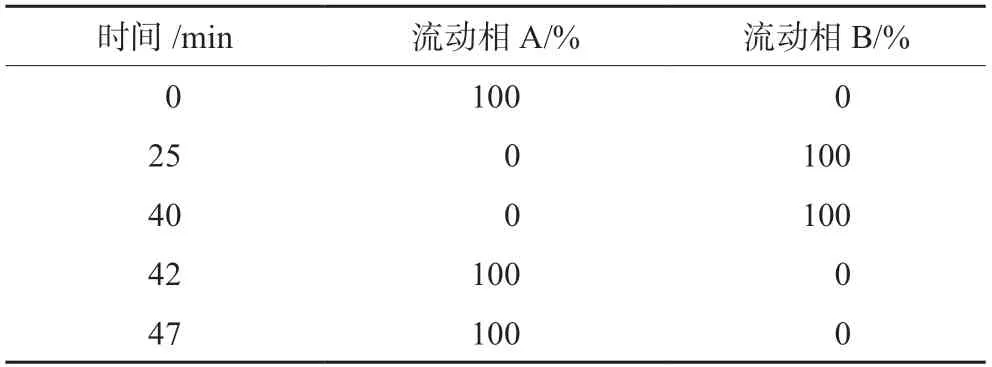
表1 梯度洗脱程序Tab 1 Gradient elution
2.2 质谱参数
采用ESI离子源、正离子及负离子全扫描模式,m/z范围为70~1000,扫描时间0.2 s,喷雾电压2.5 kV,去溶剂温度500℃,去溶剂气体800 L·h-1。
2.3 溶液的制备
取供试品10片,研细,精密称取细粉适量(约相当于美沙拉秦40 mg),置100 mL量瓶中,加甲醇20 mL和0.2 mol·L-1磷酸二氢钠溶液稀释至刻度,摇匀,滤过,取续滤液,作为供试品溶液;精密量取供试品溶液0.5 mL,置500 mL量瓶中,用0.2 mol·L-1磷酸二氢钠溶液稀释至刻度,摇匀,作为对照溶液。临用时新制。
3 结果
3.1 杂质谱
采用“2.1”项下条件对115批美沙拉秦(嗪)肠溶片样品进行了分析,结果如图1所示。主要检出4种杂质,杂质3为欧洲药典中杂质G,3家企业样品均有检出,其余为未知杂质,且均为企业1生产的样品特有。各杂质含量测定结果如表2所示。
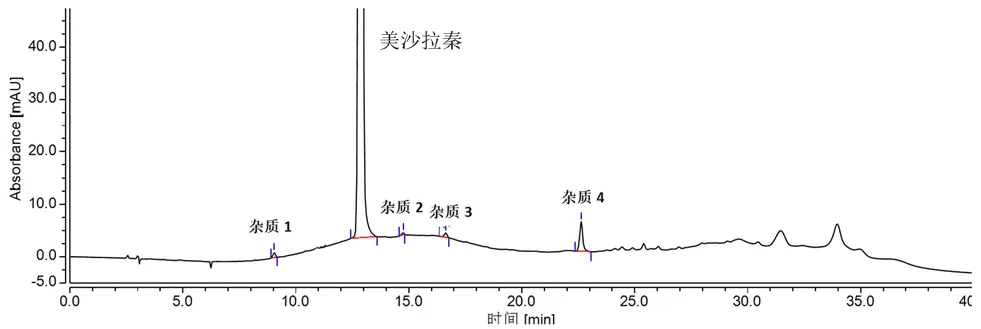
图1 美沙拉秦(嗪)肠溶片杂质谱Fig 1 Impurity spectrum of mesalazine enteric-coated tablets
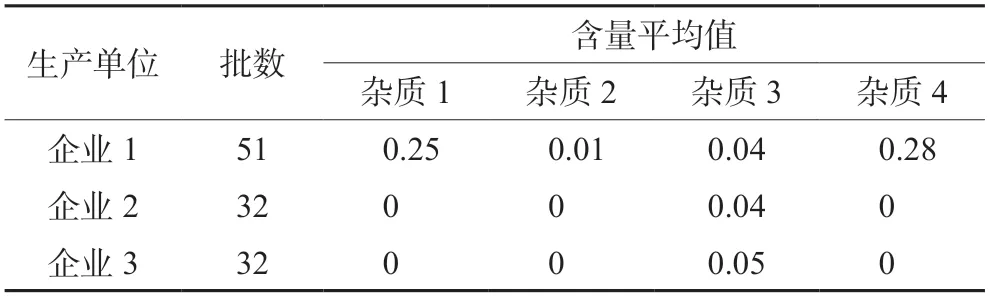
表2 各杂质含量测定结果(%)Tab 2 Content of impurities (%)
3.2 杂质1、杂质2来源分析
首先考虑是否为原辅料引入。各企业所用原辅料如表3所示。将企业1所用原辅料分别采用“2.1”项下条件测定,结果如图2所示,均无该3个杂质峰,证明不是原辅料直接引入。
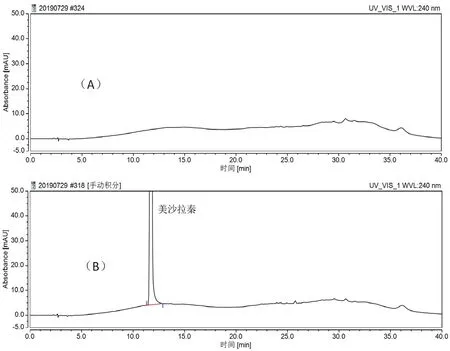
图2 企业1原辅料色谱图Fig 2 API and excipients chromatograms of enterprise 1

表3 美沙拉秦(嗪)肠溶片处方Tab 3 Prescription of mesalazine enteric-coated tablets
从该企业的留样库里调取了5批留样(均为本次研究涉及的批次),采用“2.1”项下条件进样测定,结果与市售样品一致。提示该杂质可能在出厂时已经存在,不由储存产生。
取处方量的原辅料进行压片前工艺的模拟,分别于原辅料混合、制粒、60℃干燥3 h 3个步骤取样测试。结果如图3所示,从原辅料混合后,杂质1就开始出现,并在制粒、干燥后该杂质逐渐增多。
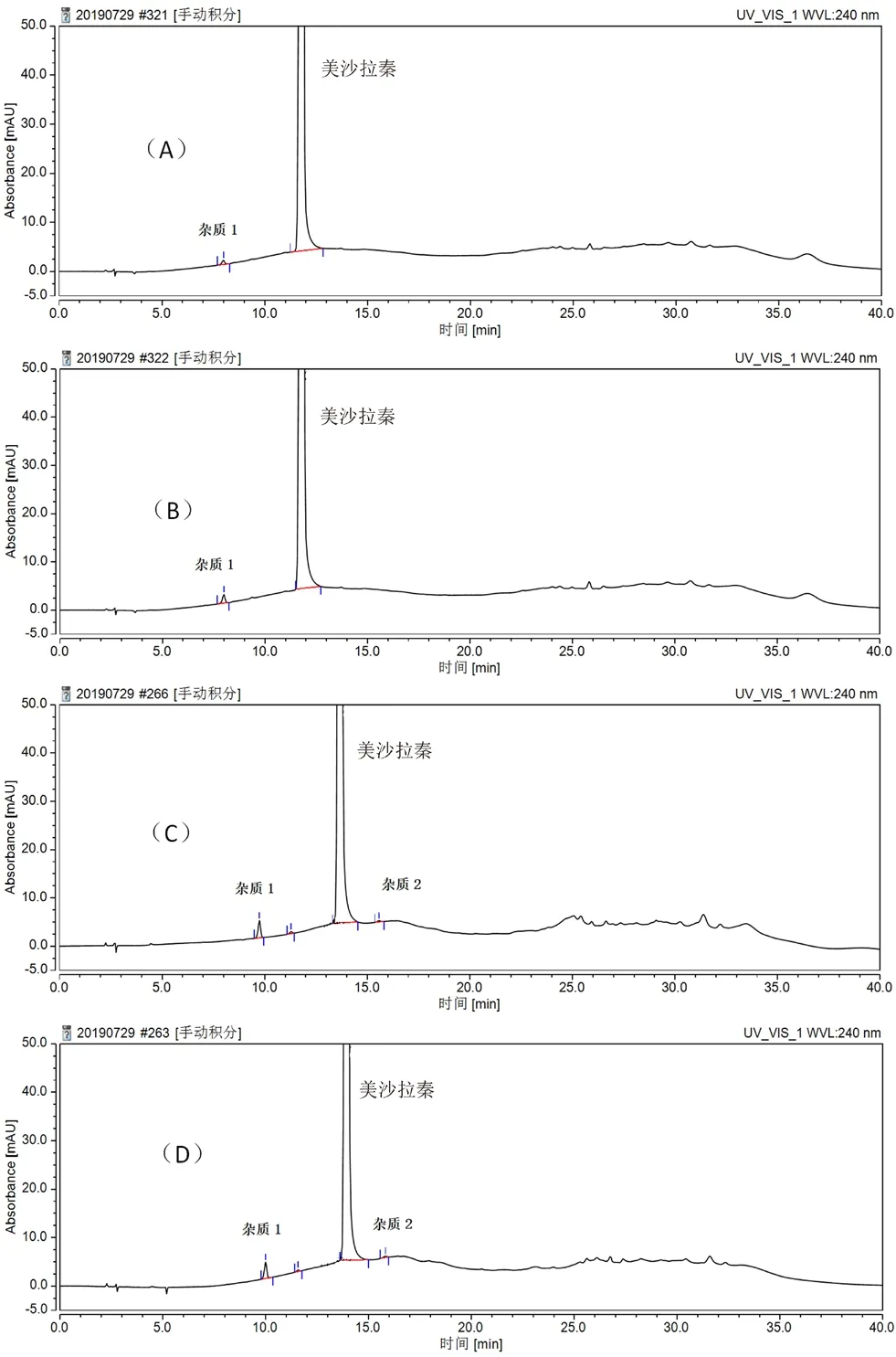
图3 企业1制粒过程样品色谱图Fig 3 Chromatogram of sample pelletizing process from enterprise 1
对比3家企业所用辅料,发现乳糖、微晶纤维素和滑石粉是企业1所特有,分析乳糖的结构发现,乳糖是由葡萄糖及半乳糖所组成的双糖,即由葡萄糖的第四个碳原子上的羟基与半乳糖中第一个碳原子的β-半缩醛羟基失水成苷键而得。因此仍然保持着葡萄糖分子上所含醛基的还原性。如图4所示,美沙拉秦结构中含有伯胺基,在加热的条件下能与还原糖发生羰氨反应(Maillard反应),氨基与羰基缩合生成席夫碱。温度20~25℃即可发生Maillard反应,一般每相差10℃,反应速度相差3~5倍,30℃以上速度加快,高于80℃时,反应速度受温度和氧气影响小。水分含量在10%~15%时,反应易发生。该企业工艺参数显示,本品为湿法制粒,干燥温度为60℃,均利于Maillard反应的发生。
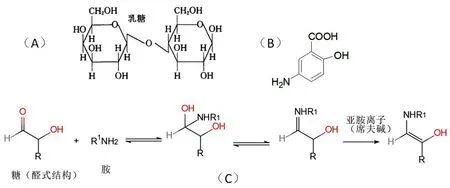
图4 乳糖与美沙拉秦的反应Fig 4 Reaction of lactose with mesalazine
用“2.2”项下方法测试杂质1的分子量,如图5所示,在负离子模式下,分子离子峰质荷比为476,正离子模式下,分子离子峰的质荷比为478,证明该杂质的分子量为477。乳糖的分子量为342,美沙拉秦的分子量为153,两者缩合脱水后的分子量恰好就是477。杂质2与杂质1质荷比相同,可能为杂质1的异构体。
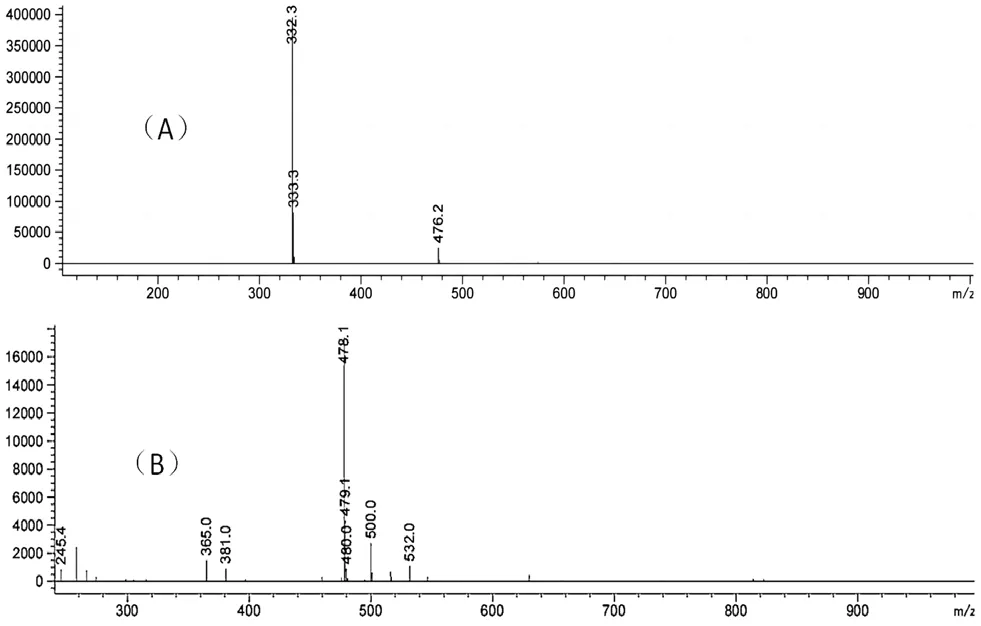
图5 杂质1质谱图Fig 5 Mass spectrum of impurity 1
综上所述,杂质1可能为辅料乳糖与美沙拉秦原料在生产过程中发生了Mailard而产生的。
3.3 杂质4来源分析
与同企业未检出杂质4批次的样品比较,检出杂质4的样品除去包衣后的片芯颜色都偏深,且片子硬度偏软,其水分分别为3.24%与3.41%。于企业1留样库里调取了同批次的留样进行测定,结果如表4所示。从企业留样库里调取的同样批次的样品均未检出杂质4,片芯颜色均显类白色,且片子硬度较大,水分值分别为1.94%与2.08%。提示样品在流通储存过程中发生了变化(硬度变小,水分增加),该杂质可能于流通储存环节中产生。

表4 不同来源美沙拉秦样品中杂质4的检测情况Tab 4 Detection of impurity 4 in mesalazine samples from different sources
将美沙拉秦原料及3个企业的样品分别进行高温、高湿、光照、高温+高湿四种条件的影响因素试验,结果如表5所示。在单独的光照、高温及高湿的条件下,本品的性状及杂质4没有改变,但在高温及高湿的共同作用下,企业1样品的性状发生了改变,同时产生了杂质4(见图6)。企业2及企业3样品的性状均未发生改变,也未产生杂质4。
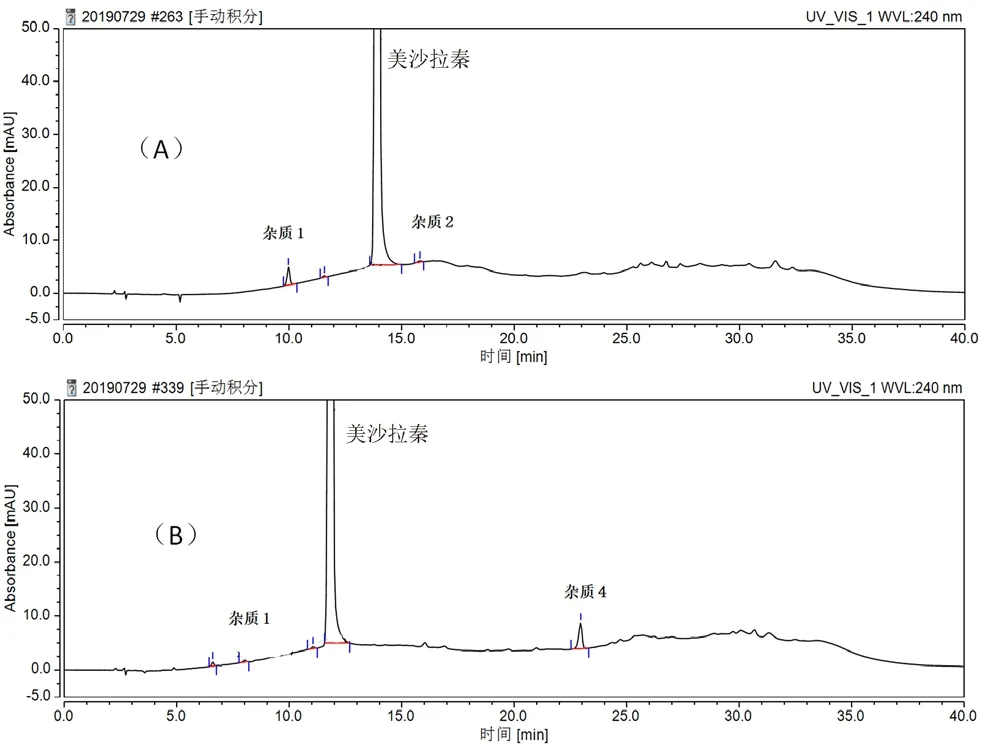
图6 企业1杂质色谱图Fig 6 Impurity chromatogram of enterprise 1
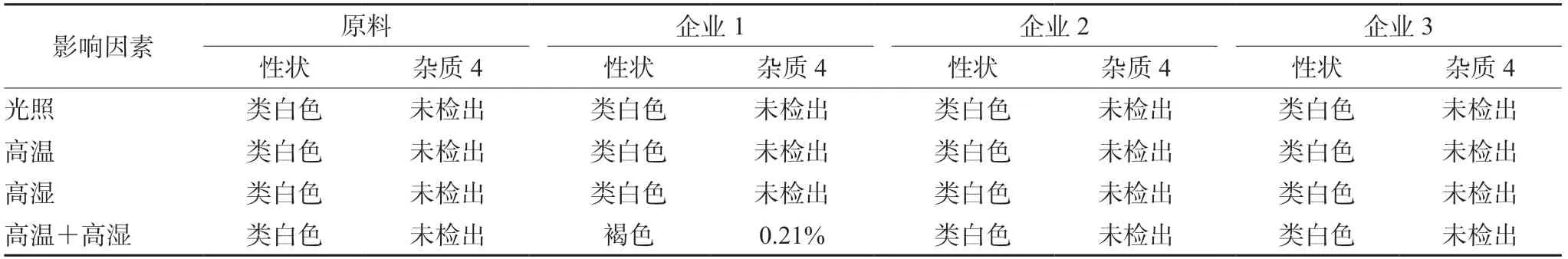
表5 各因素对不同来源美沙拉秦样品中杂质4的影响Tab 5 Effect of various factors on impurity 4 in mesalazine samples from different sources
分析各企业处方发现,企业1使用了辅料微晶纤维素。微晶纤维素吸湿性强,在高湿度下会吸湿增加水分,水分作为反应介质,增加了系统的塑性和分子流动性,同时形成水膜,反应就在此发生,进一步引起美沙拉秦降解,杂质显著增加。
企业2和企业3的处方未使用微晶纤维素,其样品比较稳定,高温高湿放置7 d后,性状未发生变化,杂质未见增加。
用LC-MS测试杂质4的分子量,结果如图7所示,负离子模式下,分子离子峰质荷比为260;正离子模式下,分子离子峰的质荷比为262。证明该杂质的分子量为261。

图7 杂质4质谱图Fig 7 Mass spectrum of impurity 4
根据其分子量初步推测,杂质4的结构可能为图8所示。具体情况还有待进一步研究证实。

图8 杂质4可能的结构图Fig 8 Possible structure of impurity 4
4 讨论
4.1 不同处方的样品杂质谱有较大差异
本文对市售各企业多批样品进行了有关物质考察,共检出4个主要杂质,其中杂质1、杂质2和杂质4为企业1生产的样品的特有杂质,杂质3为所有样品的共有杂质。提示不同处方的样品杂质谱有较大差异。
4.2 企业1处方不合理,应对其进行变更
杂质1、杂质2为企业1处方中辅料与原料发生反应产生的,同时,企业1处方中的辅料还可能会促进杂质4的生成。提示企业1处方不合理,应对其进行变更。
4.3 原辅料相容性应引起重视
《药用辅料与药物相容性研究指导原则》指出:药物制剂中各种药用辅料、药用辅料的杂质及药物活性成分之间不得发生化学反应,不产生新化学成分或杂质,进而不影响药物的疗效。乳糖与美沙拉秦会产生Maillard反应,生成杂质,含美沙拉秦的制剂中应避免使用乳糖作为辅料。
微晶纤维素吸湿性强,在高湿度下会吸湿增加水分,可能会引起美沙拉秦降解速率的增大,使制剂杂质显著增加,含美沙拉秦的制剂中也应避免使用微晶纤维素作为辅料。
4.4 小结
本文对目前市售的不同处方的美沙拉秦(嗪)肠溶片的杂质进行全面分析,通过建立新的杂质检测方法及杂质谱,从杂质种类、杂质个数、杂质来源、不同处方样品的稳定性等方面进行分析,从而对其产品质量及生产工艺进行评价,同时,使各企业对自身产品质量状况、同品种质量现状以及产品质量改进等各方面有客观的认识和了解,为药品监督管理部门今后对美沙拉秦(嗪)肠溶片的监督管理提供了参考。
