蔷薇红景天总黄酮提取物对Aβ25-35诱导PC12细胞损伤的保护作用及其活性部位筛选
2024-03-14刘忠毅王启文阿孜古丽阿里木王晓梅胡君萍王新玲新疆医科大学药学院乌鲁木齐830011
刘忠毅,王启文,阿孜古丽·阿里木,王晓梅,胡君萍,王新玲(新疆医科大学药学院,乌鲁木齐 830011)
蔷薇红景天(RhodiolaroseaL.)为景天科(Crassulaceae)红景天属(Rhodiola)多年生草本植物,是新疆的重要植物资源之一,据《新疆药用植物志》记载[1],其主要分布于新疆天山山脉1600~2700米的高寒地区,药用部位主要为根及根茎,具有清肺止咳、止血、止带等功效,也用作滋补强壮药[2]。近年研究表明蔷薇红景天还具有强壮机体、抗脑缺氧、抗疲劳、增强记忆、延缓衰老等作用[3]。
阿尔茨海默病(Alzheimer’s disease,AD)是一种多发于老年人的由多种因素引起的中枢神经退行性疾病,临床症状主要为患者记忆力丧失、认知功能障碍等,严重影响着老年人的身心健康,也加重了国家医疗体系负担[4]。目前临床治疗以缓解症状为主,减轻或阻止疾病的进程并不理想。中药在治疗AD方面表现出独特的优势,也是药物研发的重要来源。现代药理研究表明,黄酮类化合物具有抗氧化、抗炎、神经保护以及增强认知功能等方面的作用[5-6],可从多靶点改善AD模型动物的认知功能障碍,减轻AD样病理症状,抑制AD的病理进程[7]。课题组前期从新疆蔷薇红景天中得到了山柰酚-7-O-α-L-鼠李糖苷及其苷元山柰酚、5,7,3',5'-四羟基二氢黄酮及草质素-7-O-α-L-鼠李糖苷等黄酮类化合物[8],并对总黄酮进行了提取和纯化工艺研究,得到的提取物和纯化物的总黄酮含量分别为56.97%和82.83%[9],药理作用结果表明,其总黄酮提取物具有较好的抗炎和对Aβ25-35诱导HT22细胞损伤的保护作用,且安全无毒[10]。鉴于前期所选纯化工艺存在流速慢而耗时、收率低而不利于工业化生产等缺点,故本研究以蔷薇红景天总黄酮提取物(total flavonoids extract,TFE)为研究对象,经AB-8大孔吸附树脂分离,得不同体积分数的乙醇洗脱物;测定不同洗脱物总黄酮含量同时,利用Aβ25-35诱导分化PC12细胞构建AD炎症细胞模型,通过观察PC12细胞形态、检测PC12细胞活力及细胞培养液中炎症因子包括白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、环氧合酶-2(COX-2)和白细胞介素-1β(IL-1β)的水平,探究不同体积分数的乙醇洗脱物对β-淀粉样蛋白25-35(Aβ25-35)诱导细胞损伤的保护作用,筛选活性部位并阐明其中药效物质基础,为进一步研究开发和应用新疆蔷薇红景天提供理论依据。
1 材料
蔷薇红景天购于新疆伊犁,由新疆医科大学药学院丛媛媛教授鉴定为景天科红景天属植物蔷薇红景天(RhodiolaroseaL.)的干燥根茎,标本保存于新疆医科大学药学院天然药物化学/生药学教研室。蔷薇红景天总黄酮提取物(TFE,总黄酮含量56.97%)由新疆医科大学药学院天然药物化学/生药学教研室自制[9]。
胎牛血清(VivaCell,批号:2148389);DMEM高糖培养基(Servicebio,货号:G4511-500 mL);磷酸缓冲液(PBS)、0.25%胰蛋白酶消化液、青霉素+链霉素(VivaCell公司);Aβ25-35(美国Sigma公司,HPLC≥97%,批号:A4559-1MG);MTT(德国Biofroxx公司);BCA总蛋白定量试剂盒(北京索莱宝公司,批号:20220311);乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所,批号分别为20220706、20220705);IL-6、TNF-α、COX-2、IL-1β酶联免疫试剂盒(上海将来实业股份有限公司,批号分别为JL13202、JL20896、JL20884、JL21044);盐酸多奈哌齐片(植恩生物技术股份有限公司,批号:H20010723);芦丁(纯度:98%,中国食品药品检定研究院,批号:0080-9705);PC12细胞(高分化,大鼠肾上腺嗜铬细胞瘤,武汉普赛诺生命科技有限公司)。
UV2700紫外可见分光光度计(日本岛津公司);N-1001型旋转蒸发仪(上海爱朗仪器有限公司);AB135-S型十万分之一电子天平(Mettler Toledo公司),Heracell型CO2恒温培养箱(美国赛默飞公司);KS12型超净工作台、KS12型离心机(美国Thermo Scientific公司);MLS-3750型高压蒸汽灭菌锅(日本三洋电机株式会社);W-HL828型-80℃超低温冰箱(中科美菱);01562型荧光倒置显微镜(上海蔡司光学仪器);Multiskan GO全波长酶标仪(Thermo Fisher公司)。
2 方法与结果
2.1 总黄酮含量测定
2.1.1 TFE不同体积分数乙醇洗脱物母液的制备 称取蔷薇红景天TFE适量,采用AB-8大孔吸附树脂柱色谱法分离,分别经3倍柱体积的蒸馏水及20%、40%、60%、80%及95%乙醇溶液进行梯度洗脱,得不同体积分数乙醇洗脱液,减压浓缩、干燥,得干浸膏,计算收率。分别记为TFE-0%、TFE-20%、TFE-40%、TFE-60%、TFE-80%、TFE-95%。精密称取不同体积分数乙醇洗脱物干浸膏10 mg,用70%乙醇溶解,定容于10 mL量瓶中,摇匀,即得1.0 mg·mL-1各洗脱物样品溶液,4℃保存备用。
2.1.2 总黄酮含量测定方法 参考相关文献[11]并对测定方法略加优化。在全波长扫描所确定的508 nm波长下测定吸光度(A),以芦丁对照品溶液质量浓度(X)为横坐标,A为纵坐标,绘制标准曲线,得线性回归方程A=11.631X+0.008,r=0.9999,线性范围为0.016~0.080 mg·mL-1。
2.1.3 芦丁对照品溶液的配制 精密称取干燥至恒重的芦丁对照品8.0 mg,置50 mL量瓶中,加70%乙醇溶解并定容至刻度,摇匀,即得0.16 mg·mL-1芦丁对照品溶液,4℃保存备用。
2.1.4 标准曲线的绘制 精密量取芦丁对照品溶液1.0、2.0、3.0、4.0、5.0 mL于10 mL量瓶中,分别加入5%亚硝酸钠溶液0.4 mL,摇匀,静置6 min;再加入10%硝酸铝溶液0.4 mL,摇匀,静置6 min;再加入4% NaOH溶液4.0 mL,70%乙醇定容至刻度,摇匀,静置15 min;以70%乙醇溶剂为空白。
2.1.5 TFE不同体积分数乙醇洗脱物中总黄酮含量的测定 分别精密量取适量TFE不同体积分数乙醇洗脱物母液,按“2.1.2”项下方法分别测定吸光度,根据标准曲线计算相应的总黄酮含量。
2.2 TFE不同体积分数乙醇洗脱物对Aβ25-35诱导损伤的PC12细胞保护作用
2.2.1 细胞培养与分组 PC12细胞复苏后,在含10%胎牛血清和青霉素100 U·mL-1+链霉素100 U·mL-1的DMEM高糖培养基中37℃、5%CO2培养箱培养,1~2 d传代1次,达到对数生长期后开始实验。
PC12细胞损伤模型采用20 µmol·L-1Aβ25-35建立。分组如下:阴性组(只加完全培养液)、空白组(含细胞的完全培养液)、模型组(20µmol·L-1Aβ25-35)、TFE-0%组(TFE-0%+20µmol·L-1Aβ25-35)、TFE-20%组(TFE-20%+20 µmol·L-1Aβ25-35)、TFE-40%组(TFE-40%+20 µmol·L-1Aβ25-35)、TFE-60%组(TFE-60%+20 µmol·L-1Aβ25-35)、TFE-80%组(TFE-80%+20 µmol·L-1Aβ25-35)、TFE-95%组(TFE-95%+20 µmol·L-1Aβ25-35)、盐酸多奈哌齐组(盐酸多奈哌齐+20 µmol·L-1Aβ25-35)。
2.2.2 溶液配制
① Aβ25-35溶液:将1 mg Aβ25-35溶解于940µL PBS溶液中,放入37℃培养箱孵育7 d,使其老化形成凝聚态,再分装成每支100 µL放入-20℃冰箱保存,使用前取出,4℃保存备用。
② 药物溶液:TFE不同体积分数乙醇洗脱物(TFE-0%、TFE-20%、TFE-40%、TFE-60%、TFE-80%、TFE-95%)与盐酸多奈哌齐用二甲基亚砜(DMSO)溶解,加入完全培养基使DMSO终浓度为0.1% mmol·L-1,4℃保存备用。使用时用完全培养基对药物溶液进行稀释,得到所需的浓度。
2.2.3 MTT法检测TFE不同体积分数乙醇洗脱物对PC12细胞存活率 取对数生长期的细胞进行消化,加入DMEM完全培养基重悬,计数,将浓度稀释至5×104个·mL-1,接种于96孔板中,待细胞贴壁后,各组分别加入TFE-0%、TFE-20%、TFE-40%、TFE-60%、TFE-80%、TFE-95%及盐酸多奈哌齐不同浓度与PC12细胞共同培养24 h,每组设置3个平行对照。MTT法检测细胞活力,根据细胞存活率确定药物的安全浓度。
2.2.4 MTT法检测TFE不同体积分数乙醇洗脱物对Aβ25-35损伤的PC12细胞存活率的影响 将PC12细胞按5×104个·mL-1接种于96孔板中,待细胞贴壁后,按照“2.2.1”项下方法进行分组,除空白组和模型组外,其他各组分别加入TFE-0%、TFE-20%、TFE-40%、TFE-60%、TFE-80%、TFE-95%及盐酸多奈哌齐进行干预4 h,再加入20µmol·L-1Aβ25-35共同培养24 h,每组设置3个平行对照,放入37℃、5% CO2培养箱中培养24 h后,MTT法检测细胞活力。
2.2.5 细胞形态学观察 将PC12细胞按5×104个·mL-1接种于12孔板中,待细胞贴壁后,按照“2.2.4”项下方法分组给药,共同培养24 h后,在倒置显微镜下观察各组细胞形态并记录。
2.2.6 PC12细胞中LDH漏出量和SOD水平的测定 细胞以每孔1 mL的体积接种于24孔细胞培养板中,培养24 h,待细胞贴壁生长后,弃去上清液。按照“2.2.1”项下方法分组,每组设置3个平行对照组,实验组均每孔给药500 µL,空白组加无血清培养液,培养4 h后,每孔加入500 µL 40 µmol·L-1Aβ25-35损伤(终浓度为20 µmol·L-1),共同培养24 h后,收集细胞和细胞培养液。严格按照试剂盒说明书在450 nm处测定吸光度值OD,按下列公式计算各组LDH漏出量和SOD活力。
LDH漏出量(IU·L-1)=(OD测定孔-OD对照孔)/(OD标准孔-OD空白孔)×标准品浓度(0.2 μmol·mL-1)×1000
SOD活力(U·mgprot-1)=SOD抑制率/50%×稀释倍数/待测样本蛋白浓度
2.2.7 ELISA法检测细胞上清液中TNF-α、IL-6、IL-1β、COX-2的分泌量 按照“2.2.6”项下方法干预细胞,收集细胞培养液,离心并收集上清液,严格按照IL-1β、COX-2、TNF-α及IL-6试剂盒说明书操作进行后续实验。450 nm处酶标仪测定吸光度,然后计算细胞炎症因子IL-1β、COX-2、TNF-α及IL-6的分泌水平。
2.3 统计学处理
所有实验数据结果以均数±标准差(±s)表示,统计分析采用SPSS 21.0统计软件,实验数据采用单因素方差(One-way ANOVA)分析,以P<0.05为统计学有统计学意义。
2.4 结果与分析
2.4.1 TFE不同体积分数乙醇洗脱物中总黄酮的含量
计算TFE不同体积分数乙醇洗脱物浸膏得率,赋予浸膏得率0.3权重,再根据“2.1.4”项下标准曲线计算不同洗脱物中总黄酮浓度,赋予总黄酮浓度0.7权重,以总得分为评价标准,得分越高,表明该洗脱物越优。结果见表1,TFE-40%洗脱物总黄酮浓度可达91.12%,浸膏得率为23.17%,总得分为70.74,高于其他体积分数的乙醇洗脱物。

表1 TFE不同体积分数乙醇洗脱物浸膏得率及总黄酮含量及其得分(n=3)Tab 1 Extract yield and total flavonoid content of TFE different volume fractions ethanol elution and their scores (n=3)
2.4.2 TFE不同体积分数乙醇洗脱物对PC12细胞存活率的影响 结果显示,与空白组相比,盐酸多奈哌齐在50 μmol·L-1时,细胞活力无统计学意义;TFE-40%、TFE-60%及TFE-95%在800 μg·mL-1时,PC12细胞活力明显下降(P<0.05);TFE-0%、TFE-20%及TFE-80%组在800 μg·mL-1时细胞活力差异无统计学意义;而TFE各洗脱物在给药剂量为400 μg·mL-1时,对PC12细胞存活率的影响较小,均未表现出明显毒性,见表2。为保持单一变量,故在后续实验中均选择400 μg·mL-1为TFE不同体积分数乙醇洗脱物的给药浓度。
表2 TFE不同体积分数乙醇洗脱物对PC12细胞存活率的影响(±s,n=3)Tab 2 Effect of ethanol eluent of different volume fractions of TFE on the survival rate of PC12 cells (±s,n=3)

表2 TFE不同体积分数乙醇洗脱物对PC12细胞存活率的影响(±s,n=3)Tab 2 Effect of ethanol eluent of different volume fractions of TFE on the survival rate of PC12 cells (±s,n=3)
注:与空白组比较,*P<0.05,**P<0.01。Note:Compared with the blank group,*P<0.05,**P<0.01.
组别剂量细胞存活率/%空白组-100盐酸多奈哌齐组12.5 μmol·L-1115.99±7.18*25 μmol·L-1119.10±5.04**50 μmol·L-1106.10±8.87 TFE-0%组200 μg·mL-1118.41±7.66**400 μg·mL-1117.11±4.57*800 μg·mL-1105.65±9.54 TFE-20%组200 μg·mL-1107.54±3.92 400 μg·mL-1101.30±5.75 800 μg·mL-1 95.65±6.90 TFE-40%组200 μg·mL-1100.21±3.13 400 μg·mL-1 90.72±10.01 800 μg·mL-1 76.09±5.01*TFE-60%组200 μg·mL-1106.13±5.68 400 μg·mL-1102.96±4.58 800 μg·mL-1 85.51±3.62**TFE-80%组200 μg·mL-1133.04±4.94**400 μg·mL-1129.86±5.90**800 μg·mL-1 99.57±3.01 TFE-95%组200 μg·mL-1137.97±1.33**400 μg·mL-1136.81±2.96**800 μg·mL-1 78.12±4.65**
2.4.3 TFE不同体积分数乙醇洗脱物对Aβ25-35诱导的PC12细胞存活率的影响 表3结果显示,与空白组相比,模型组细胞存活率明显下降(P<0.01);与模型组相比,400 μg·mL-1的TFE-0%与TFE-20%组细胞存活率差异无统计学意义;TFE-40%、TFE-60%、TFE-80%、TFE-95%与盐酸多奈哌齐组细胞存活率均明显上升(P<0.01)。
表3 TFE不同体积分数乙醇洗脱物对Aβ25-35诱导的PC12细胞存活率的影响(±s,n=3)Tab 3 Effect of ethanol eluent of different volume fractions of TFE on Aβ25-35 induced PC12 cell viability (±s,n=3)

表3 TFE不同体积分数乙醇洗脱物对Aβ25-35诱导的PC12细胞存活率的影响(±s,n=3)Tab 3 Effect of ethanol eluent of different volume fractions of TFE on Aβ25-35 induced PC12 cell viability (±s,n=3)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。Note:Compared with the blank group,##P<0.01;compared with the model group,*P<0.05,**P<0.01.
组别剂量细胞存活率/%LDH漏出量/(U·L-1)SOD水平/(U·mgprot-1)空白组-100160.42±13.01336.08±3.04模型组 20 µmol·L-169.75±1.96##333.33±15.73##227.32±28.35##TFE-0%组400 μg·mL-169.43±2.56289.58±19.09*258.09±32.04*TFE-20%组400 μg·mL-172.80±2.34279.17±25.26**275.80±2.02**TFE-40%组400 μg·mL-181.16±0.88**233.33±21.95**296.97±8.50**TFE-60%组400 μg·mL-180.49±3.88**222.92±21.95**287.59±1.23**TFE-80%组400 μg·mL-176.22±0.97**243.75±10.83**284.64±8.67**TFE-95%组400 μg·mL-176.26±0.75**247.92±23.66**309.29±7.25**盐酸多奈哌齐组 50 μmol·L-175.63±3.08**220.83±19.09**321.88±9.27**
2.4.4 TFE不同体积分数乙醇洗脱物对Aβ25-35诱导的PC12细胞LDH漏出量和SOD水平的影响 与空白组相比,模型组LDH漏出量明显升高(P<0.01),SOD水平明显下降(P<0.01),说明Aβ25-35对PC12细胞有一定程度的损伤。与模型组相比,TEF-0%组SOD水平明显上升,LDH漏出量明显下降(P<0.05),TFE-20%、TFE-40%、TFE-60%、TFE-80%、TFE-95%组及盐酸多奈哌齐组的SOD水平明显升高(P<0.01),LDH漏出量明显下降(P<0.01),结果见表3。
2.4.5 细胞形态学观察 由图1可知,空白组PC12细胞形态结构完整,多呈梭形结构,有多个突触。模型组细胞经20 µmol·L-1Aβ25-35诱导24 h后,细胞形态发生了明显损伤,细胞间隙变大,出现细胞碎片,细胞数目减少,且突触明显减少。与模型组相比,TFE-0%组、TFE-20%组细胞形态无明显改变,但细胞碎片增加,细胞间隙变大,出现明显损伤;TFE-40%组、TFE-60%组和盐酸多奈哌齐组细胞形态均有一定程度改善,细胞数目增多,细胞突触增加,且细胞形态较为完整;TFE-80%与TFE-95%组的细胞突触变长,但细胞碎片、间隙无明显改善。说明TFE-40%组、TFE-60%组和盐酸多奈哌齐组对Aβ25-35诱导损伤的PC12细胞结构及形态均有一定程度的保护作用。

图1 倒置显微镜下观察PC12细胞形态变化(×100)Fig 1 Morphological changes of PC12 cells under inverted microscope(×100)
2.4.6 TFE不同体积分数乙醇洗脱物对Aβ25-35诱导的PC12细胞上清液中IL-1β、COX-2、TNF-α及IL-6水平的影响 与空白组相比,模型组中IL-1β、COX-2、TNF-α及IL-6分泌量均明显上升(P<0.01);与模型组相比,TEF-0%与TEF-20%组对细胞中COX-2、TNF-α和IL-6的分泌量差异无统计学意义,TEF-20%组中细胞IL-6的分泌量明显下降(P<0.05);TFE-40%组、TFE-60%组、TFE-80%组、TFE-95%组及盐酸多奈哌齐组使细胞中IL-1β、COX-2、TNF-α及IL-6的分泌量均明显下降(P<0.05),且TFE-40%组对IL-1β和TNF-α的影响强于其他给药组,结果见表4。
表4 PC12细胞上清液中IL-1β、COX-2、TNF-α及IL-6分泌量(±s,n=3)Tab 4 Secretion of IL-1β,COX-2,TNF-α and IL-6 in the supernatant of PC12 cells (±s,n=3)
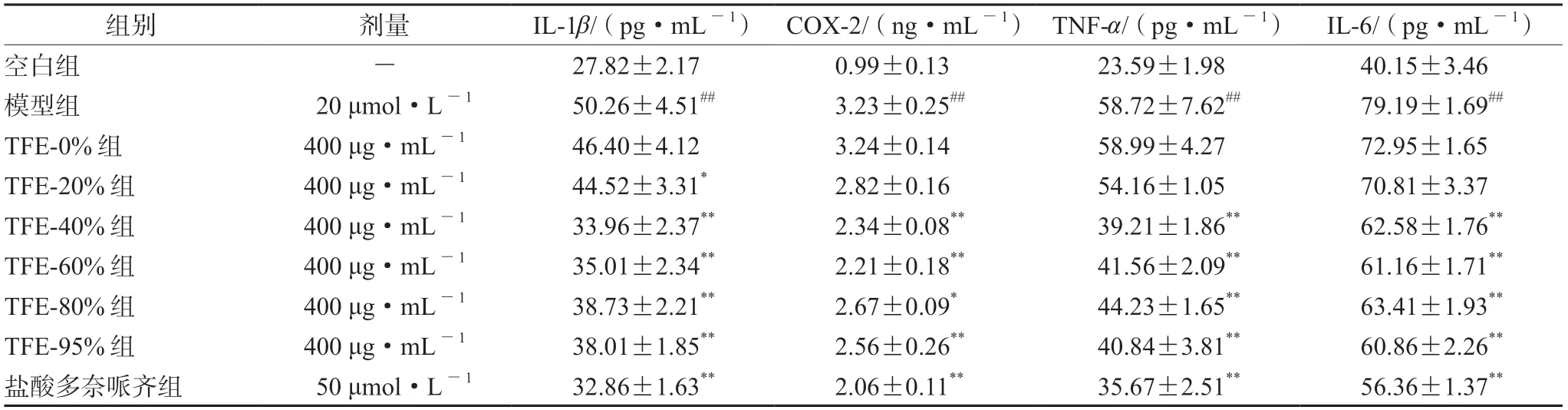
表4 PC12细胞上清液中IL-1β、COX-2、TNF-α及IL-6分泌量(±s,n=3)Tab 4 Secretion of IL-1β,COX-2,TNF-α and IL-6 in the supernatant of PC12 cells (±s,n=3)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。Note:Compared with the blank group,##P<0.01;compared with the model group,*P<0.05,**P<0.01.
组别剂量IL-1β/(pg·mL-1)COX-2/(ng·mL-1)TNF-α/(pg·mL-1)IL-6/(pg·mL-1)空白组- 27.82±2.17 0.99±0.13 23.59±1.98 40.15±3.46模型组 20 μmol·L-1 50.26±4.51## 3.23±0.25## 58.72±7.62## 79.19±1.69##TFE-0%组400 μg·mL-1 46.40±4.12 3.24±0.14 58.99±4.27 72.95±1.65 TFE-20%组400 μg·mL-1 44.52±3.31* 2.82±0.16 54.16±1.05 70.81±3.37 TFE-40%组400 μg·mL-1 33.96±2.37** 2.34±0.08** 39.21±1.86** 62.58±1.76**TFE-60%组400 μg·mL-1 35.01±2.34** 2.21±0.18** 41.56±2.09** 61.16±1.71**TFE-80%组400 μg·mL-1 38.73±2.21** 2.67±0.09* 44.23±1.65** 63.41±1.93**TFE-95%组400 μg·mL-1 38.01±1.85** 2.56±0.26** 40.84±3.81** 60.86±2.26**盐酸多奈哌齐组 50 μmol·L-1 32.86±1.63** 2.06±0.11** 35.67±2.51** 56.36±1.37**
3 讨论
在正常生理情况下,Aβ淀粉中的蛋白堆积量与其水解时间基本是趋于一致的;但病理条件下,Aβ蛋白质的分解数量会增加,水解次数减少,过量降解产生的Aβ蛋白易凝结形成一个寡聚体,寡聚体间的过度聚集会形成一种难溶性的淀粉斑块,并沉积在大脑皮层;高浓度的Aβ淀粉聚集具有神经毒性,会导致全身各种特异性免疫的炎症反应、神经毒性级联排斥反应以及大量神经元细胞坏死、变性甚至死亡,最终导致AD的形成[12-13]。目前临床上可用于治疗AD的药物较少,目前有单克隆抗体(阿杜那单抗与仑卡那单抗)和典型的小分子化合物如多奈哌齐、美金刚和卡巴拉汀外,还有来源于天然植物的EGb 761和GV-971,EGb 761是银杏叶的标准化提取物,其主要活性成分为类黄酮和银杏内酯[14]。天然黄酮化合物是一类具有广泛活性的成分,可经肠道吸收,穿过血脑屏障,通过抑制脑组织炎症因子的表达和分泌、减轻氧化应激造成的损伤、抑制神经元凋亡、降低胆碱酯酶活性、减少Aβ聚集和形成而改善与年龄相关的认知障碍[15]。因此黄酮类化合物已成为一种潜在的神经保护剂,有望开发成为抗AD的药物[16]。
本研究通过考察蔷薇红景天TFE不同体积分数乙醇洗脱物总黄酮含量、浸膏得率、对Aβ25-35诱导损伤PC12细胞的存活率、细胞形态及拮抗炎症因子的能力,发现TFE-40%组总黄酮浓度(91.12%)和浸膏得率(23.17%)的综合评分高于其他各组;20 μmol·L-1Aβ25-35作用于PC12细胞24 h后,细胞碎片增多,细胞间隙增大,细胞活力明显下降,细胞形态明显受损,当蔷薇红景天TFE不同体积分数乙醇洗脱物干预后,发现TFE-40%组与TFE-60%组中细胞形态得到明显改善,细胞存活率明显上升。
SOD属于抗氧化酶类,通过清除自由基及减少过氧化物的生成而发挥抗氧化损伤的作用,其水平高低可间接反映自由基含量的高低;当PC12细胞受到具有神经毒性的Aβ蛋白损伤后,细胞膜通透性增加而致LDH从细胞质中溢出,反映出细胞受损的程度。本研究结果显示20 μmol·L-1Aβ25-35诱导损伤PC12细胞的存活率和SOD水平均显著下降,LDH漏出量显著升高,而蔷薇红景天TFE不同体积分数乙醇洗脱物干预后,可不同程度地提高PC12细胞存活率和SOD水平,降低LDH漏出量;提示蔷薇红景天TFE不同体积分数乙醇洗脱物可能会通过促进PC12细胞生成SOD而清除氧自由基,通过降低LDH漏出量而维持细胞膜的完整性,其中TFE-40%洗脱物组的作用强于其他各洗脱物组。
PC12细胞来源于大鼠肾上腺髓质嗜铬瘤细胞,其细胞形态、结构、功能与神经元细胞相似,因此,在AD的炎症反应和氧化应激损伤研究中,通常选择Aβ诱导的PC12细胞建立AD细胞模型[17-18]。有研究表明,Aβ引起的NLRP3炎症小体激活是AD患者和APP/PS1小鼠疾病进展中炎症反应的关键过程[19],过量堆积的Aβ蛋白斑块会激活NLRP3炎症小体分泌各种促炎症分子,如IL-1、IL-6、TNF-α、自由基和趋化因子等而损伤神经元[20]。已有研究证实在AD患者体内TNF-α、IL-1β、IL-6及COX-2等炎症因子的水平高于正常人[21],Aβ25-35诱导的炎症反应导致神经元细胞凋亡和突触损失,COX-2通过炎症信号、生长因子、缺氧等诱导致炎症反应加重[22],进而会加速Aβ的沉积和AD的进展[23]。本研究显示,20 μmol·L-1Aβ25-35诱导损伤PC12细胞后,刺激TNF-α、IL-1β、IL-6及COX-2等炎症因子的过度表达,进一步诱发加重炎症反应,细胞存活率下降,形态发生变化,突触减少。蔷薇红景天TFE不同体积分数乙醇洗脱物中,除TFE-0%组和TFE-20%组外,其他各洗脱物组均能明显降低TNF-α、IL-1β、IL-6及COX-2的水平,拮抗Aβ25-35诱发的炎性神经毒性,降低细胞凋亡,提高细胞存活率;且发现TFE-40%组抑制TNF-α、IL-1β、IL-6及COX-2的释放能力强于其他各洗脱物组。
综上所述,总黄酮浓度最高的蔷薇红景天TFE-40%可通过促进清除Aβ25-35诱导损伤的PC12细胞中的氧自由基,维持细胞膜的完整性,拮抗Aβ25-35诱发的炎性神经毒性,抑制细胞凋亡而起到保护损伤细胞的作用,TFE-40%中总黄酮含量可达91.12%,提示TFE-40%是以总黄酮为药效物质基础的具有保护受损神经细胞作用的活性部位,结合本课题组前期研究基础和洗脱溶剂极性大小推测,TFE-40%中主要为极性大的游离黄酮类、二氢黄酮类及其苷类成分。后续将进一步对TFE-40%在保护受损神经细胞作用机制及其活性成分方面进行深入研究,为开发蔷薇红景天在抗AD方面提供理论依据。
