浅表大血管复温对下肢骨折手术患者术中核心体温的干预效果
2024-03-14王丽吴建明路强胡秀玲邓言江
王丽 吴建明 路强 胡秀玲 邓言江
围术期低体温是麻醉手术患者常见并发症,可导致切口感染风险增加、术中出血量增多、代谢功能紊乱等一系列不良后果[1]。下肢骨折患者术前有不同程度的出血,对其凝血功能造成影响,同时止血药、麻醉药等进一步加速患者术中体温散失,增加了手术风险[2]。调查显示,下肢骨折手术患者围术期低体温发生率为50%~80%[3]。《围术期患者低体温防治专家共识》[4]指出,手术中应常规进行体温监测并采取有效地保温措施,以预防发生低体温。充气加温系统是英国国家卫生与临床优化研究所[5](national institute for health and care excellence,NICE)唯一推荐的术中主动加温装置,其通过加热系统将热量传导至保温毯,再通过气流交换作用为患者持续供热。为了扩大术中消毒和操作范围,一般将保温毯放在患者身下。根据充气加温系统说明书,保温毯需要紧贴皮肤,增加了皮肤热损伤风险[6]。另外,保温毯身下保温,接触部位组织受重力压迫导致受热不均匀,容易出现反跳性高热,甚至发生低血容量休克等严重并发症[7]。浅表大血管包括颈动脉、股动脉等,该部位血流丰富且流速快,能将热量快速带到机体核心,对维持体温的稳定具有一定作用[8]。在肿瘤射频消融中存在所谓“热沉降效应”(heat sink effect)[9],是指紧邻病灶组织存在大血管,消融的热量会被血液迅速传递身体内部。受此启发,本研究对下肢骨折手术患者进行浅表大血管复温,旨在观察对患者围术期低体温的预防效果。报道如下。
1 资料与方法
1.1 一般资料 选取2021年10月至2023年4月阜阳市中医医院收治的80例下肢骨折患者作为研究对象。按照随机数字表法,患者分为试验组和对照组,每组40例。2组患者性别比、年龄、体重指数、骨折部位等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经阜阳市中医院医学伦理委员会批准。见表1。
1.2 纳入与排除标准 (1)纳入标准:①年龄≥18岁;②下肢骨折,择期手术;③术前体温36~37.5℃;④能耐受椎管内麻醉;⑤取得患者或监护人同意,签署知情同意书。(2)排除标准:①凝血功能异常或合并严重血液疾病;②急诊手术者;③广泛性皮肤病或其他可能影响体温调节的疾病;④术前已存在压力性损伤。
1.3 方法 所有手术由同一小组完成,2组患者均给予常规围术期护理:(1)术前对患者进行手术宣教,介绍手术流程和操作要求,给予患者心理疏导,缓解其紧张、恐惧情绪。(2)手术开始前,调节室温22~24℃,相对湿度40%~60%,开启输液加温器至37℃,术中输液和冲洗液均加温至37℃。患者进入手术室后,建立静脉通路,连接生命监护仪,监测血氧饱和度、血压、呼吸等生命体征。患者取健侧卧位,覆盖棉被,皮肤消毒及建立手术无菌区时,尽量减少非必要皮肤暴露。采用椎管内麻醉,麻醉满意后给予面罩供氧,麻醉师全程观察患者体征变化。(3)手术结束待患者苏醒后,将患者转运至病房,与病区护士做好交接工作,向患者家属讲解术后注意事项。
1.3.1 对照组采用全身保温毯身下保温,具体操作方法:将无菌型外科保温毯(Bair Hugger 630型,3M公司)平铺于手术床最上层,接口处连接暖风机。患者卧在手术床上即开始启动暖风机,设定温度为38℃,预保温30 min,术中根据患者核心体温及时调节暖风机温度。
1.3.2 试验组采用浅表大血管复温,具体操作:将医用一次性包布(规格:100 cm×100 cm)卷成空心圆柱体,其直径大小与暖风机出风口管道直径相匹配(约7.0 cm),卷3圈后多余部分折叠并放在一侧(多余包布不与皮肤接触)。将卷成圆柱状的包布一端塞入暖风机出风口管道,塞入长度约30~40 cm,避免吹暖风时包布脱落。患者卧在手术床后,在颈部浅表大血管处环绕圆柱状包布(若患者实施颈内静脉穿刺,则在穿刺后环绕包布)。暖风机预保温时间、温度设置、风速以及仪器型号等同对照组。
1.4 观察指标 (1)核心体温。巡回护士于患者入室时、开始麻醉时、手术开始时、术中30 min、术中1 h、手术结束时,使用生命监护仪的体温探头连续监测患者鼻咽温,同时记录患者低体温(患者从进入手术室至转入病房期间核心体温<36℃[10])发生率。(2)血乳酸值。分别于手术开始时、术中30 min、术中1 h、手术结束时采集患者动脉血,利用便携式血气分析仪测量各时段血乳酸值。(3)临床指标。记录患者手术时间、术中失血量、以及寒战发生率。寒战:护士采用床边寒战评估量表[11](bedside shivering assessment scale,BSAS)评估患者的寒战发生情况,0级代表无颤抖;1级代表轻度颤抖,集中在颈部和面部;2级代表中度颤抖,包括上肢肌群;3级代表重度颤抖,包括全身部位。1级、2级、3级判定为寒战。
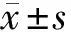
2 结果
2.1 2组不同时间核心体温变化情况 2组患者核心体温的组间和时间主效应差异均有统计学意义(P<0.05),提示患者核心体温随时间变化而变化,不同干预措施对患者核心体温变化的影响不同;但2组患者核心体温的组间和时间交互效应无统计学意义(P>0.05)。具体时间比较,入室时、开始麻醉时、手术开始时,2组核心体温差异无统计学意义(P>0.05);术中30 min、术中1 h、手术结束时,试验组核心体温高于对照组,差异有统计学意义(P<0.05)。见表2。
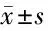
表2 2组不同时间核心体温变化比较 n=40,℃,
2.2 2组不同时间血乳酸变化情况 2组患者血乳酸的组间和时间主效应均有统计学意义(P<0.05),提示患者乳酸随时间变化而变化,不同干预措施对患者乳酸变化的影响不同。手术开始时、术中30 min,2组乳酸差异无统计学意义(P>0.05);术中1 h、手术结束时,试验组乳酸[(1.27±0.34)mmol/L,(1.46±0.45)mmol/L]低于对照组[(1.51±0.36)mmol/L,(1.80±0.48)mmol/L],差异有统计学意义(P<0.05)。见表3。
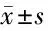
表3 2组不同时间血乳酸变化比较 n=40,mmol/L,
2.3 试验组和对照组临床指标比较 2组患者手术时间、术中失血量等差异无统计学意义(P>0.05);试验组低体温、寒战发生率低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 2组临床指标比较 n=40
3 讨论
多种因素可增加下肢骨折患者术中低体温发生风险。(1)出血的影响。下肢骨折术前存在出血情况,并且各器官血管丰富程度不一样,血流降温时身体核心器官之间温度可经血液循环相互影响,导致体温持续降低,最终引发术中低体温[12]。(2)麻醉的影响。下肢骨折手术多采用椎管内麻醉,麻醉阻断了温度通过传入神经达到中枢,造成体温调节中枢失灵,最终导致血管扩张,加重体温的丢失[13]。另外,肌松药的使用也会抑制产热,造成热反应阈值上升,冷反应阈值降低,身体产热减少和散热增加,引起体温持续降低[14]。(3)手术室环境的影响。虽然手术室温度一般控制在22~24℃,但骨折手术多在层流手术室完成,此类型手术室空气流动速度快,加速体温散热,最终导致机体核心温度降低。本研究结果显示,2组患者核心体温随手术时间延长逐渐降低。充气加温系统由暖风机和保温毯组成,通过热辐射作用持续为机体提供热量,从而减少体温散失。但是大量研究表明[6-7,15],保温毯保温效果不稳定,患者术中体温波动大。保温毯需要紧贴皮肤,其接触面积约占身体总表面积的15%[16],接触部位受重力影响,局部血液循环差,难以将热量带到身体核心部位。
浅表大血管血流丰富,可以将热量迅速传导至身体内部。研究表明,对颈部动脉等部位进行热疗,可以使热量通过大动脉血流较快循环至全身,达到改善微循环和有效复温的目的[17]。本研究结果表明浅表大血管复温可维持下肢骨折患者术中体温的平稳,降低低体温发生风险。可能与以下原因有关:颈动脉血流快速流动,能迅速带走主动加温系统所产生的热量,通过“热沉降效应”持续为身体核心提供热量,当热量散失和吸收达到平衡时,即可维持核心体温的稳定[9]。研究证实,将冰袋置于颈动脉等大血管部位,能迅速降低体温,其原理即是通过大血管血液流动达到降温的目的[18]。
血乳酸是组织代谢、血液循环状态的敏感指标。主动升温过程中,核心体温波动大,可导致重要器官发生再灌注损伤,引起循环乳酸含量增加[19]。本研究结果显示,术中1 h、手术结束时试验组乳酸明显低于对照组,表明浅表大血管复温效果更好,能最大程度避免升温过程中出现的器官再灌注损伤。刘宇权等[20]也证实,保温毯受热不均匀,患者末梢升温快,导致末梢血管扩张,含有大量乳酸的血液回流到心脏,可导致心律失常。浅表大血管复温快,热量通过大血管传导至身体内部,使核心体温以均匀的速度上升,可以有效避免体温反跳升高的风险。研究表明低体温可造成凝血紊乱,表现为凝血障碍和纤溶亢进,导致术中出血量增加[21]。但本研究结果显示,试验组术中输血量低于对照组,但2组间差异无统计学意义(P>0.05)。推测可能因为本研究样本量少,无法在统计学上体现失血量的差异。
综上所述,浅表大血管复温可有效维持下肢骨折患者核心体温的稳定,降低低体温发生风险,是一种安全、有效地术中保温措施。
