富含植物乳杆菌的普洱熟茶品质分析
2024-03-13伯年国刘琨毅李若愚王藤梁正维沙艮陈思琴陈红艳马燕赵明
伯年国,刘琨毅,李若愚,王藤,梁正维,沙艮,陈思琴,陈红艳,马燕 ,赵明
(1.云南农业大学 茶学院,食品科学技术学院,云南 昆明 650201;2.云南农业大学 云南省药用植物生物学重点实验室,西南中药材种质创新与利用国家地方联合工程研究中心,云南 昆明 650201;3.宜宾职业技术学院 五粮液技术与食品工程学院,四川 宜宾 644100)
植物乳杆菌(Lactobacillusplantarum)不仅是一种存在于发酵乳制品、谷物等食品中的乳酸菌[1-2],而且是一种具有调节免疫功能与肠道功能等生理功效的微生物[3-4]。植物乳杆菌可以提高食品风味、改善食品品质,因此广泛应用于发酵食品的生产[5]。例如,Ge 等[6]利用植物乳杆菌与酿酒酵母共同发酵小麦面条,结果表明,共同发酵改善了小麦面条的面筋网络结构,提升了小麦面的风味。王紫琳等[7]利用植物乳杆菌发酵雪莲果,开发了一款特色雪莲果植物发酵饮料。马晓娟等[8]研究发现,经植物乳杆菌发酵后枸杞浆的风味得到明显改善,抗氧化活性显著提升。邓成林等[9]利用植物乳杆菌发酵绿茶饮料显著提升了其风味及口感,增强了绿茶饮料的抗氧化活性。冯雪娜等[10]利用植物乳杆菌发酵红茶饮料,发现发酵后红茶饮料的挥发性风味物质增加,营养成分更加丰富,极大提升了口感。因此,植物乳杆菌是一种益生菌,可以维持人体肠道菌群的稳态,增强肠道免疫系统,同时也是一种能提高发酵食品品质的发酵剂。
普洱熟茶是以云南大叶种茶树[(Camelliasinensisn.)var.assamiea(Masters)Kitmaura]的一芽二叶或三叶制成的晒青茶为原料,经微生物后发酵而成的茶产品[11]。微生物发酵是普洱熟茶加工的关键步骤[12],不仅形成了普洱熟茶滋味醇和、汤色红褐、陈香显著的风味[13],而且决定了普洱熟茶具有降脂减肥、抗氧化、抗肿瘤、保护神经损伤、抑制α-葡萄糖苷酶等功能[14-16]。已有研究表明植物乳杆菌参与了普洱熟茶发酵。郝彬秀等[17]总结了参与普洱熟茶发酵的微生物,发现霉菌(黑曲霉、米曲霉、青霉等)、酵母(Blastobotrysadeninivorans、酿酒酵母等)、细菌(凝结芽孢杆菌、枯草芽孢杆菌、植物乳杆菌等)是主要微生物。Bian 等[18]研究发现,普洱熟茶发酵过程中乳酸杆菌科、嗜热霉属、芽孢杆菌科等细菌可以将不溶性多糖分解并生成具有多种生物活性的2 型单糖和影响茶叶滋味的羧酸。李晨晨等[19]研究发现普洱熟茶发酵过程中存在大量嗜热细菌,例如植物乳杆菌、凝结芽孢杆菌、枯草芽孢杆菌、地衣芽孢杆菌、乳酸片球菌等细菌。发酵中存在植物乳杆菌,表明普洱熟茶具有开发为富含益生菌产品的潜力。
强化发酵(enhanced fermentation,EF)是将一种外源微生物接入到未经灭菌的原料中进行发酵,进而提高发酵产品品质的一种方式[20]。前期通过接种产黄青霉P1、地衣芽孢杆菌L1、接种伞枝犁头霉A1、阿曲霉A1 强化发酵普洱熟茶,发现接菌发酵提高了茶褐素和可溶性糖含量,降低了儿茶素、儿茶素没食子酸酯、表儿茶素、没食子儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯和表没食子儿茶素含量,茶汤的甜味和厚重感分数增加,苦味、涩味和酸味分数降低提升了茶叶品质[21-24]。本研究从普洱熟茶中分离鉴定得到的植物乳杆菌接种于普洱熟茶发酵中进行强化发酵,分析发酵样品的感官品质特征、化学成分及微生物群落结构,以期应用该菌生产出一款富含植物乳杆菌的普洱熟茶。
1 材料与方法
1.1 材料与试剂
晒青毛茶(一芽三叶)原料:普洱市茶叶科学研究所;没食子酸(gallic acid,GA)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin-3-gallate,ECG)、儿茶素(catechin,C)、表儿茶素(epicatechin,EC)、表没食子儿茶素没食子酸酯(epigallocahechin-3-gallate,EGCG)、儿茶素没食子酸酯(catechin-3 - gallate,CG)、没食子儿茶素没食子酸酯(gallocahechin-3-gallate,GCG)、没食子儿茶素(gallocatechin,GC)、咖啡碱(caffeine,CA)、鞣花酸(ellagic acid,EA)、木犀草素(luteolin,Lut)、杨梅素(myricetin,Myr)、槲皮素(quercetin,Que)、山奈酚(kaempferol,Kea)、茶碱(theophylline,Theo)、花旗松素(taxifolin,Tax)、芦丁(rutin,Rut)标准品:成都曼思特生物科技有限公司;细菌DNA提取试剂盒:北京诺禾致源科技股份有限公司;甲醇、乙腈(均为分析纯):美国TEDIA 试剂公司;磷酸、盐酸(均为分析纯):成都市科龙化工试剂厂;MRS 肉汤培养基:广东环凯微生物科技有限公司;DNA 聚合酶(2×Rapid Taq Master Mix):南京诺唯赞生物科技公司。
1.2 仪器与设备
756CRT 型紫外可见分光光度计:上海菁华科技仪器有限公司;CP214 型电子分析天平:上海奥豪斯仪器有限公司;CT15RE 型离心机:日本日立公司;101A-2型电热鼓风恒温干燥箱:上海市崇明实验仪器厂;CS-2000 型高速多功能粉碎机:武义海纳电器有限公司;SW-CJ-1B 型超净工作台:苏州安泰空气技术有限公司;1200 型高效液相色谱[配有TSKgel ODS-80TM 色谱柱(4.6 mm × 250 mm,5 μm)]:美国安捷伦公司;Trident 960 型基因扩增仪:上海力新仪器有限公司;DW-86L626 型医用低温保存箱:青岛海尔生物医疗股份有限公司;YS6060 型色差仪:深圳市三恩时科技有限公司;XB.K.25 型血球计数板:上海求精生化试剂仪器有限公司。
1.3 试验方法
1.3.1 植物乳杆菌PET003 分离鉴定
对从普洱熟茶中分离纯化得到的菌株进行了形态学观察,并进行16S rRNA 基因序列测序分析。
1.3.2 植物乳杆菌PET003 强化发酵普洱熟茶试验
参照文献[21-24]的方法,称取30 kg 晒青毛茶,量取茶样质量30% 的纯净水进行潮水静置一夜。将茶叶装入发酵筐(50 cm×40 cm×60 cm),每隔5 d 翻堆一次,25 d 后发酵完成。前期研究发现第20 天时接菌发酵的普洱熟茶品质最好,因此,本研究在第20 天时取出5 kg 茶叶,接入茶叶质量0.1% 的植物乳杆菌PET003发酵剂置于底层。用纱布将其与其他未接菌的隔开一同静置发酵,25 d 时结束发酵。采用5 点取样法取样,-80 ℃贮藏备用;将未接入植物乳杆菌PET003 的样品命名为CK,接入植物乳杆菌PET003 强化发酵的样品命名为EF,每组样品进行3 个重复。
1.3.3 高通量测序分析微生物多样性
使用细菌DNA 提取试剂盒来提取茶样中的细菌DNA,并利用DNA 聚合酶与引物338F 和806R 进行聚合酶链式反应,反应产物在北京诺禾致源科技股份有限公司进行基因测序。
1.3.4 乳杆菌菌落计数
采用GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》检测方法对茶样中乳杆菌属进行计数。
1.3.5 茶叶化学成分测定
参照GB/T 8305—2013《茶水浸出物测定》、GB/T 8314—2013《茶游离氨基酸总量的测定》、GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》的方法分别测定水浸出物(water extracts,WE)、游离氨基酸(free amino acids,FAA)、茶多酚(tea polyphenols,TP)的含量。采用蒽酮硫酸法[21]测定可溶性糖(soluble sugars,SS),采用萃取比色法[25]测定茶红素(thearubigins,TR)、茶黄素(theaflavins,TF)及茶褐素(theabrownins,TB)的含量。采用高效液相色谱法定量茶样中儿茶素组分含量[26]。
1.3.6 茶样感官审评
5 位具有评茶资格的人员(3 女2 男),根据GB/T 23776—2018《茶叶感官审评方法》对茶叶样品进行感官审评。
1.3.7 定量描述分析
使用定量描述分析法对茶汤的滋味特征进行评价,其中包括苦味、涩味、酸味、甜味和醇厚感这5 个属性。每个属性的评分范围从0~9,其中0 表示较弱,9 表示较强[27]。同时,使用YS6060 型色差仪来测定茶汤的颜色。
1.4 数据处理
使用IBM SPSS Statistics 22.0 软件进行数据处理和统计分析,数值以平均值加减标准差的形式表示。采用GraphPad Prism 8 软件进行主成分分析。使用TBtools 1.09854 绘制归一化后的数据的聚类热图。
2 结果与分析
2.1 植物乳杆菌的分离鉴定结果
菌株PET003 的菌落形态及微观特征见图1 与图2。

图1 菌株PET003 的菌落形态Fig.1 Colony morphology of strain PET003

图2 菌株PET003 的革兰氏染色显微观察Fig.2 Gram staining microscopic observation of strain PET003
由图1 可知,将菌株接种到MRS 培养基中培养2 d 后,菌落形态呈圆形、乳白色、表面光滑凸起、边缘整齐、不透明的菌落。由图2 可知,经革兰氏染色后均为紫色,呈杆状或棒状,单个或成链状。
将菌株测序所得序列与NCBI 数据库进行比对,选择模式物种进行建树分析,结果如图3 所示。菌株PET003 与LactiplantibacillusplantarumATCC_14917 聚为一支,因此将PET003 鉴定为植物乳杆菌。

图3 细菌16S rRNA 基因序列系统发育树Fig.3 Phylogenetic tree of bacterial 16S rRNA gene sequence
2.2 发酵样品植物乳杆菌数量
各茶样植物乳杆菌菌落数见表1。

表1 各茶样植物乳杆菌菌落数Table 1 Lactiplantibacillus plantarum colony number in tea samples
由表1 可知,应用平板计数法分析接菌发酵样的菌落为2.07×106CFU/g,显著高于对照样(6.00×105CFU/g,P<0.05)。由此可知接入植物乳杆菌强化发酵过程中,植物乳杆菌可以存活,并作用于发酵过程,更重要的是,干燥后存在大量植物乳杆菌,表明开发了一款富含植物乳杆菌的普洱熟茶。
研究发现,在传统发酵过程中,细菌的片球菌属、芽孢杆菌属、短状杆菌属、欧文氏菌属、特布尔西菌属、乳杆菌属占优势地位,同时乳杆菌属呈现出在第一、二次翻堆时增加随后开始减少、出堆时增加的趋势[28]。因此,植物乳杆菌在普洱熟茶出堆后还大量存在。本研究为了进一步研究接入植物乳杆菌PET003 强化发酵普洱熟茶出堆样中乳酸菌的生长情况,应用Illumina MiSeq 测序技术,测定16S rRNA 基因序列,对操作分类单元(operational taxonomic units,OTU)进行鉴定,结果见图4。发酵样品细菌目水平群落结构如图5所示。
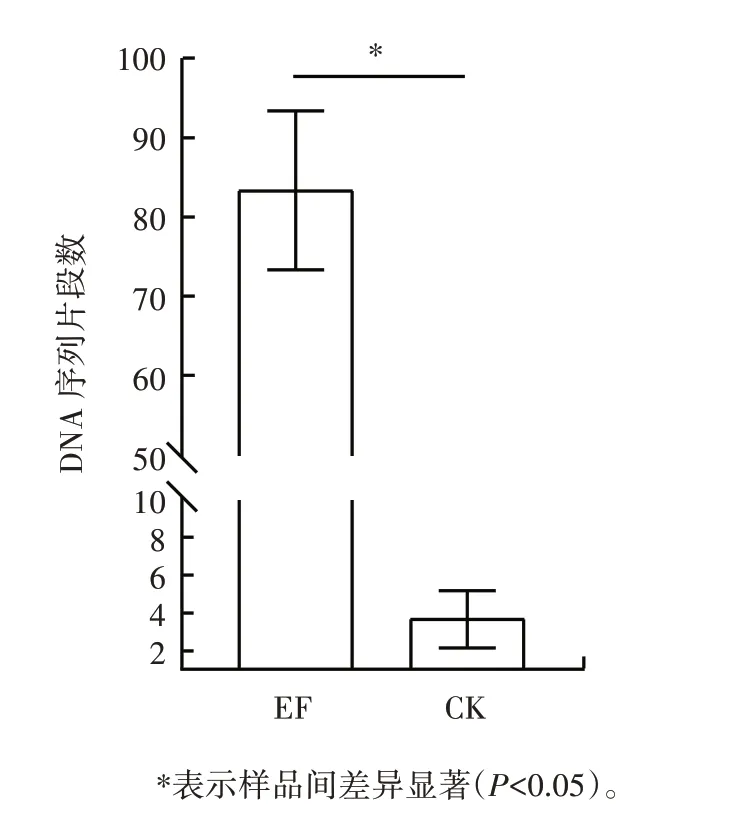
图4 EF 与CK 乳杆菌属(Lactobacillus)DNA 序列片段数柱状图Fig.4 Column graph of Lactobacillus reads in tea samples with enhanced fermentation(EF)and control fermentation(CK)
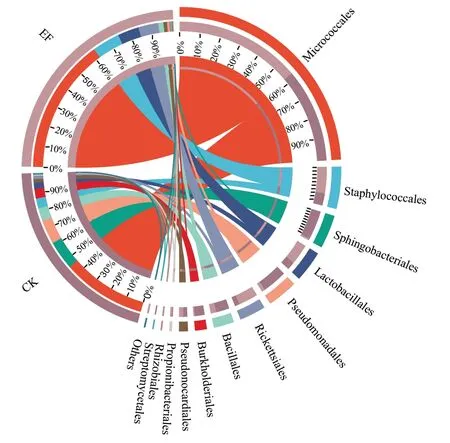
图5 EF 与CK 细菌目水平群落结构图Fig.5 Community structure of bacteria in tea samples with enhanced fermentation(EF)and control fermentation(CK)
由图4、图5 可知,强化发酵样品中归为乳杆菌属(Lactobacillus)的DNA 序列片段数显著增加(P<0.05),表明接菌发酵增加了植物乳杆菌的数量。接菌发酵样品的优势细菌主要是微球菌(Micrococcales)(62%)、Staphylococcales(13%)、乳杆菌目(Lactobacillales)(10%)。传统发酵样品的优势细菌主要是微球菌目(Micrococcales)(46%)、鞘脂杆菌目(Sphingobacteriales)(16%)、假单胞菌目(Pseudomonadales)(13%)。比较发现,接入植物乳杆菌PET003 发酵显著增加了乳杆菌目(Lactobacillales)、微球菌目(Micrococcales)的相对丰富度。而植物乳杆菌属于乳杆菌目(Lactobacillales),因此接入植物乳杆菌PET003 发酵改变了普洱熟茶发酵微生物群落结构,增加了植物乳杆菌的数量。
2.3 发酵茶叶品质
为评估发酵茶样品质,对样品进行审评结果见表2、图6~图8。

表2 传统发酵(CK)与强化发酵(EF)感官审评结果Table 2 Sensory evaluation results of tea samples with enhanced fermentation(EF)and control fermentation(CK)

图6 CK 的感官审评照片Fig.6 Sensory evaluation photos of control
由图6、图7 可知,样品茶汤均呈红褐色,但接菌发酵后茶汤颜色更深。由图8 可知,接菌发酵样的甜味(4.82±0.17)、醇厚感(6.82±0.19)显著高于传统发酵(P<0.05),涩味(1.19±0.15)、酸味(0.31±0.02)显著低于传统发酵(P<0.05),滋味更加醇厚顺滑、陈香持久无堆味。

图7 EF 的感官审评照片Fig.7 Sensory evaluation photos of enhanced fermentation

图8 发酵样茶汤的滋味特征Fig. 8 Taste characteristics of fermented tea soup
应用色差仪测定茶汤色差值的结果见图9。
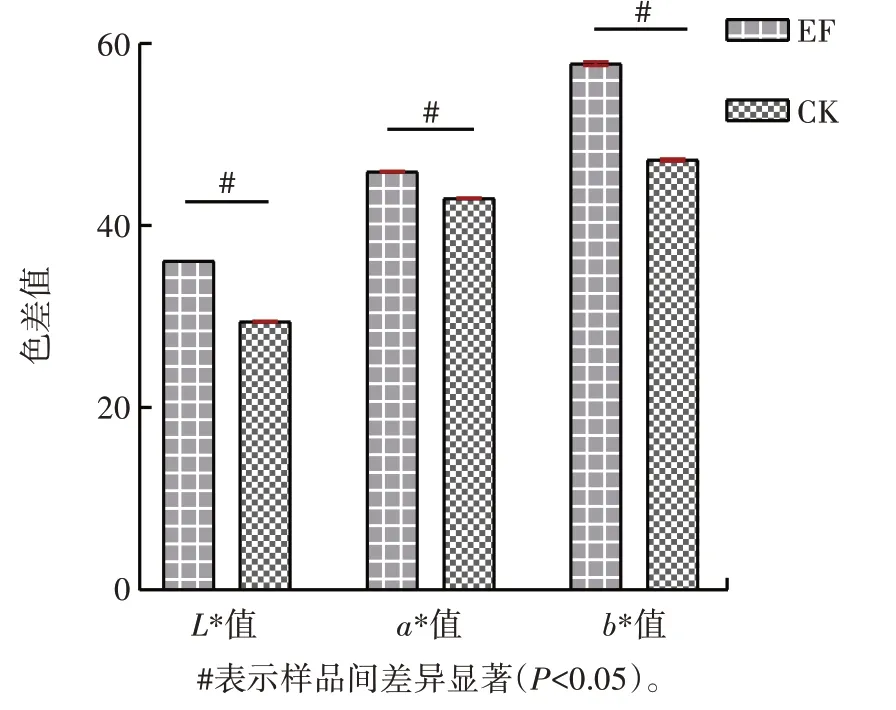
图9 发酵样品茶汤的颜色参数Fig.9 Color parameters of tea soup of fermented tea sample
由图9 可知,EF 的L* 值(36.13±0.00)、a* 值(45.92±0.05)和b* 值(57.79±0.18)显著高于CK(P<0.05),结果与审评结果相符。因此接入植物乳杆菌发酵增加了茶汤汤色。
茶样特征成分的结果见表3。

表3 发酵茶样特征成分含量Table 3 Contents of characteristic components of fermented tea samples
由表3 可知,EF 样品的可溶性糖(5.11±1.02)%、茶褐素(14.41±0.33)%、茶多酚(7.57±1.63)%、儿茶素(0.15±0.03)mg/g、儿茶素没食子酸酯(0.12±0.00)mg/g、咖啡碱(52.92±0.12) mg/g、没食子儿茶素(34.50±0.22)mg/g 和表儿茶素(0.13±0.04)mg/g 含量均显著高于CK(P<0.05)。有研究表明,可溶性糖、茶褐素、游离氨基酸、简单儿茶素含量与茶汤甜度和厚度呈正相关[29],因此,该结果与感官审评EF 茶汤色泽红褐,滋味的甜度与醇厚感高于CK 相符,与代祥青等[30]的研究结果一致。因此,植物乳杆菌PET003 强化发酵提高了普洱熟茶的风味品质。
3 结论
本研究从普洱熟茶中分离得到的植物乳杆菌PET003 在发酵第20 天时接种于茶样中进行强化发酵,发酵后样品的乳杆菌目(Lactobacillales)、微球菌目(Micrococcales)和植物乳杆菌属的DNA 序列片段数量增加,含2.07×106CFU/g 的植物乳杆菌。接菌发酵后茶样中可溶性糖、茶褐素、游离氨基酸、咖啡碱、儿茶素、表儿茶素、没食子儿茶素、儿茶素没食子酸酯的含量显著高于对照茶样,显著提升了茶叶的品质。因此,本研究开发了一种富含植物乳杆菌,且感官品质优良的普洱熟茶。
