乌牛早红茶对高脂饮食小鼠降脂功能和肠道菌群的调控作用
2024-03-12叶江成张一帆龚明秀俞晓平
叶江成,赵 进,张一帆,龚明秀,俞晓平
(1 中国计量大学生命科学学院 食品营养与质量安全研究所 杭州310018 2 生物计量与检验检疫技术浙江省重点实验室 杭州310018 3 特色农产品品质与危害物控制技术浙江省重点实验室 杭州 310018)
肥胖是一种多因素导致的代谢性疾病[1],它能引起各种慢性疾病,包括心血管疾病[2]、Ⅱ型糖尿病[3]、高血压[4]、高血脂[5]、脂肪肝[6]和癌症[7]等。世界卫生组织应用身体质量指数(Body mass index,BMI)来判断个体是否肥胖,并将超重和肥胖定义为一种损害健康的疾病,体现为异常或过多的脂肪堆积[8-9]。肥胖的本质是基于能量代谢不平衡所造成的脂肪堆积,减少能量摄入和增加能量消耗是影响肥胖的有效方法。目前,肥胖尚无有效的治疗手段,主要通过调节饮食、体育锻炼和药物干预[10]。肥胖治疗药物都有一定的副作用[11-12],如导致营养吸收障碍和神经问题等。预防或改善肥胖是当今重大的社会和科学问题。现今研究人员在分子水平对天然植物产品进行了广泛研究[13-14],其健康功效已逐渐被全球消费者接受和喜爱。功能性的食品作为膳食干预肥胖比药物治疗更受欢迎。
茶叶作为天然、无毒的安全产品,能够改善高胆固醇血症[15]、高血脂症[16]、高血糖[17]、非酒精性脂肪肝[18-19],并具有调节机体脂质代谢的功效[20-21]。Pan 等[22]研究发现英红九号红茶能够减少小鼠的摄食量,并可能通过LKB1/AMPK 途径调节脂肪生成来预防肥胖。Pan 等[23]的研究发现红茶多酚在预防肥胖方面比绿茶多酚更为有效,其能够抑制脂质和糖类物质的吸收;通过AMPK 途径促进脂质代谢,抑制前脂肪细胞的分化和增殖减少脂质积累;还能减少氧化应激来干预肥胖及代谢综合征。此外,大量研究[24-26]表明通过高脂饮食建立的动物肥胖模型,其肠道菌群发生了显著变化,高脂饮食导致的肥胖及其代谢紊乱可能与肠道菌群组成及其相对丰度的变化有关。研究发现去咖啡碱的红茶多酚诱导肥胖小鼠肠道菌群的改变和短链脂肪酸的增加,并促进肝脏AMPK 磷酸化水平增加,最终对于高脂饮食肥胖小鼠起到降脂减肥的作用[27]。
乌牛早是中国茶叶的地区特色品种,原产地是浙江永嘉县,是中国茶类中特早发芽的品种,比西湖龙井等早1 个月,每年3 月初即可采制大量上市,深受消费者青睐。关于乌牛早红茶的抗肥胖健康效应研究尚未见报道,其干预肥胖及其脂质代谢的功效机理也不清楚。本研究以高脂饮食诱导C57BL/6 小鼠建立肥胖模型,探究乌牛早红茶水提物预防高脂血症肥胖小鼠的分子机理,以及调节小鼠肠道菌群结构的干预作用等。
1 材料与方法
1.1 材料与试剂
乌牛早鲜叶采集时间为2021 年5 月1 日,在浙江三农茶业有限公司按照红茶加工工艺制作而成乌牛早红茶制品。8 周龄雄性SPF 级C57BL/6小鼠,2021 年11 月1 日购于杭州子源实验动物科技有限公司,使用及生产许可证号为SYXK(浙)2018-0009。
无水乙醇(AR)、氯化钙(AR)、氯化钠(AR)、磷酸二氢钾(AR)、三水合磷酸氢二钾(AR)、十二水合磷酸氢二钠(AR)、碱式乙酸铅(AR)、盐酸(AR)、硫酸(AR)、福林酚(AR)、碳酸钠(AR)、茚三酮(AR)、苯酚(AR)、谷氨酸(AR)、甲醇(HPLC)、乙腈(HPLC)等试剂,杭州米可化工仪器有限公司;表没食子儿茶素没食子酸酯(EGCG)、表没食子儿茶素(EGC)、表儿茶素(EC)、没食子儿茶素(GC)、表儿茶素没食子酸酯(ECG)等,上海源叶生物科技有限公司;Bradford 法蛋白浓度测定试剂盒,北京索莱宝生物有限公司;小鼠血清和肝组织检测生化指标,如总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、谷草转氨酶(AST)和谷丙转氨酶(ALT)检测试剂盒,南京建成生物工程研究所;TRIzolPlus RNA 纯化试剂盒购,Thermo Fisher 公司。
1.2 仪器与设备
DK-8D 三温三控水槽,上海博迅实业有限公司医疗设备厂;台式低速自动平衡离心机L400,湖南湘仪实验室仪器开发有限公司;UV-5200 紫外-可见分光光度计,上海元析仪器有限公司;FA1004 电子天平,上海舜宇恒平科学仪器有限公司;高效液相色谱,沃特世公司;美国MD 全波长酶标仪Spectra Max190,北京嘉鹏同创科技发展有限公司;SHZ-D(III)型循环水真空泵,邦西仪器科技(上海)有限公司;电热恒温干燥箱,上海叶拓仪器仪表有限公司;超声波清洗器,上海生析超声仪器有限公司。
1.3 方法
1.3.1 茶叶主要功能成分的测定 乌牛早红茶主要成分检测指标为:水分、水浸出物、咖啡碱、茶多酚及其儿茶素、茶黄素、游离氨基酸、可溶性糖、可溶性蛋白和总黄酮含量。参考方法依次分别为:GB 5009.3-2016《食品安全国家标准 食品中水分的测定》中的直接干燥法[28]、GB/T 8305-2013《茶水浸出物测定》[29]、GB/T 8312-2013《茶 咖啡碱测定》中的紫外分光光度法[30]、GB/T 8313-2018《茶叶中茶多酚和儿茶素类含量的检测方法》[31]、GB/T 30483-2013《茶叶中茶黄素的测定 高效液相色谱法》中的高效液相色谱法[32]、GB/T 8314-2013《茶游离氨基酸总量的测定》[33]、硫酸苯酚法[34]、考马斯亮蓝染色法,以及超声辅助提取总黄酮后三氯化铝法检测[35]。
1.3.2 茶叶水提物的制备 参照Li 等[36]的方法,用95 ℃热水按料液比1 ∶20 浸提乌牛早红茶5 min,立即通过减压抽滤水提取物并收集滤液,然后在-55 ℃条件下真空冷冻干燥24 h,制备茶水提取物冻干粉,后续根据动物实验方案配置相应浓度茶汤进行小鼠灌胃。
1.3.3 动物实验方案设计 30 只8 周龄雄性C57BL/6 小鼠,统一安置在常规环境(12 h 光/暗循环)中,自由取食饮水适应性喂养1 周,按小鼠体质量随机分为3 组:正常组(NC)、模型组(MC)、乌牛早红茶水提物干预组(WBT);NC 组以普通饲料作为食物,MC 组和WBT 组以高脂肪饲料(D12492,含有60%脂肪热量)作为食物;WBT 组水提物冻干粉配制液(以蒸馏水溶解)的灌胃质量浓度为3 mg/mL,灌胃剂量为0.2 mL,NC 组和MC组灌胃等量生理盐水,定时记录各组小鼠的食物摄入量和体质量变化。
1.3.4 小鼠葡萄糖耐受实验 在小鼠饲养实验第5 周,将3 组小鼠进行禁食12 h 后口服葡萄糖,观察其耐受实验情况。按照2 g/kg bw 剂量灌胃小鼠20%葡萄糖溶液后,分别在0,15,30,60 min 和120 min 时间点采集小鼠尾静脉血样,应用罗氏血糖仪和检测试纸条测定相应时间点的小鼠血糖值。
1.3.5 小鼠血清和肝脏生化指标检测 将小鼠全血经过离心(4 ℃,3 000 r/min,10 min)得到血清样本(-80 ℃保存),分别测定小鼠血脂和肝组织指标,如TG、TC、LDL-C 和HDL-C 含 量,AST 和ALT 酶活性。
1.3.6 小鼠肝组织苏木精和伊红(HE)染色 参考Xu 等[37]的方法,采集小鼠肝脏同一部位,将其在中性福尔马林缓冲液中固定24 h,石蜡包埋切片后,使用苏木精和伊红(HE)对切片进行染色,组织病理学观察和分析结果。
1.3.7 实时荧光定量PCR 分析 从肝脏中提取总RNA,并使用RNase-Free DNase Set(Qiagen)来去除DNA 污染。然后使用Nanodrop 2000 紫外-可见分光光度计(Beckman)对RNA 浓度进行分光光度测量。使用SuperScriptTMIII First-Strand Synthesis SuperMix(Thermo)将总RNA 转化为单链cDNA,并使用Power SYBRGreen PCR Master Mix(Applied Biosystems)进行实时PCR。反应条件:预变性95 ℃,1 min;变性95 ℃,15 s,退火和延伸63 ℃,25 s。使用比较循环阈值(ΔΔCt)方法对各基因的相对表达水平进行统计分析。
1.3.8 蛋白质印迹法 参考Li 等[38]的方法,采用蛋白质印迹技术分析小鼠肝组织脂质代谢相关蛋白质表达情况。通过SuperSignalWest Dura Extended Duration Substrate 进行显影和定影,使用Image J 1.8.0 图像处理软件(美国)分析条带的光密度值,每个条带重复3 次,目的蛋白相对表达量={目的蛋白(光密度值)/内参(光密度值)}×10n进行表示。
1.3.9 肠道菌群分析 采集小鼠结肠粪便,通过16S rRNA 基因高通量测序得到操作分类单元(OTUs)(根据16S rRNA 基因序列相似度聚类得到的一组相似的序列),通过使用Usearch 软件(5.2 版)进行OTU 聚类分析,并对其进行分类学注释特征性序列和微生物多样性分析。
1.4 数据分析
数据通过SPSS 20.0 进行单因素方差分析,P<0.05 为显著水平。
2 结果与分析
2.1 乌牛早红茶主要功能成分及其组分含量检测
乌牛早红茶主要功能成分及其组分含量检测结果如表1 所示,茶多酚为(12.07±0.13)%、咖啡碱为(3.51±0.07)%、游离氨基酸为(6.16±0.10)%、可溶性糖为(1.27 ± 0.04)%、总黄酮为(0.70 ±0.01)%、可溶性蛋白为(2.76±0.08)%、水分含量为(4.19 ± 0.02)g/100 g、水浸出物为(39.99 ±0.35)%。

表1 乌牛早红茶主要功能成分及其组分含量检测结果Table 1 Main functional components content of Wuniu Zao black tea
由于红茶制作工艺的不同,儿茶素含量较少,总量仅为(1.81 ± 0.05)%,其中EGCG 含量最高(0.77±0.02)%,其余成分含量依次为ECG(0.66±0.02)%,EC(0.14±0.01)%,C(0.14±0.01)%,EGC(0.12±0.01)%。茶黄素[39]是一种红茶特有的水溶性色素,在红茶的制作过程中,茶多酚(主要是儿茶素)类物质首先被氧化成醌,然后进一步氧化和聚合成茶黄素。乌牛早红茶的茶黄素总量为(0.47± 0.80)%,其中含量最高的是TF-3-G(0.22 ±0.25)%,其余成分含量依次为TFDG(0.11 ±0.25)%、TF-3'-G(0.07 ± 0.15)%、TF(0.05 ±0.02)%。
2.2 WBT 对肥胖小鼠体质量、能量摄入量、脏器指数和Lee’s 指数的影响
由图1 和表2 可知,经过9 周高脂饮食C57BL/6 小鼠肥胖模型造模成功。图1 为小鼠及其肝组织、附睾白色脂肪、体质量和能量摄入结果,表明NC、MC 和WBT 共3 组小鼠在体型、肝脏和附睾白色脂肪的大小具有明显的区别。MC 组小鼠肝脏呈现异常的灰色和肝脏肿大,这是由于MC 组小鼠长期高脂饮食导致肝脏脂肪变性;而WBT 组小鼠肝脏与NC 组相似,这表明在WBT 的干预下,高脂饮食导致的小鼠肝脏脂肪变性有被抑制的作用。小鼠的肝脏系数显示MC 组的肝脏指数显著大于NC 组和WBT 组(P<0.05),也证实了WBT 具有改善小鼠肝脏脂肪变性和肝脏肿大的作用。

图1 小鼠体型、肝组织、附睾白色脂肪组织、体质量、能量摄入量的变化Fig. 1 Changes in body size,liver tissue,epididymal white adipose tissue,body weight,and energy intake of mice

表2 小鼠的脏器指数、Lee's 指数、初始体质量、最终体质量和增加体质量Table 2 Organs index,Lee's index,initial body weight,final body weight and weight gain of mice in each group
表2 为小鼠的脏器指数、Lee’s 指数、初始体质量、最终体质量和增加体质量。由表2 可以得到结果,高脂饲料能够显著增加小鼠(C57BL/6)的体质量(P<0.05),MC 的小鼠终体质量远高于NC 的终体质量(P<0.05),WBT 的小鼠最终体质量也与MC 具有显著差异(P<0.05)。图1c 为3 组小鼠每日能量摄入量,MC 组远高于NC 组和WBT 组。另外,由表2 中小鼠心脏指数、脾脏指数、肾脏指数和Lee’s 指数结果,均显示MC 和NC 具有显著差异(P<0.05),而WBT 小鼠的心脏指数、脾脏指数、肾脏指数和Lee’s 指数也与MC 组具有显著差异性(P<0.05),说明WBT 能够抑制高脂饮食导致的脏器脂肪变性增加,有效干预高脂饮食引起的小鼠体重和脏器脂肪增加的趋势。
2.3 WBT 对肥胖小鼠葡萄糖耐受的影响
高脂饮食的小鼠和肥胖患者一样往往具有葡萄糖耐受功能受损的现象。为探究WBT 调节血糖水平效应,在小鼠饲养实验第5 周进行口服葡萄糖耐量实验。表3 为口服20%葡萄糖溶液后各组小鼠的血糖含量变化以及曲线下面积(AUC)。

表3 口服20%葡萄糖溶液后各组小鼠血糖变化以及曲线下面积(AUC)Table 3 Blood glucose changes and area under curve(AUC)of mice in each group after oral administration of 20% glucose solution
如表3 所示,MC 组小鼠的初始血糖含量与NC 组和WBT 组初始血糖含量具有显著差异(P<0.05),小鼠在口服20%葡萄糖溶液后,在第15,30,60 分钟和120 分钟的血糖含量均与NC 组和WBT 组具有显著差异性(P<0.05)。相对于单点的血糖值,糖耐曲线下面积能更全面清晰地分析血糖变化的程度,MC 组小鼠的AUC 远大于NC组(P<0.05),说明MC 组的小鼠糖耐受受损显著,WBT 具有显著降低高脂饲料饮食诱导的小鼠血糖水平和延缓AUC 增加的能力(P<0.05)。分析结果表明高脂饮食能引起小鼠葡萄糖耐受功能受损,糖脂代谢过程失衡,WBT 能显著改善糖脂代谢水平,具有干预高脂饮食对小鼠造成的葡萄糖不耐受症状的能力。
2.4 WBT 对肥胖小鼠血清生化指标的影响
小鼠血清的生化指标含量检测结果如图2 所示。MC 组小鼠血清中血脂指标(TC、TG 和LDLC)和肝功能指标(AST 和ALT 酶活性)上升明显,与NC 组相比差异显著(P<0.05);与MC 组相比,WBT 组小鼠血清指标如TC、TG 和LDL-C 含量皆表现显著性降低(P<0.05)。血清中的HDL-C 含量在3 组间无显著性差异,WBT 虽然增加了高脂饮食肥胖小鼠血清中的HDL-C 水平,但是无统计学意义(P>0.05)。同时,与MC 组相比,WBT 小鼠肝组织生化指标AST 和ALT 的含量显著性降低(P<0.05),表明WBT 能够有效抑制高脂饮食肥胖小鼠的血脂水平增加趋势,具有改善高脂饮食导致的小鼠肝损伤症状的作用。

图2 小鼠血清生化指标的检测结果Fig. 2 Detection results of serum biochemical indexes in mice
2.5 WBT 对肥胖小鼠肝脏脂质代谢的影响
如图3a 为小鼠肝脏组织切片的HE 染色结果,NC 组小鼠肝脏切片中细胞的染色状态红蓝清晰,细胞形态完整;MC 组的小鼠肝细胞排列不整齐,细胞之间存在较大体积的脂肪小空泡,可以观察部分明显固缩的细胞核;WBT 组小鼠肝脏切片显示肝细胞排列较整齐,主要表现为细胞之间脂肪空泡尺寸明显缩小,表明WBT 明显抑制了高脂饮食诱导肥胖小鼠肝脏的脂肪累积。实验小鼠肝组织脂质代谢相关基因mRNA 转录水平检测结果如上图3c 所示:3 组样品中6 个基因表达量两两之间都表现为差异性极显著(P<0.05),高脂饮食显著增加了基因如SREBP1c、FAS、ACC1 和SCD1 的转录水平(P<0.05);并且结果还表明CD36 和PAI-1 相对表达量显著增加(P<0.05)。SREBP1c、FAS、ACC1 和SCD1 在脂肪酸合成过程中均发挥重要作用,结果表明WBT 能够有效降低脂肪酸调控基因SREBP1c、FAS、ACC1 和SCD1的表达量(P<0.05)。CD36 是一种重要跨膜糖蛋白,主要功能为促进长链脂肪酸转运,在WBT 组肝组织中的转录水平降低显著(P<0.05);另外,WBT 组小鼠肝组织与代谢综合征和动脉粥样硬化形成相关的PAI-1 基因转录水平呈现显著性降低(P<0.05)。结果表明WBT 能明显调控脂质代谢基因的表达水平,进而保护高脂饮食诱导小鼠肝组织继续发挥正常代谢功能,并且具有明显的降脂减肥功效。图3b 和3d 结果显示MC 组小鼠肝组织SREBP1、FAS、ACC1 和p-ACC1 蛋白表达水平显著高于NC,同时印证了WBT 的抑制蛋白质表达增加作用,WBT 组小鼠肝组织SREBP1C、FAS 和ACC1 蛋白水平,与MC 组相比,具有相应降低趋势,并伴随着ACC1 磷酸化(p-ACC1)水平升高,抑制了肝脏中的脂肪酸合成和脂肪生成,达到减少小鼠肝脏脂质积累的作用,这与之前文献报道研究结果具有一致性[36]。

图3 肥胖小鼠脂质代谢通路信号变化Fig. 3 Changes of signal of lipid metabolism pathway in obese mice
2.6 WBT 对肥胖小鼠肠道菌群的影响
为了探究WBT 对高脂饮食诱导肥胖小鼠肠道菌群紊乱的调节作用,本研究基于Illumina Novaseq 测序平台对小鼠结肠段粪便进行高通量测序分析(16S rRNA)。将3 组18 个样品高通量测序所得的原始序列经过质控得到高质量序列,使用USEARCH 10.0 进行OTUs 聚类划分(相似性97%水平),共得到668 个OTUs,如图4 为3 组小鼠肠道菌群的差异性展示。NC、MC 和WBT 小鼠3 组中共有238 个相同OTUs;此外,NC 组有93 个特有OUTs,MC 组有70 个特有OUTs,WBT组有56 个特有OUTs,说明3 组小鼠肠道菌群整体差异性较大,MC 组和WBT 组都具有影响小鼠肠道菌群结构的能力。
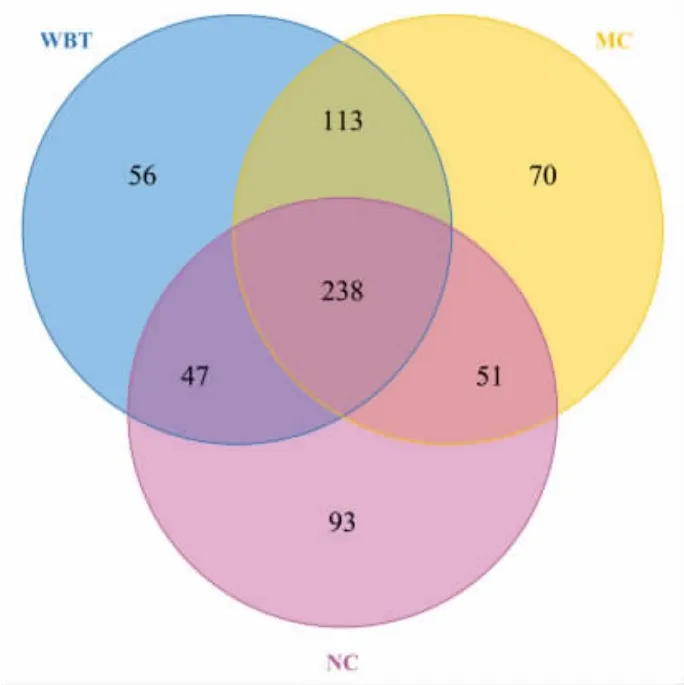
图4 OTUs 韦恩图Fig. 4 OTUs venn diagram
小鼠肠道菌群的Alpha(α)多样性分析结果如图5a,基于Chao 丰富度估计量(Chao1 richness estimator)的 结果显示,与NC 组相比,MC 组Chao1 指数明显降低(P<0.05),表明MC 组肠道菌群的相对丰度下降,而WBT 组Chao1 指数与MC组相比有显著上升(P<0.05)。如图5b 所示,MC 组香农-威纳多样性指数(Shannon-wiener diversity index)与NC 组相比也表现出明显下降的趋势(P<0.05),说明MC 组肠道菌群的多样性显著减少了,WBT 组香农指数显著上升(P<0.05),WBT 能提高高脂饮食小鼠肠道菌群的多样性。

图5 3 组小鼠肠道菌群多样性的影响Fig. 5 Effects of gut microbiota diversity in 3 groups of mice
此外,基于主成分分析(Principal component analysis,PCA)和主坐标分析(Principal coordinat analysis,PcoA)的Beta(β)多样性分析表明,PCA(PC1 和PC2 分别占小鼠肠道菌群结构总体差异的38.68%和13.67%)如图5c 所示,发现MC 组小鼠肠道菌群离散程度极大,与NC 组整体分布明显不同,具有较大的组间差异性,说明高脂饮食诱导小鼠肠道菌群发生了变化,WBT 组小鼠肠道菌群与MC 组相比,离散程度变小,在整体分布上与NC 组差距较大,一定程度上改善了高脂饮食小鼠肠道菌群的变化。如图5d 所示,PcoA(PC1 和PC2分别占肠道菌群结构总体差异的55.47%和22.29%)结果表明,各组肠道菌群在图5 中呈现分散分布,整体分布差异较大,WBT 组离NC 组更近,其小鼠肠道菌群在x 轴方向上的投影往NC组移动,说明在WBT 的干预下高脂饮食小鼠的肠道菌群有正常化的趋势。
基于分类学对OTUs 进行注释对小鼠肠道菌群在门水平的相对分布进行分析(图6),3 组小鼠肠道菌群相对丰度显著不同,NC 组小鼠肠道菌群的优势菌群主要是拟杆菌门、厚壁菌门、放线菌门和变形菌门,结果发现在高脂饮食的影响下拟杆菌门、放线菌门和变形菌门等3 种菌的相对丰度明显下降,其中拟杆菌门和变形杆菌门两种菌的相对丰度下降显著(P<0.05),厚壁菌门相对丰度增加显著(P<0.05)。除NC 组的优势菌之外,还发现脱硫菌门(Desulfobacterota)和弯曲杆菌门(Compylobacterota)的相对丰度也得到了明显增加。经过WBT 干预,高脂饮食小鼠肠道菌群中厚壁菌门相对丰度的上升趋势得到了缓解,并显著提高了拟杆菌门相对丰度(P<0.05)。

图6 3 组小鼠肠道菌群相对丰度的变化趋势Fig. 6 Trend of relative abundance of gut microbiota in 3 groups of mice

图7 高脂饮食对小鼠肠道菌群功能丰度的影响Fig. 7 Effects of high-fat diet on functional abundance of gut microbiota in mice
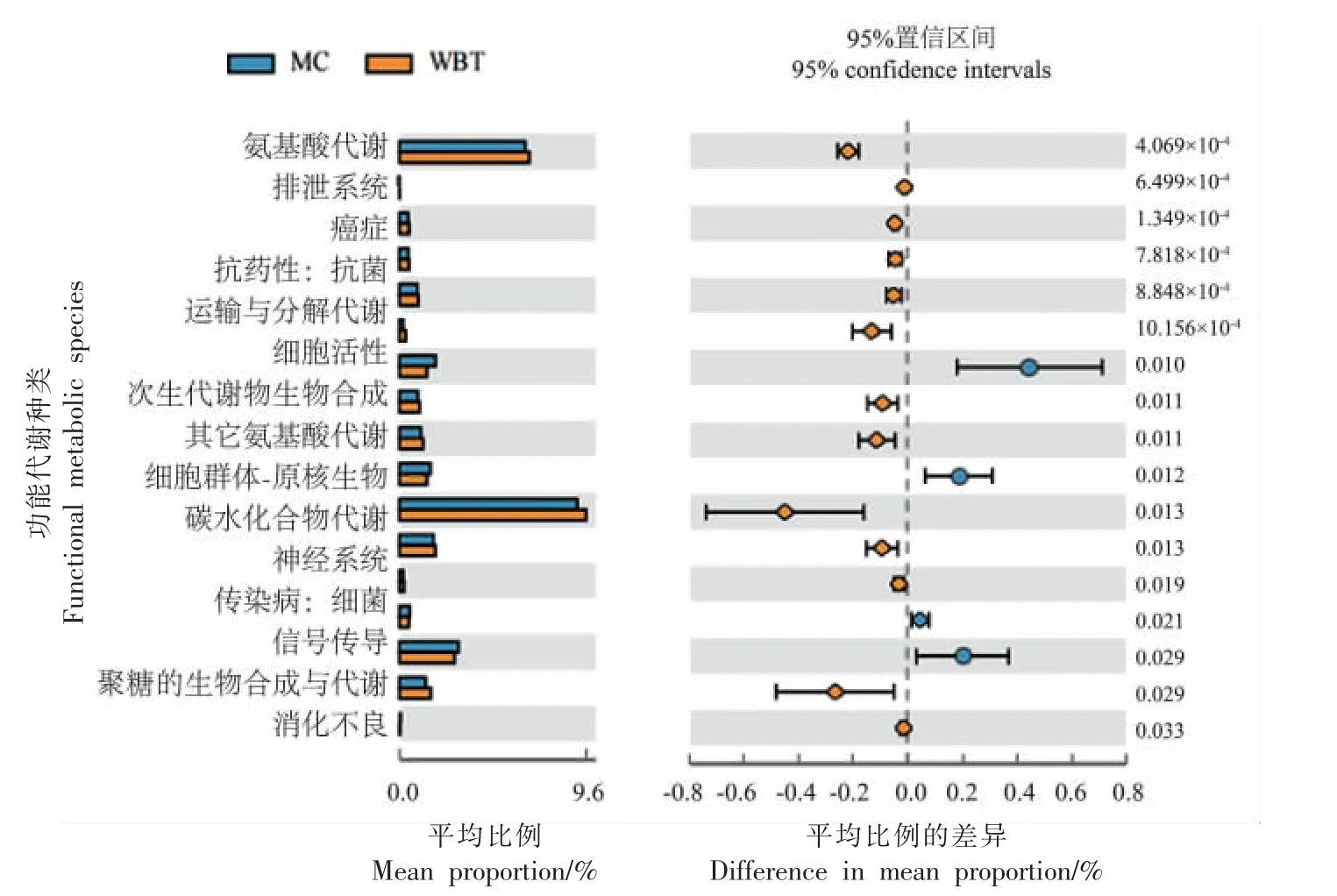
图8 WBT 对小鼠肠道菌群功能丰度的影响Fig. 8 Effects of WBT on functional abundance of gut microbiota in mice
3 讨论
肥胖是多因素导致的代谢性疾病,本研究以高脂饮食C57BL/6 小鼠作为肥胖模型,经过9 周高脂饮食诱导,并同时设立WBT 干预组。实验结果表明,MC 组小鼠具有和前人研究[40-41]相似的结果:高脂饮食肥胖小鼠有高血脂和肝功能受损的症状,其体质量、脏器指数和Lee’s 指数显著升高(P<0.05),血糖、每日能量摄入明显提高,糖耐受功能显著受损,肝脏肿大并伴有脂肪变性,血清中的TC、TG、LDL-C 含量、AST 和ALT 酶活性均显著性提高(P<0.05),表明MC 组C57BL/6 小鼠肥胖模型造模成功。
本研究发现WBT 组小鼠体质量、脏器指数和Lee’s 指数与MC 组相比显著下降(P<0.05),血糖、每日能量摄入明显减弱,糖耐受受损、肝脏肿大和肝脏脂肪变性得到了有效的缓解;LDL-C 被称为"坏的胆固醇",主要负责把合成的胆固醇运输到机体全身的其它组织,HDL-C 的功能与LDL-C 相反,主要功能是把机体外周组织的胆固醇运回肝脏中进行分解,血清中LDL-C 和HDLC 含量与肥胖的并发症(动脉粥样硬化、心血管疾病和冠心病)相关[42-44],WBT 组小鼠血清中血脂(TC、TG 和LDL-C)水平均显著性降低(P<0.05),HDL-C 水平虽有降低但是无统计学意义(P>0.05),表明肥胖小鼠的高脂血症在WBT 的干预下具有明显的改善效果。AST 和ALT 作为血清的常规指标能够反应肝功能是否受损[45],WBT 组小鼠血清AST 和ALT 酶活性显著下降(P<0.05),显示WBT 具有能够改善肥胖小鼠的肝功能受损作用,表明WBT 能够有效干预和抑制高脂饮食导致的小鼠肥胖症状。
本研究检测了小鼠肝脏中与脂质代谢相关的6 个基因mRNA 的转录水平。SREBP1c 属于SREBP 转录因子家族[46],在肝脏和脂肪中有着较高的表达,具有激活ACC、FAS 和SCD,在机体的肝脏脂质代谢中起了重要作用。ACC 作为脂肪生成限速酶,还能够起阻止脂肪酸进入线粒体进行脂肪酸氧化的作用,具有治疗肝脏脂肪变性的重大潜力。FAS 和SCD 都是机体脂质代谢的重要因子,都能够对机体的肥胖产生影响。CD36 是小鼠肝脏内的脂肪酸转运酶,与小鼠的内脏肥胖、胰岛素抵抗和非酒精性脂肪肝等疾病有关[47-48]。Henning 等[49]研究结果表明脱咖啡碱的红茶提取物能显著诱导高脂小鼠的CD36 基因表达水平下调。学者研究[50-52]发现PAI-1 在肥胖患者中表达水平增加,能促进脂肪组织炎症的发展,并加剧高脂饮食导致的肥胖的代谢紊乱。本研究中MC 组小鼠由于高脂饮食的原因,相关脂质代谢基因(SREBP1c、FAS、ACC1、SCD1、CD36 和PAI-1)转录水平极显著上调(P<0.01),并通过免疫印迹技术分析肝脏中脂肪生成相关蛋白(SREBP1、FAS、ACC1、p-ACC1)表达水平,结果显示蛋白表达水平与相应的mRNA 转录水平具有一致的调控趋势,SREBP1、FAS 和ACC1 的蛋白含量提高显著(P<0.05),而p-ACC1 蛋白水平降低显著(P<0.05),p-ACC1/ACC1 的蛋白相对比值也显著降低(P<0.05),表明MC 组小鼠肝脏脂质合成增加。WBT 组CD36 和PAI-1 的基因转录水平呈现显著降低趋势(P<0.05),降低了小鼠肥胖及其代谢紊乱风险。此外,WBT 组小鼠肝脏中SREBP1C、FAS和ACC1 蛋白表达水平和mRNA 转录水平都体现为显著性降低趋势(P<0.05),并伴随着ACC1 磷酸化(p-ACC1)水平升高,抑制了肝脏中的脂肪酸合成,减少小鼠肝脏脂质积累的作用。结果表明WBT 对于肥胖小鼠脂质代谢的调控具有明显的改善作用。
肥胖在世界范围内的迅速增长已经成为了健康领域的重大挑战,近年来,肠道菌群的对于肥胖的影响已成为研究热点[53-54]。普洱茶、茯砖茶、绿茶、茶多酚和褐茶褐素等多种茶叶及其活性成分,通过调节高脂饮食小鼠肠道菌群的相对丰度,进而影响小鼠机体内的脂质代谢通路达到抑制机体肥胖作用[55-58]。在人类的肠道微生物区系中主要细菌门是拟杆菌门、厚壁菌门、放线菌门和变形菌门,其中最多的是厚壁菌门和拟杆菌门,约占肠道细菌的90%[59],各菌群之间和菌群与宿主之间在健康宿主的肠道中会形成一个动态的平衡,拟杆菌和厚壁菌这两种优势菌因为和肥胖的发展有关被定义为肥胖性肠道微生物[60]。这两种菌的相对丰度与体质量增加、肠道炎症和肥胖的发展息息相关,厚壁菌门和拟杆菌门的比值(F/B)可以作为肥胖肠道菌群紊乱的生物标志物[61-63]。F/B 的值在高脂饮食的作用下异常上升,导致宿主能量代谢失衡并引起肥胖代谢综合征发病率的增加[64]。分析本实验小鼠肠道菌群的菌群丰度和组成,结果显示肠道菌群在门水平存在显著性差异(P<0.05)。高脂饮食导致小鼠肠道中厚壁菌门和拟杆菌门的相对丰度发生了显著变化,WBT 通过显著增加厚壁菌门和拟杆菌门的相对丰度,并且降低厚壁菌门和拟杆菌门的比值,表明WBT 可能通过调节小鼠肠道菌群的相对丰度和多样性,改善了高脂饮食造成的小鼠肠道菌群紊乱,缓解了肥胖症状。
为了探究不同组小鼠肠道菌群的功能基因在代谢途径上的差异和变化,将高通量测序所得的OTUs 经过分类学注释后所获得的物种组成与KEGG PATHWAY 数据库进行比对,并在其纲水平进行功能注释。将NC 组与MC 组进行STAMP差异性分析[65],使用Welch's-t-test 检验发现,高脂饮食改变了小鼠肠道菌群的部分功能丰度,共有28 个功能丰度发生了显著变化,分别体现为18 个功能丰度显著增加,10 个功能丰度显著下降。这些变化主要涉及脂质代谢、核苷酸代谢、氨基酸代谢等代谢通路以及心血管疾病、免疫疾病和内分泌和代谢疾病等复杂疾病,此外机体的一些运输、膜转运功能也发生了变化。由此可见,高脂饮食改变了小鼠肠道菌群的代谢功能。WBT 的干预结果表明WBT 显著影响了高脂饮食小鼠17个肠道菌群的功能丰度,其中13 个功能丰度增加,4 个功能丰度下降,功能丰度的变化也主要涉及了脂质、核苷酸、氨基酸等代谢通路,这与周方等[66]的研究结果相一致。本研究结果表明WBT 的功能成分经过肠道菌群的代谢之后,改变了肠道菌群的相对丰度,可能通过这种干预来改变肠道菌群的生物代谢功能,进而调控小鼠的脂质代谢通路,从而达到缓解肥胖的作用。
4 结论
乌牛早红茶作为一种天然植物膳食,具有降脂减肥的巨大潜力,它可以抑制高脂饮食小鼠体质量的增加和脂质的累积,改善肝脏脂肪变性和糖耐受受损,并通过调控脂质代谢来减少脂肪酸的合成。此外WBT 的干预还可以通过改善肠道菌群的多样性和丰度来调节高脂饮食小鼠肠道菌群的紊乱,特别是对于厚壁菌门和拟杆菌门相对丰度的调节,进而干预小鼠肥胖及其相关代谢。
