水产品过敏原及其检测技术概述
2024-03-12陈一瑜刘庆梅张凌晶曹敏杰刘光明
刘 红,陈一瑜,刘庆梅,张凌晶,曹敏杰,刘光明*
(1 集美大学海洋食品与生物工程学院 厦门市海洋功能食品重点实验室福建省海洋功能食品工程技术研究中心 福建厦门361021 2 华侨大学材料科学与工程学院 福建厦门 361009)
水产品因鲜美的味道和丰富的营养而深受消费者青睐。其中,鱼和甲壳类水产品属于联合国粮农组织和世界卫生组织认定的过敏食物[1]。流行病学及食物过敏调查发现,水产品是我国过敏人群的主要致敏物[2-4]。近年来我国水产养殖业和水产食品加工业发展迅猛,2021 年我国水产品总产量达到6 693 万t,食用消费量2 965 万t,加工消费达到2 783 万t,消费总量6 888 万t[5]。随着水产品消费量出现的大幅度增长,随之引发的水产品过敏问题也日益严峻。除了水产品本身外,其作为原料或配料被广泛添加到各类食品中,由此扩大了含有水产品致敏成分的食物种类,导致出现许多潜在的水产品过敏原组分[6-7]。截至2021 年3 月,世界卫生组织和国际免疫学会联合会过敏原命名小组已命名1 036 种过敏原[8],同时指出应在产品标签中提示过敏原信息;我国也颁布预包装食品标签通则,增加了致敏物质的标识[9]。事实上水产食品在加工、运输、贮藏过程中有可能受到外来过敏原的污染,标签中难以对交叉污染产生的过敏原进行标注。消费者仅根据明确的标签标识,难以预防对过敏原的摄入[10]。由此水产食物过敏引起的食品安全问题日益严峻,严重制约了行业的发展。明确水产食品中的过敏原,利用适当的检测技术对水产品及其加工、运输、贮藏过程中所含过敏原进行检测、监控,有利于评估水产品过敏的潜在风险,预防过敏疾病的发生。根据近年的研究报道,本文概述水产品过敏原及其检测技术。
1 水产品过敏原概述
水产品过敏原,来自水产品中的蛋白质,能够诱导人体产生特异性IgE 抗体应答的抗原性物质[11],一般分子质量为10~100 ku,且相对分子质量越高,结构越复杂,其致敏性越强。其多为酸性糖蛋白,具有酸性等电点。由于过敏原的糖基化作用可能在一定程度上使其维持更为稳定的结构,因此普遍具有较好的耐酸碱和热稳定性,耐胃肠液中消化。在食品加工处理和人体消化过程中过敏原不易被破坏,相关过敏人群一旦食用,极易引发水产食物过敏性疾病,发病症状也趋于复杂化和严重化,在皮肤、胃肠系统、呼吸系统方面会出现不同程度的过敏症状,严重时甚至昏厥、休克[12]。不同水产过敏原可能存在相同的抗原决定簇,从而发生免疫交叉反应,使过敏患者在食用不同的水产品时均发生过敏反应,且因个体差异,最低食用量各异,过敏症状通常伴随终身[13-15]。
水产品富含蛋白质,其中只有极少数蛋白质能够引发过敏反应。通常将能诱发50%过敏患者产生过敏反应的蛋白质称为主要过敏原,而次要过敏原即其它引起过敏反应的蛋白质。目前已发现并鉴定的鱼类过敏原有小清蛋白(Parvalbumin,PV)、鱼类胶原蛋白(Collagen,CO)、β-烯醇酶(β-Enolase)、醛缩酶A(Aldolase A)、鱼卵中的β′-组分(β′-Component,β′-c)及鱼精蛋白(Protamine)等;甲壳类水产品过敏原有原肌球蛋(Tropomyosin,TM)、精氨酸激酶(Arginine kinase,AK),肌质钙结合蛋白(Sarcoplasmic calcium-binding protein,SCP)、磷酸丙 糖异构 酶(Triosephosphate isomerase,TIM)、肌球蛋白轻链(Myosin light chain,MLC)、细丝蛋白c(Filamin C,FLN c)、肌钙蛋白C(Troponin C,TnC)和血蓝蛋白(Hemocyanin,HMC)等[16],其理化性质和生物学功能详见表1。目前,关于水产品过敏原的检测类研究主要集中在鱼类主要过敏原PV、甲壳类及软体类动物泛过敏原TM 中。
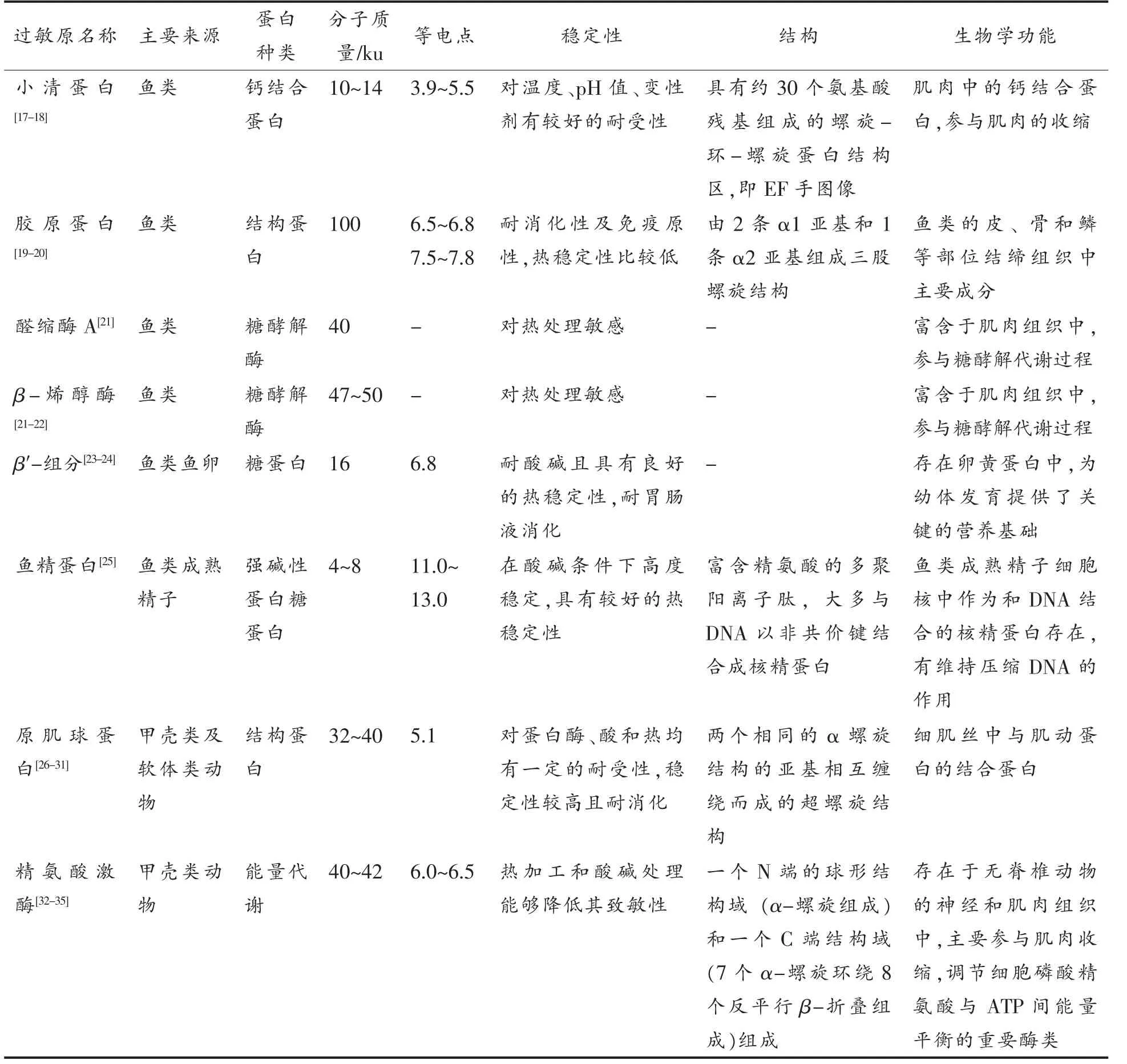
表1 水产品过敏原的理化性质和生物学功能Table 1 Physicochemical properties and biological functions of aquatic products allergens
2 水产品过敏原检测技术
水产品过敏原的检测技术是基于生物标志物(DNA 或蛋白质)开发的[50-51],主要有基于基因水平的核酸检测技术和基于蛋白水平的免疫检测技术及质谱检测技术。核酸检测技术是通过测定扩增的过敏原DNA 片段来实现,主要包括聚合酶链式反应(PCR)、实时荧光PCR 技术、环介导等温扩增(LAMP)技术等。免疫检测技术是通过抗原和抗体的特异性结合产生的变化来实现,主要包括酶联免疫吸附(ELISA)技术、免疫印迹技术、免疫层析技术、免疫传感器技术等。质谱检测技术是通过测定过敏原完整蛋白或酶解肽段的离子质荷化来实现,主要包括自上而下(Top-down)分析策略、自下而上(Bottom-up)分析策略。
2.1 基于基因水平的核酸检测技术
2.1.1 PCR 技术 根据编码过敏原的DNA 序列,设计特异性引物,使用DNA 聚合酶进行变性-退火-延伸多次循环扩增,利用扩增后的核酸产物进行测定,从而实现水产品过敏原的定性分析。该技术的特异性依赖于与靶序列两端互补的寡核苷酸引物。Phan 等[52]设计了特异性引物Tropo-F 和Tropo-R,建立了用于检测虾源主要过敏原TM 基因的PCR 检测方法,可以成功识别加工食品中的TM 基因。常规PCR 技术主要对单一过敏原进行定性检测,若在同一PCR 反应体系中加上多对特异性引物,即可实现多重PCR 反应,可对水产品中多种过敏原进行定性检测[53]。Suh 等[54]利用多重PCR 技术并与毛细管电泳技术相结合,对牡蛎、贻贝、鲍鱼、蛤蜊TM 基因进行测定,DNA 的检测限(LOD)为16 pg/mL。然而,多重PCR 易受引物间竞争扩增的影响,方法体系优化相对复杂。PCR技术不会严格要求模板DNA 的纯度及其完整性,所需PCR 仪造价较便宜,然而后续的基因分析还需借助电泳、荧光检测或测序技术才能实现最终检测任务,检测流程繁琐,不能准确定量,而且极微量的污染即可造成假阳性。
2.1.2 实时荧光PCR 技术 通过在PCR 反应体系中加入荧光基团,利用荧光检测系统实时监测累积的荧光强度,从而实现对水产品中过敏原的定性、定量分析。其中特异性的荧光探针Taqman探针法和非特异性的SYBR Green I 荧光染料法是常用的荧光标记方法。Sun 等[55]建立了一种基于TaqMan 标记探针技术的实时荧光PCR 检测鱼类主要过敏原PV 的方法,DNA 的灵敏度达5 pg/mL。Prado 等[56]建立了同时检测鲭鱼和金枪鱼DNA 的实时荧光PCR 方法,灵敏度高达5 pg/mL。该技术把核酸扩增、杂交、光谱分析和实时检测技术结合在一起,实现了从定性到定量的飞跃,自动化程度更高,避免了交叉污染,省去了后续染色及荧光检测等步骤,节省人力,准确度更高,然而需要实时荧光定量PCR 仪,设备成本相对较高。
2.1.3 LAMP 技术 LAMP 技术是一种新型的核酸扩增技术,针对靶基因的6 个区域设计4 条特异性引物,等温条件下在链置换型DNA 聚合酶作用下,可将目标基因在15~60 min 内扩增9~10倍,根据产物浑浊度或绿色荧光等的指标,实现水产品中过敏原的定性、定量分析。Sheu 等[57]利用LAMP 技术30 min 内可以检测出含有0.01%的虾类DNA,与螃蟹、龙虾等其它甲壳类动物的DNA无交叉反应,可用于对食品中虾类过敏原的鉴定。张懿翔等[58]利用LAMP 技术检测出含牡蛎过敏成分0.1%,DNA 质量浓度为0.01 pg/mL 的样品。该技术缩短了检测时间,可在微量体系下完成,对仪器、设备的要求降低,只需水浴锅或恒温箱就能实现反应,产物易检测,简便、快捷,适合基层快速诊断,然而引物设计难度较大,较高的扩增效率也易引起环引物间的非特异性配对,导致假阳性的结果。
2.2 基于蛋白水平的免疫技术
2.2.1 ELISA 技术 ELISA 技术是将免疫反应的特异性和酶的高效催化作用相结合的检测技术。将已知的抗原或抗体吸附在聚苯乙烯微量反应板表面,利用酶标记抗体与之发生特异性结合,并以酶作用底物后的显色深浅来实现对水产品中过敏原的定性、定量分析。主要有竞争法、双抗体夹心法、间接法等。Cai 等[59]制备了鲢鱼细小蛋白单克隆抗体,建立了一种竞争ELISA 法测定鲢鱼体内PV,LOD 为0.04 μg/mL。Koppelman 等[60]用大西洋蛤和海洋圆蛤混合蛋白免疫兔和绵羊,制得包被抗体和二抗,建立双抗体夹心ELISA 检测食品中蛤蜊过敏原,LOD 为2.5 mg/kg。双抗体夹心ELISA法灵敏度和特异性更高,被广泛用于水产品过敏原的筛选和常规检测领城,然而所检测的抗原必须拥有两个以上的抗体结合部位,制备抗体比较困难。ELISA 技术目前只能针对一种过敏原的分析,无法进行多残留检测,对具有抗原决定簇类似结构的过敏原存在一定的交叉反应。目前,快速和高通量的过敏原ELISA 检测试剂盒已商业标准化[61]。只需1 台酶标仪即可大批量检测样品,方法简便,易于推广,然而受样本基质、试剂以及试验操作等因素影响较大。
2.2.2 免疫印迹(Western blot)技术 免疫印迹技术是将特异的固相免疫和高分辨率的凝胶电泳相结合的检测技术,通过单向或二维凝胶电泳技术将需要测定的蛋白转移到硝酸纤维素膜等固相载体上,利用抗原和抗体在固定相上发生免疫反应,再与酶标记的抗体反应,并通过底物显色完成水产品中过敏原的定性或半定量分析。汪宁等[62]应用抗蛙PV 单克隆抗体,利用Western blot 分析5 种鱼、2 种鱼糜制品和3 种鱼罐头中PV,结果显示该方法能有效确定鱼类制品中的PV。该技术主要用于发现和鉴定新的过敏原,通常与斑点免疫印迹法(Dot blot)相结合进行联合确认。Dotblot 样品不需通过电泳转膜,直接点在固相载体上,根据斑点的强度实现水产食品中过敏原的半定量检测。Han 等[36]对葡萄牙牡蛎SCP 的过敏原性研究,采用Western blot 及Dot blot 联合分析SCP 的免疫结合活性。Western blot 技术先利用电泳的方式可分离不同分子质量的蛋白质组分,再进行过敏原的确认,可有效避免蛋白质抑制剂存在的影响。对于复杂的样品,可采用双向电泳实现更高程度的分离。免疫印迹技术对试剂需求量少,分析容量大,检测流程繁琐,分析时间长,易受水产品基质的影响。
2.2.3 免疫层析技术 免疫层析技术是将免疫技术和色谱层析相结合的检测技术,将抗体固定于硝酸纤维素膜的某一区带,把干燥的一端浸入待测物后,样品沿膜向前运动达到检测区,与标记的抗体捕获物特异结合而聚集显色,从而实现水产品中过敏原的定性分析。检测的关键在于着色标记物的灵敏度,常用免疫胶体金或免疫酶染色作为标记物,一些新型材料如超顺磁性纳米微球具有较高的灵敏度。Zhang 等[63]以Fe3O4/Au 纳米微球为标记物,制备的免疫层析试纸条可在15 min 内检测鱼过敏原PV,具有良好的检测特异性及稳定性,LOD 为2 ng/mL。利用该技术制备的检测试纸,对待测物进行快速、准确显色,不需要其它仪器、设备和专业临检人员,用于现场快速检测,操作简单,携带方便,基层可以开展,然而检测结果靠肉眼判断,存在灵敏度较低,难于定量化的局限,同时标记物制作成本较高。
2.2.4 免疫传感器技术 免疫传感器技术是将免疫反应的特异性与传感技术的高灵敏度相结合的检测技术,将抗体作为识别元件,利用抗原-抗体发生的特异性结合所产生的物理、化学信号的变化来实现水产品中过敏原的定性或定量分析[64]。Angulo 等[65]将丝网印刷电极结合羧甲基化磁珠作为抗体固相,将辣根过氧化物酶标记二抗构建在磁珠上,并与电化学传感系统耦合,研制出一种用于微量检测虾TM 电化学免疫传感器,3 h 内的LOD 为47 pg/mL,磁珠的使用提高了捕获抗原的效率,利用磁珠修饰丝网印刷电极提高了电极的导电率。Zhou 等[66]将抗TM 单克隆抗体固定在纳米金薄膜传感器芯片表面,建立表面等离子共振免疫传感器技术,实现贝类样品中TM 的实时检测,LOD 为1.0 μg/mL。免疫传感器技术利用传感器记录、检测和分析抗原抗体反应的结果,简化了分析过程,减少了分析时间,降低了检测下限,提高了灵敏度,具有设备小型化,测量过程自动化的特点,然而生物传感器制作较为复杂,费用较高。
2.3 基于蛋白水平的质谱技术
2.3.1 Top-down 分析策略 Top-down 分析策略是将完整蛋白碎裂后进行全局分析。该分析策略样品制备相对简单,无需进行蛋白质酶解,也不依赖抗原抗体的制备,试验耗时减少,具有高分辨率、高灵敏度、蛋白序列覆盖率高等优点。该策略主要用于完整过敏原蛋白的定性确认,定量分析应用较少。Top-down 定性确认策略通常将完整的过敏原离子化后引入到质谱,通过碎片裂解技术最终得到完整蛋白和碎片离子的质荷比信息,最后采用生物信息检索推演多肽序列和修饰位点,可以鉴定出相关的蛋白质亚型和翻译后修饰位点,实现水产品中过敏原的定性鉴定。一般利用分离技术(如液相色谱或2-D 凝胶电泳)从复杂样品中分离出完整的过敏蛋白,选择高分辨率和精确质量的质谱仪进行分析,如傅里叶变化离子回旋共振质谱仪(FTICR-MS)或静电场轨道离子阱质谱仪(Orbitrap-MS)。常见的离子化技术有:电喷雾电离(ESI)、基质辅助激光解吸电离(MALDI)等。常见的碎片离子裂解技术主要有:碰撞诱导解离(CID)、电子捕获解离、高能碰撞引入解离、紫外光解离等[67]。Carrera 等[68]通过ESI-FTICR-MS 对鳕鱼过敏原小清蛋白PV 直接测定,多重电荷态分布显示了具有不同的PV 亚型,并对所有PV 亚型进行准确分子量测定。Top-down 定性确认可获得蛋白质的完整形态特征,检测具有二硫键的四级结构,以及蛋白质翻译后修饰位点和修饰模式之间的关系数据。然而该策略存在得到的信息相对有限、分析通量相对较低等缺点,样品需高度纯化,且较难分析大分子量的蛋白质,灵敏度通常因为蛋白质带电量不同而受限。
2.3.2 Bottom-up 分析策略 Bottom-up 分析策略是通过分析酶解肽段来解析蛋白序列,该分析策略具有高自动化、高分辨率、高灵敏度、样品用量少、分析速度快、高特异性、高通量、分离和鉴定同时进行等优点,也是目前蛋白质组学分析最常用的分析方法。该策略可用于过敏原酶解肽段的定性确认和特征肽段的定量检测。
Bottom-up 定性确认策略利用特异性酶将过敏原酶解成多肽片段的混合物,根据一级质谱或串联质谱检测到的各种多肽的准分子、离子或碎片离子信息,与已知蛋白数据库进行检索匹配,结合匹配度打分及错配过滤,利用得到肽段的确切序列拼接出各蛋白的完整序列,从而实现水产品中过敏原的定性鉴定。定性鉴定方法常采用肽质量指纹图谱(PMF)和肽片段指纹图谱(PFF)。PMF是肽段进行一级质谱分析后与数据库匹配的最佳结果,适用于单一蛋白质分析。混合蛋白质酶解后可能存在相同的肽段,会增加分析的复杂性,质量相似的肽段亦会增加匹配的难度。PMF 分析常使用基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF-MS),如Liu 等[69]对淡水鱼团头鲂中主要存在的过敏原进行分离后,通过双向电泳胶内酶切结合MALD 鉴定出过敏原AK 和烯醇酶。PFF是肽段进行二级碎裂质谱分析后与数据库匹配的最佳结果,通过串联质谱碎裂分析可以获得丰富的肽段碎片离子信息,可用于表征多个蛋白酶解的混合物,对于质量相似的肽段确认更准确,极大地增加了数据库检索结果的可靠性。PFF 多使用具备CID 功能的质谱,如潘晓东等[70]采用超高效液相色谱-四极杆静电场轨道离子阱质谱仪(UPLC-Q-Orbitrap-MS)鉴定了沼虾中的4 种过敏原,分别为TM、AK、SCP 和HMC,肽段覆盖率分别为53%,36%,12%和12%。由于样品经过酶解,Bottom-up 定性确认不仅增加了检测时间,还会破坏蛋白质不稳定结构,导致无法识别蛋白质变异,无法正确分析蛋白质翻译后修饰之间的关系,蛋白序列覆盖率相对较低。
Bottom-up 定量分析策略常使用稳定同位素标记法,根据定性检测结果结合相关蛋白质组学软件挑选1 条或多条特征肽段,将同位素标记的特征肽段作为内标,酶解肽段混合物经超高效液相色谱(UPLC)分离,利用串联质谱的选择反应监测/多反应监测/平行反应监测(SRM/MRM/PRM)模式对目标特征肽指定离子对强度进行监测,从而实现水产品中多种过敏原的同时定量分析[71]。Stella 等[72]筛选TM 两个特征肽,分别为限定肽和量化肽,采用UPLC-Q-Orbitrap-MS 在PRM 模式下检测甲壳类水产品的TM,LOD 为5 μg/mL。Fan等[73]选择灵敏度高的ANIQLVEK 作为定量标记肽,利用高效液相色谱-三重四极杆质谱(UPLCQqQ-MS)在MRM 模式下检测虾、蟹中TM 的LOD 为0.1 μg/mL。孟佳等[74]利用UPLC-Q-Orbitrap-MS 实现了南美白对虾、大闸蟹、青蟹、金枪鱼、大西洋鲑鱼的7 种过敏原蛋白的快速筛查,并选取30 个特征肽,利用UPLC-QqQ-MS 建立MRM 定量检测方法,LOD 为2.0~3.5 μg/mL。Bottom-up 定量分析利用液相色谱的高效分离和质谱的高分辨率,通过对所选的特征肽段进行检测,有效避免其它肽段的干扰,提高重现性、灵敏度和特异性。使用稳定同位素标记的特征肽可解决基质效应,建立的方法更加准确可靠。
2.4 水产品过敏原检测技术的比较
过敏原检测手段多样,各种检测技术的分析要求、所需设备、优缺点各异[75],详见表2。基于基因水平的核酸检测技术不易受热处理和压力等作用的影响,更加灵敏可靠,且对于缺乏特异性单抗的过敏原,可利用已知过敏原的基因序列进行检测。由于核酸检测技术属于间接性检测,检测对象是DNA 非致敏蛋白,因此不能真正反映水产品过敏原的致敏性。基于蛋白水平的免疫检测技术特异性高、操作简便、无需复杂的试验操作,然而制备抗体比较困难,且水产品在实际加工生产中,各种加工处理会破坏致敏蛋白的结构,从而破坏其抗原决定簇,导致分析准确度降低,并且因样本、试剂及操作等因素而造成检测结果的偏差,稳定性较差[76]。基于蛋白水平的质谱检测技术具有高自动化、高分辨率、高灵敏度、高特异性、高通量、样品用量少、分析速度快、分离和鉴定同时进行等优点,是分析水产品过敏原的有力工具,既克服了核酸检测技术不能直接分析致敏蛋白的缺点,又改善了免疫检测技术存在的检测低通量和交叉干扰的弊端。质谱检测在鉴定过敏原蛋白中起重要作用,无需制备抗原抗体,尤其在复杂基质中多种过敏原的定量检测方面具有很大的优势,依赖的特征肽段几乎不受加工影响,稳定性高,可以满足直接检测目标蛋白和变性蛋白的要求[77-78]。然而,质谱检测技术需要昂贵的设备和专业技能,限制了该技术的广泛应用。
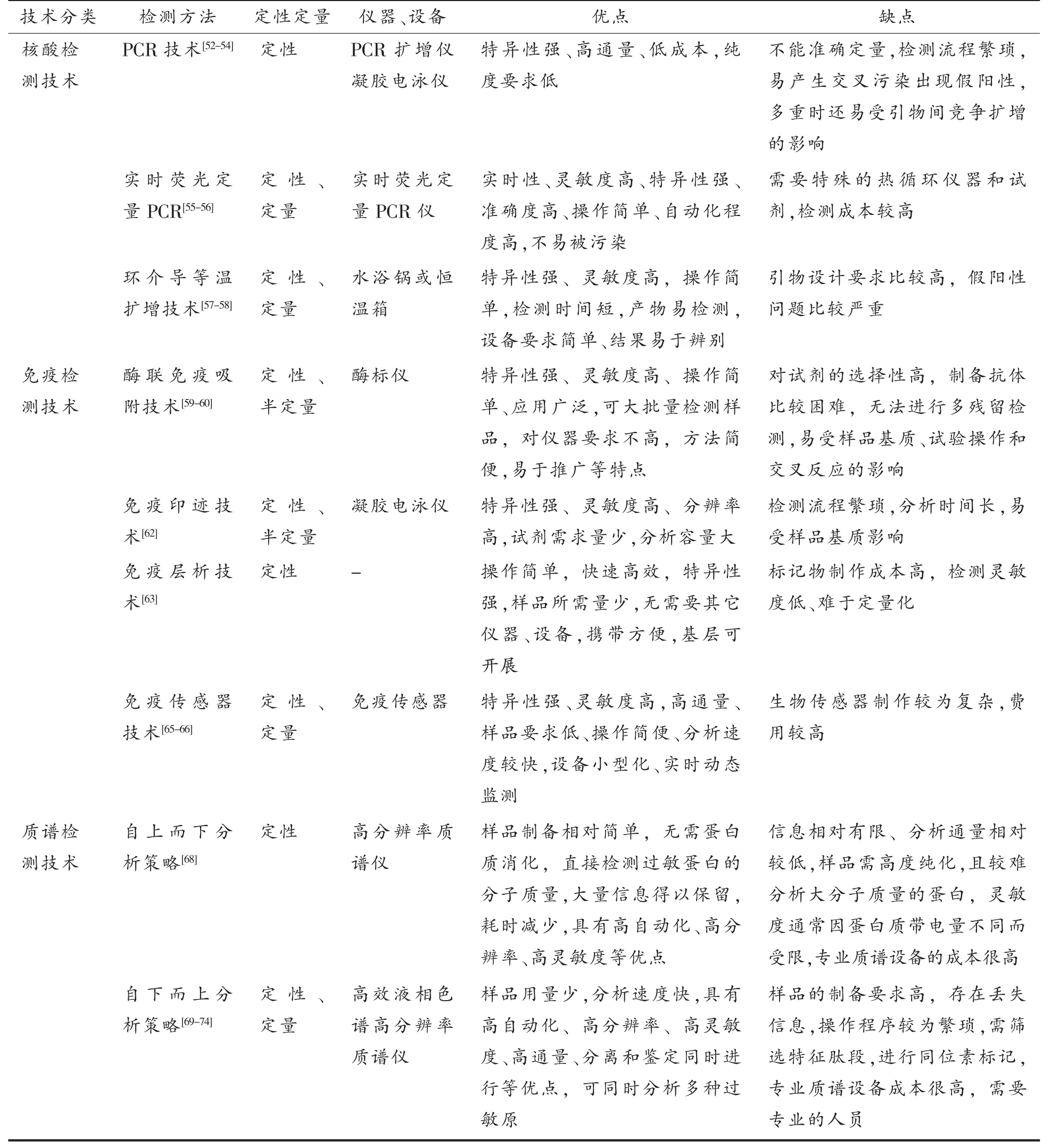
表2 水产品过敏原检测方法比较Table 2 Comparison of allergen detection methods for aquatic products
3 结语
水产品过敏原种类众多,过敏原检测手段多样,单一检测方法很难做到普遍适用性。利用适当的技术来对水产过敏原进行准确检测、监控,结合试验条件和成本,选用经济、可靠又快速、明确的识别与定量的方法,准确检测水产食品中隐藏的过敏原,降低生产过程中的交叉污染,有利于评估水产品过敏的潜在风险,预防水产食物过敏疾病的发生。
现有过敏原的检测集中在少数主要过敏原中,针对新型或次要过敏原的检测有待进一步探究。未来水产品中过敏原检测将向更加准确、快速、经济、普遍适用、高自动化、高通量、高灵敏性的方向发展。同时,多种方法联用将在水产品中的过敏原甚至是潜在过敏原的高效检测中发挥更重要的作用,以更好的保障过敏人群的生命健康。
