市售鱼鳔氨基酸及蛋白质成分分析
2024-03-12张金聚卢一泓吴孟华马志国
张金聚,卢一泓,何 倾,吴孟华,马志国,张 英∗,曹 晖∗
(1.暨南大学岭南传统中药研究中心,广东 广州 510632; 2.国家中药现代化工程技术研究中心岭南资源分中心,广东 广州 510632; 3.广东省中医药信息化重点实验室,广东 广州 510632)
鱼鳔是一种传统的药食两用物质,又称鱼胶、鱼肚、鱼白、花胶等,在岭南地区尤为常用,其富含胶质,味道鲜美[1]。中医药理论认为,鱼鳔可补肾固精、滋养筋脉、养血止血[2-3]。现代研究表明,鱼鳔具有抗疲劳、清除自由基、抗氧化、改善便秘、抗癌、促进伤口修复等作用[4-8]。
市售鱼鳔通常是将新鲜鱼鳔剖开,经去除血管及黏膜、洗净压扁、晒干等步骤制成。市场上的鱼鳔形态大小各异,价格相差悬殊,来源非常复杂[9-10]。根据已有文献报道及实验室前期研究,市场上约70%的鱼鳔来源于石首鱼科的鱼类,此外,也可见来源于尖吻鲈科、刺鲀科等非石首鱼科的鱼鳔[9-11]。目前,国内外学者对鱼鳔成分的研究主要集中于氨基酸、蛋白质、多糖等[12-16]。如赵敏豪等[17]通过氨基酸自动分析仪,发现大黄鱼鱼鳔等7 种鱼鳔均含有17 种常见的氨基酸,但总氨基酸含量存在差异。Kaewdang 等[18]采用酸法和酶法提取了黄鳍金枪鱼鱼鳔中的胶原蛋白并进行了表征研究,发现鱼鳔中富含Ⅰ型胶原蛋白。现有研究大多针对新鲜鱼鳔及少数种类的市售鱼鳔中的氨基酸、多糖及胶原蛋白进行成分测定和药理作用研究,缺少对来源复杂的市售鱼鳔开展系统的成分分析及对比研究,且对于鱼鳔中除胶原蛋白外的蛋白质分析尚为欠缺。因此,对多种市售鱼鳔的蛋白质和氨基酸成分进行全面的分析和对比,对于鱼鳔药效物质基础及质量控制研究具有重要意义,可为鱼鳔的开发利用和深入研究提供依据。
1 材料与方法
1.1 材料 16 批鱼鳔样品购自广东各药材市场,由暨南大学岭南传统中药研究中心张英副教授通过性状和DNA 条形码鉴别基原,样品保存于暨南大学药学院中药标本馆。样品信息见表1。
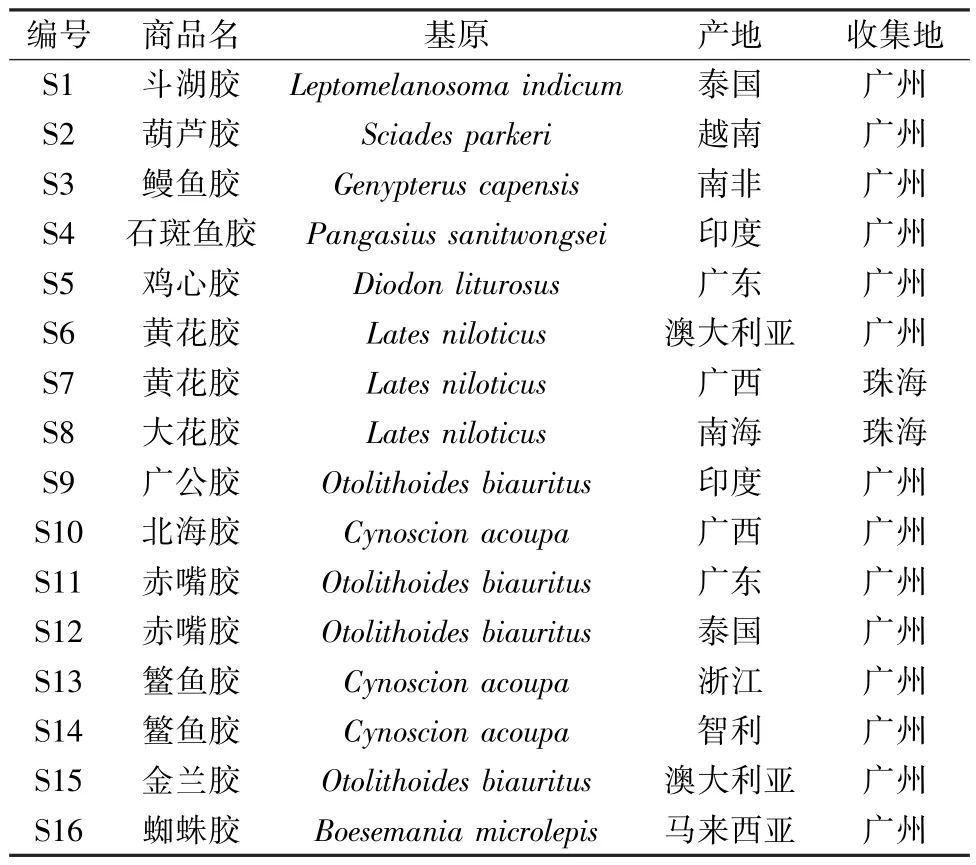
表1 鱼鳔样品信息Tab.1 The information of swim-bladder samples
碳酸氢铵(分子生物学级)、尿素(分子生物学级)、甲酸(质谱纯)、三氟乙酸(质谱级)、乙腈(色谱纯)(美国Sigma 公司); Waters AccQ·FluorTM氨基酸测定试剂盒(货号4034882751),包括AccQ·Fluor 衍生剂粉末2A、AccQ·Fluor 稀释剂2B、AccQ·Fluor 硼酸缓冲液、AccQ·Fluor 醋酸盐-磷酸盐缓冲液、17 种氨基酸混合标准溶液[天冬氨酸(Asp)、丝氨酸 (Ser)、谷氨酸 (Glu)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸 (Pro)、半胱氨酸(Cys)、酪氨酸(Tyr)、缬氨酸(Val)、甲硫氨酸(Met)、赖氨酸(Lys) 异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe),浓度均为2.5 mmol/L],购于美国Waters 公司; BCA 蛋白浓度测定试剂盒、蛋白酶抑制剂混合物、测序级重组胰蛋白酶、蛋白质分子量标准(6.5 ~270 kDa)、6×蛋白上样缓冲液 (上海碧云天生物技术有限公司)。
1.2 仪器 Agilent 1260 高效液相色谱仪,配置G7121A FLD 检测器(美国Aglient 公司); Milli-Q超纯水系统(美国Millipore 公司); 10 kDa 超滤离心管、EASY-nLC 1200 纳升级液相色谱仪、Orbitrap Fusion Lumos 质谱仪(美国赛默飞世尔科技公司)。
1.3 方法
1.3.1 氨基酸含量测定
1.3.1.1 对照品溶液制备 精密移取适量浓度均为2.5 mmol/L 的含17 种氨基酸的对照品溶液,置于1 mL 量瓶中,用超纯水将对照品溶液分别配制成浓度为 25.0、50.0、100.0、250.0、500.0、1 000.0、2 500.0 μmol/L 的系列对照品溶液。
1.3.1.2 样品溶液制备 取0.05 g 已于50 ℃烘干至恒重的鱼鳔样品,精密称定,置于耐压管中,加入6 mol/L HCl 溶液10 mL,120 ℃烘箱中反应24 h,取出,冷却至室温,用6 mol/L HCl 溶液补足减失的质量,得水解液; 取5 mL 水解液至蒸发皿中,80 ℃水浴蒸干,用9 mL 超纯水分3 次洗涤蒸干后的固体产物,将洗涤液转移至10 mL 量瓶中并定容至刻度,过0.22 μm 滤膜,即得。每个样品平行制备3 份样品溶液。
1.3.1.3 衍生化 Waters AccQ·Fluor 衍生试剂的制备按照Waters AccQ·FluorTM氨基酸测定试剂盒说明书进行操作。吸取1 mL AccQ·Fluor 稀释剂2B加入到装有AccQ·Fluor 衍生剂粉末2A 的试剂瓶中,涡旋振荡10 s,于55 ℃恒温水浴锅中加热8~9 min,制得衍生试剂。
衍生样品溶液和对照品溶液: 分别吸取10 μL对照品溶液或样品溶液、70 μL AccQ·Fluor 硼酸盐缓冲液、20 μL 衍生试剂于0.2 mL 离心管中,放置1 min,涡旋振荡10 s,于55 ℃恒温水浴锅中加热8~9 min,冷却,即得。
1.3.1.4 色谱条件 AccQ·FluorTMC18色谱柱(150 mm×3.9 mm,4 μm); 使用超纯水将AccQ·Fluor 醋酸盐-磷酸盐缓冲液(pH 4.95) 按1 ∶10 稀释,作为流动相A,60%乙腈水溶液为流动相B,梯度洗脱(0 ~0.5 min,0 ~2% B; 0.5 ~15 min,2% ~7% B; 15~19 min,7% ~10% B; 19~32 min,10% ~40% B; 32 ~33 min,40% B; 33 ~34 min,40% ~100% B; 34~37 min,100% B; 37 ~38 min,100% ~0 B); 体积流量1.0 mL/min; 进样量5 μL;柱温37 ℃; FLD 检测器激发波长250 nm,发射波长395 nm。
1.3.1.5 数据处理 采用Excel 软件对测得的数据进行处理,氨基酸含量以(±s) 表示,采用SPSS 26.0 软件进行主成分分析。
1.3.2 蛋白质SDS-PAGE 分析
1.3.2.1 蛋白质提取 参考Wis'niewski 等[19]的方法并加以改进,称取0.1 g 鱼鳔样品,加入500 μL含1% 混合蛋白酶抑制剂的PBS,常温浸泡1 h,组织研磨仪60 Hz 研磨30 s,重复研磨3 次,加入500 μL 含1% 混合蛋白酶抑制剂的SDT 缓冲液(4% SDS,200 mmol/L DTT,200 mmol/L Tris/HCl,pH 7.6),60 Hz 研磨30 s,冰上裂解30 min,沸水浴5 min,100 W 超声5 s,间隔5 s,循环超声6 次,再次沸水浴3 min,涡旋振荡,12 000 r/min 离心10 min,取上清。按照试剂盒说明书,使用BCA 法测定蛋白质浓度。
1.3.2.2 SDS-PAGE 分析 使用SDT 缓冲液调整鱼鳔蛋白样品液质量浓度为1 mg/mL,取20 μL 蛋白样品液置于0.2 mL 离心管中,加入6×蛋白上样缓冲液,在100 ℃下煮沸5 min,每孔上样量10 μL,凝胶电泳于恒压模式下进行,开始时电压保持在60 V,进入分离胶后调整电压为120 V。电泳结束后,使用考马斯亮蓝R-250 将胶片染色1 h,于脱色液 (含50% 甲醇、10% 冰醋酸) 中脱色12 h。
1.3.3 蛋白质种类鉴定分析
1.3.3.1 蛋白质提取与酶解 参考Wi s'niewski等[19]的方法并加以改进,取“1.3.2.1” 项下蛋白质样品,使用SDT 缓冲液调整鱼鳔蛋白样品质量浓度为1 mg/mL,取200 μL 蛋白样品液加入到超滤离心管中,用300 μL 8 mol/L 尿素稀释,12 000 r/min 离心浓缩30 min,用300 μL 8 mol/L 尿素置换一次; 加入100 μL 50 mmol/L 碘乙酰胺溶液,暗处反应30 min,12 000 r/min 离心浓缩; 8 mol/L尿素置换3 次; 加入300 μL 50 mmol/L 碳酸氢铵溶液置换2 次; 加入胰蛋白酶(1 ∶100),在37 ℃酶解过夜; 酶解完成后,12 000 r/min 离心收集流出液; 用10%三氟乙酸酸化至终浓度0.4%时终止反应,样品脱盐后减压冷冻干燥,用0.1%甲酸水溶液复溶后上机测试。
1.3.3.2 LC-MS/MS 数据采集 复溶后的混合多肽样品液采用EASY-nLC 1200 纳升液相系统进行分离,色谱柱采用Acclaim PepMap 100 RPLC C18预柱(300 μm×5 mm,5 μm) 和Acclaim PepMap 100 RPLC C18分离柱(75 μm×150 mm,3 μm); 流动相2%乙腈(含0.1% 甲酸)(A) -80% 乙腈 (含0.1%甲酸)(B),梯度洗脱(0~14 min,5% ~12%B; 14~40 min,12% ~24% B; 40~53 min,24% ~38% B; 53 ~54 min,38% ~95% B; 54 ~60 min,95% B); 体积流量580 nL/min; 进样量3 μL。
样品经色谱分离后用Orbitrap Fusion Lumos 采集数据,离子源为纳升源; 喷雾电压2.2 kV (正离子模式);m/z100.0~1 500.0; 分辨率60 000 at 400m/z; 隔离宽度为3m/z,归一化碰撞能量为40 eV,选择丰度前15 的离子采集二级质谱。
1.3.3.3 搜库 质谱分析原始数据采用Proteome Discoverer 2.0 软件进行查库鉴定,数据库为UniProt_ Sciaenidae.fasta (共66 963)、UniProt_Ariidae.fasta (共1 410 条)、UniProt_Ophidiidae.fasta (共554 条)、UniProt_Polynemidae.fasta (共411 条)、UniProt_Pangasiidae.fasta (共21 731 条)、UniProt_ Diodontidae.fasta (共344 条)、UniProt_Centropomidae.fasta (共58 460 条)。检索参数酶切为胰蛋白酶,最大漏切数为2,无固定修饰,可变修饰设置为甲硫氨酸氧化、蛋白N 端乙酰化,蛋白假阳性率≤1%。
2 结果与分析
2.1 氨基酸含量测定
2.1.1 系统适用性 取衍生化后的对照品工作液和样品溶液,在“1.3.1.4” 项条件下进样测定。结果表明,衍生化后的17 种混合氨基酸标准品和样品的色谱图峰形尖锐,分离度良好,可用于鱼鳔样品中氨基酸含量的测定,见图1。

图1 氨基酸标准品(A) 和鱼鳔样品(B) HPLC 代表色谱图Fig.1 Representative HPLC Chromatograms of amino acids standard (A) and swimbladder sample (B)
2.1.2 线性关系考察 分别取“1.3.1.1” 项下浓度为 25.0、50.0、100.0、250.0、500.0、1 000.0、2 500.0 μmol/L 的氨基酸对照品溶液10 μL 进行衍生,在“1.3.1.4” 项条件下进样测定,以各氨基酸标准品的峰面积为纵坐标(Y),其对应的浓度为横坐标(X) 进行回归。如表2 所示,在一定浓度范围内,17 种氨基酸线性关系良好,其相关系数在0.998 3~0.999 9 之间,可以作为定量分析依据。
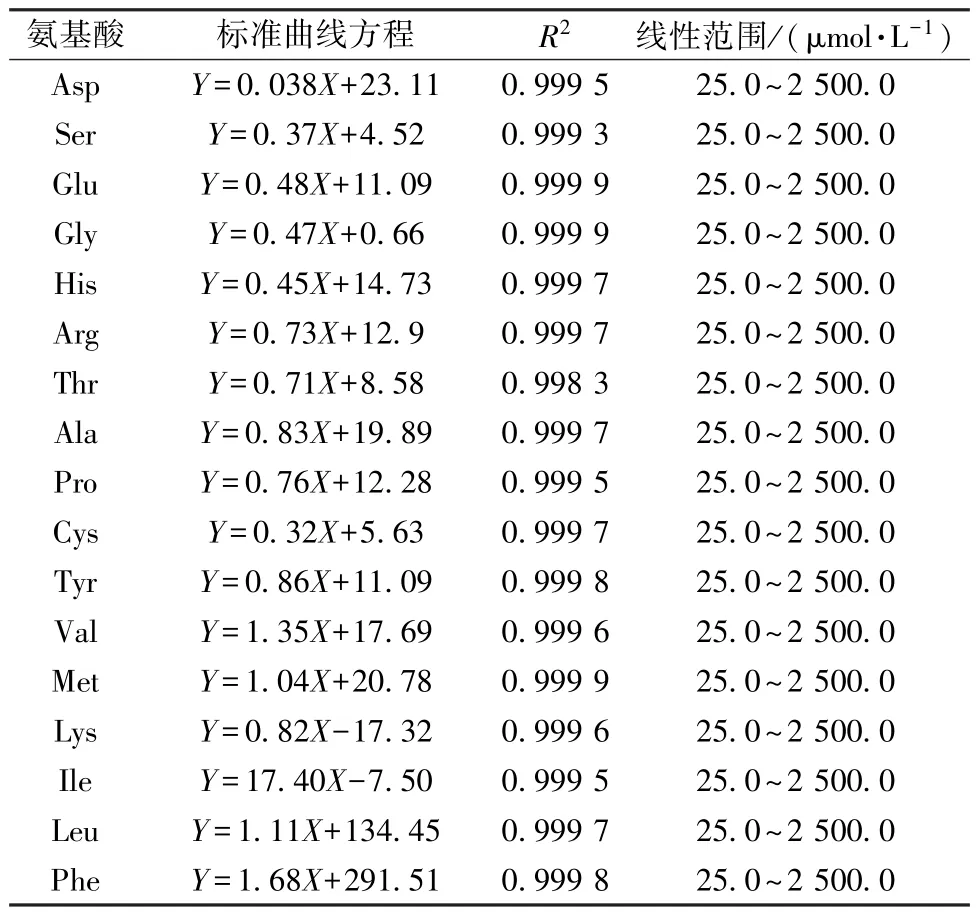
表2 17 种氨基酸的标准曲线、相关系数及线性范围Tab.2 Calibration curves,correlation coefficients and linear ranges of 17 amino acids detected by HPLC
2.1.3 精密度试验 取浓度100.00 μmol/L 的对照品衍生溶液,在“1.3.1.4” 项条件下平行测定6 次,计算17 种氨基酸峰面积测定值的RSD。结果显示,17 种氨基酸峰面积的RSD 为0.28% ~2.28%,表明该方法精密度较好,可用于鱼鳔样品中17 种氨基酸的含量测定。
2.1.4 稳定性试验 取样品S1 制备样品溶液,在“1.3.1.4” 项条件下分别于0、12、24、30 h进样测定,计算不同时间点17 种氨基酸峰面积测定值的RSD。结果显示,17 种氨基酸在30 h 内峰面积测定值RSD 为0.80% ~1.78%,表明样品在30 h内稳定性良好。
2.1.5 重复性试验 取样品S1 5 份,每份0.05 g,平行制备5 份样品溶液,在“1.3.1.4” 项条件下进样测定,计算17 种氨基酸含量并计算RSD。结果显示,17 种氨基酸含量计算值的RSD 为1.21% ~3.25%,表明该方法的重复性较好。
2.1.6 加样回收率试验 取已知氨基酸浓度的样品S1 6 份,每份约0.01 g,精密称量,置于耐压管中,每3 份为一组,第一组加入1.0 mL 浓度均为2.5 mmol/L 的17 种氨基酸对照品溶液,第二组加入150 μL 浓度均为2.5 mmol/L 的17 种氨基酸对照品溶液,按照“1.3.1.2” 项下方法水解样品,取5 mL 水解样品,置于蒸发皿中,80 ℃水浴蒸干,用4 mL 超纯水分3 次洗涤蒸干后的固体产物,将洗涤液转移至5 mL 量瓶中,用超纯水定容,过0.22 μm 滤膜,即得样品溶液。在“1.3.1.4”项条件下进样测定,通过第一组样品的测定结果,计算Asp、Ser、Glu、Gly、Arg、Thr、Ala、Pro、Val、Lys、Leu 的回收率以及RSD; 通过第二组样品的测定结果,计算His、Cys、Tyr、Met、Ile、Phe 的回收率以及RSD。结果显示,Asp、Ser、Glu、Gly、Arg、Thr、Ala、Pro、Val、Lys、Leu 的平均加样回收率为102.69% ~109.60%,RSD 为0.57% ~3.46%; His、Cys、Tyr、Met、Ile、Phe 的平均加样回收率为85.62% ~108.00%,RSD 为1.17% ~4.43%,加样回收率较好,满足鱼鳔样品中氨基酸的含量测定要求。
2.1.7 鱼鳔样品中氨基酸含量测定 取16 批鱼鳔样品各3 份,每份0.05 g,精密称量,平行制备3份样品溶液,在“1.3.1.4” 项条件下进样测定,结果见表3。16 批鱼鳔样品均检出17 种氨基酸,但氨基酸总量存在差异,介于468.31~620.05 mg/g之间。在测定的氨基酸中,含量最高者为甘氨酸,达到110.43 ~133.91 mg/g,约占总量的21.50% ~24.35%,其次为脯氨酸、精氨酸、谷氨酸和丙氨酸,上述5 种氨基酸的含量占总量的60.42% ~69.61%,为鱼鳔中的优势氨基酸。大部分鱼鳔中含量最低的氨基酸为半胱氨酸,平均为5.16 mg/g,与酪氨酸含量接近,这与段振华等[20]的研究结果相似。
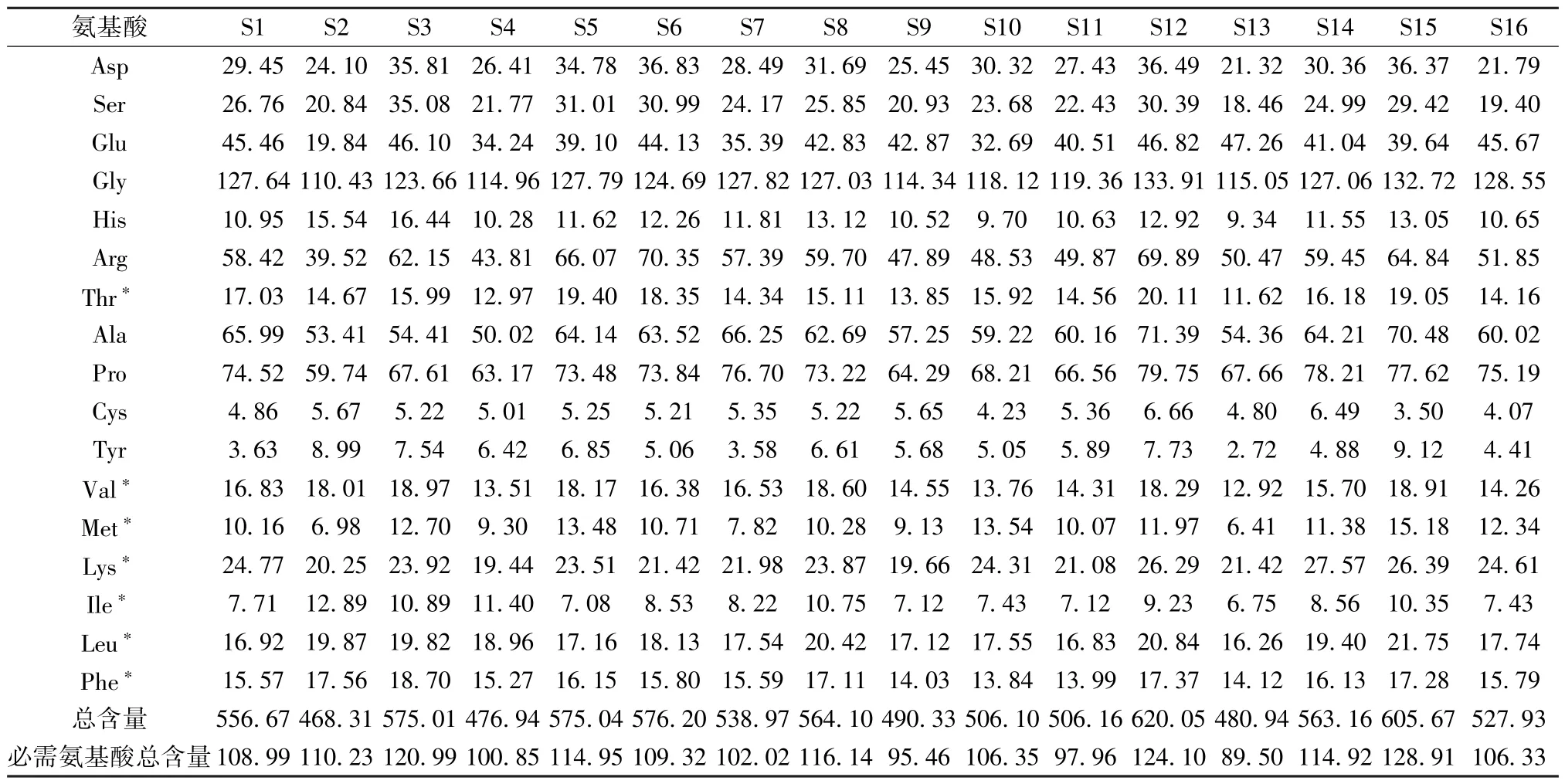
表3 16 批市售鱼鳔中氨基酸种类及含量(mg/g,n=3)Tab.3 Kinds and contents of amino acids in 16 batches of commercially swim-bladders (mg/g,n=3)
鱼鳔中的氨基酸与其风味和功效密切相关,鱼鳔具有特殊的鲜味,其鲜味来源于其中的谷氨酸、天冬氨酸、甘氨酸、丙氨酸、苯丙氨酸和酪氨酸[21],6 种呈味氨基酸的含量占总量的49.77% ~52.98%。鱼鳔中精氨酸的平均含量为56.26 mg/g,精氨酸能显著提高精子的数量以及活力,在治疗由于少精、精子活力低引起的男性不育症中有良好的疗效[22]。在临床应用中,鱼鳔常用于治疗少精和精子活力低导致的男性不育症,这可能与其含有较高含量的精氨酸有关[23]。
传统经验认为,石首鱼科鱼类的鱼鳔质量优于其它种类的鱼鳔,市场上石首鱼科的鱼鳔价格也相对较高[9-10]。本研究所收集的16 批鱼鳔共来源于10 种鱼类,其中S1 ~S8 来源于非石首鱼科,S9 ~S16 则来源于石首鱼科。不同基原的鱼鳔氨基酸含量存在一定的差异,如S2 商品名为葫芦胶,来源于海鲇科的派氏沼海鲇,其氨基酸总含量最低,为468.31 mg/g; 氨基酸总含量最高的为S12,来源于石首鱼科的长吻拟牙,其氨基酸总含量可达620.05 mg/g。虽然S2 的总氨基酸含量低于S12,但S2 所含氨基酸中必需氨基酸占氨基酸总含量的23.5% (110.23 mg/g),高于 S12 的 20.0%(124.10 mg/g)。进一步对16 批鱼鳔中氨基酸含量进行了主成分分析并绘制散点图,结果见图2,S1~S8 和S9~S16 在第一和第二主成分上未能明显地区分开,初步表明石首鱼科和非石首鱼科的鱼鳔中的氨基酸成分差异并不明显。

图2 16 批鱼鳔样品氨基酸主成分分析图Fig.2 Principal component analysis of amino acids in 16 batches swim-bladder samples
市场上的鱼鳔种类繁多,对鱼鳔的真伪优劣评价仅依赖于传统的经验,缺乏统一的标准,氨基酸是鱼鳔的主要成分之一,氨基酸的组成及含量是衡量鱼鳔质量的重要指标,考虑到不同鱼种的鱼鳔氨基酸含量的差异,应将鱼鳔中含量较高的甘氨酸、脯氨酸、精氨酸、谷氨酸等作为重要指标,同时与其它指标,如脂肪酸和矿物质等的组成及含量进行结合,共同作为制定鱼鳔质量标准的依据,以全面、客观地评价鱼鳔的质量。
2.2 鱼鳔样品中蛋白质SDS-PAGE 分析 由图3可知,16 批鱼鳔中蛋白质在分子质量52 ~270 kDa内均有分布,且蛋白条带的颜色深浅有较高的相似性,表明不同的鱼鳔样品中的蛋白质成分比较接近。在分子质量95~130 kDa 和175 ~270 kDa 明显存在一些高丰度的蛋白,与Cruz-López 等[24]通过酸法、酶法提取出的鱼鳔中Ⅰ型胶原蛋白相似。已有研究表明,鱼鳔中含量最多的蛋白质为由2 条α1 链和1 条α2 链组成的Ⅰ型胶原蛋白,分子质量为110~130 kDa,并含2 条α 链聚合的β 链及3 条α 链聚合的γ 链,且多肽链中最常见的三肽单位是G-X-Y (G 为甘氨酸,X、Y 通常分别为脯氨酸和羟脯氨酸)[25-26]。由图3 可知,95~130 kDa 明显存在2 种高丰度蛋白,应分别为Ⅰ型胶原蛋白的α1链和α2 链,175~270 kDa 范围内的高丰度蛋白则可能为Ⅰ型胶原蛋白的β 链和γ 链,此结果与前述氨基酸含量的测定结果相吻合。
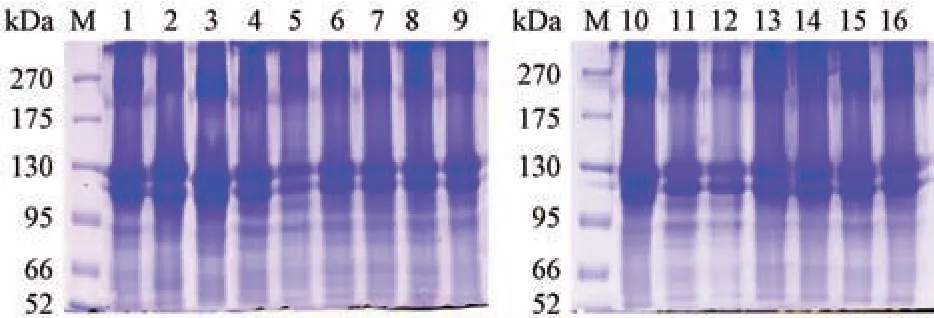
图3 鱼鳔蛋白质SDS-PAGE 图谱Fig.3 SDS-PAGE patterns of proteins from swim-bladders
除Ⅰ型胶原蛋白,在52 ~95 kDa 范围内还存在较多的低丰度蛋白。研究表明,鱼鳔胶原蛋白具有组织相容性、低抗原性等特点,用于生物医用材料、高分子复合材料具有独特的优势[27],现有的工业超声波胶原蛋白提取系统可高效提取鱼鳔中的胶原蛋白,但后续的胶原蛋白纯化程度不够理想[28],本研究结果初步表明,鱼鳔中含有较多分子量52~95 kDa 的蛋白质,其分子量较胶原蛋白小,因此,可考虑利用超滤技术,除去分子质量相对较小的杂蛋白,高效简便地实现胶原蛋白的纯化。
2.3 鱼鳔样品中蛋白质鉴定分析 通过蛋白质组学分析,在16 批鱼鳔样本中共鉴定688 种蛋白质,其中547 种(80%) 蛋白质分子量≤100 kDa (见图4),表明鱼鳔中含有丰富的低分子量的蛋白质,与前述SDS-PAGE 分析结果基本吻合。

图4 鱼鳔中蛋白质分子质量分布Fig.4 Molecular weight distribution of proteins in swim-bladder samples
共鉴定胶原蛋白有11 种(表4),其中,I 型胶原蛋白的α1 链和α2 链覆盖度均达到40%,Ⅱ型、Ⅵ型和Ⅶ型胶原蛋白覆盖度均≥10%,此外还有Ⅳ型、Ⅴ型等胶原蛋白。由此可见,鱼鳔中所含蛋白质以Ⅰ型胶原蛋白为主,其它种类的胶原蛋白为辅。另外,鱼鳔中还含有多种非胶原蛋白质,如作为细胞骨架的角蛋白,其与胶原蛋白类似,具有良好的生物相容性,可用于制作促进伤口愈合的复合材料等[29],具有良好的应用前景。对鱼鳔中蛋白质种类的全面鉴定分析可为更深入地研究和开发利用鱼鳔提供参考。
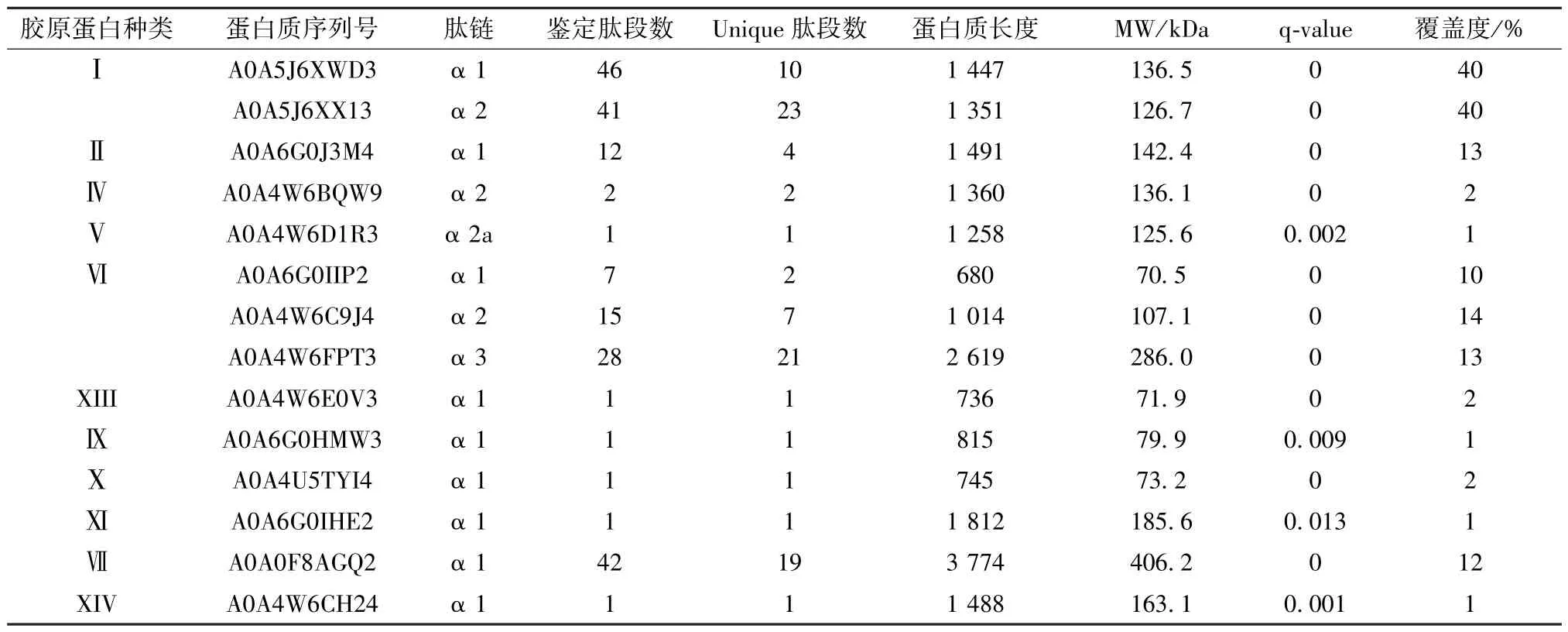
表4 鱼鳔中鉴定得到的胶原蛋白Tab.4 Identified collagens in swim-bladders
3 结论
本实验建立了AQC 柱前衍生结合超高效液相色谱同时测定鱼鳔中17 种氨基酸的方法,该方法具有良好的精密度、重复性、稳定性和回收率。通过提取鱼鳔中蛋白质,采用SDS-PAGE 对鱼鳔中蛋白质的分子量分布等特征进行研究,同时采用蛋白质组学的方法对鱼鳔中的蛋白质种类进行鉴定。结果表明,不同基原的鱼鳔均含有17 种氨基酸,且含量非常丰富,氨基酸总含量的平均值达到539.47 mg/g,甘氨酸在鱼鳔中的含量最高,其次为脯氨酸、精氨酸、谷氨酸和丙氨酸。甘氨酸具有维持前列腺健康等功能,丙氨酸、谷氨酸可与甘氨酸组成复合制剂,用于治疗前列腺炎和前列腺肥大,精氨酸则能显著提高精子质量,常用于治疗男性不育症,鱼鳔中的优势氨基酸为其补肾固精、滋养筋脉等功效提供了一定的理论依据和物质基础。通过对鱼鳔中氨基酸含量进行主成分分析,结果显示不同的鱼鳔样品在第一和第二主成分上没有明显区分开,表明不同来源的鱼鳔中的氨基酸成分差异不明显。
鱼鳔中的蛋白质主要为Ⅰ型胶原蛋白,SDSPAGE 分析结果表明鱼鳔中蛋白质分子量在52 ~270 kDa 均有分布,除95~130 kDa 和175~270 kDa的丰度较高的I 型胶原蛋白链外,在52~95 kDa 还存在较多的低丰度蛋白,从蛋白条带的分子质量和颜色深浅分析,不同的鱼鳔中蛋白质成分具有较高的相似性。通过蛋白质组学对鱼鳔中的蛋白质种类进行鉴定,发现鱼鳔含有多达11 种胶原蛋白,同时含有多种用途广泛的非胶原蛋白质,如角蛋白等。
综上所述,鱼鳔中氨基酸含量及蛋白质成分的系统分析,为鱼鳔的质量控制及品质评价提供了科学依据,也为其深层次的开发利用提供了新思路。
