补肾活血膏方对肾虚血瘀证强直性脊柱炎患者的临床疗效
2024-03-12杨晔颖何东仪于盈盈
杨晔颖,何东仪,薛 鸾,于盈盈,程 鹏,孙 宇,苏 励∗
(1.上海中医药大学附属龙华医院,上海 200032; 2.上海光华中西医结合医院,上海 200030; 3.上海中医药大学附属岳阳中西医结合医院,上海 200437; 4.青浦区中医医院,上海 201700)
强直性脊柱炎是一种以骶髂关节、脊柱附着点炎症为主要症状的常见慢性炎症性疾病,好发于青壮年,发病率为0.1% ~1.6%,本病病程长,目前仍无根治办法,多数患者需长期治疗,严重影响其身心健康,加重经济负担,是重大公共卫生问题之一[1-2]。现代医学主要采用非甾体抗炎药、抗风湿药、糖皮质激素、生物制剂等治疗强直性脊柱炎,但疗效有限,而且存在不良反应多、价格昂贵等诸多缺点[3]。
中医认为,强直性脊柱炎属于“痹病” 范畴,乃肾督亏虚,风、寒、湿、热之邪趁虚侵入肾督,深入骨骱,滞留于脊柱而形成本病[4],相关治疗手段丰富,如中药内服、中药外治 (熏洗、贴敷)、中药离子导入、针刺、灸法、推拿等等,联合常规治疗可减轻疼痛,降低急性时相炎症指标,提高疗效,减少西药副作用[5]。上海中医药大学附属龙华医院陈湘君、施杞等教授长期从事强直性脊柱炎研究,认为其病机关键在于肾虚督寒、痰瘀阻络,并以温肾强督、活血通络等法进行治疗,收到了显著效果[6-7]。
膏方治疗有较好的理论基础和临床优势,能有效缓解强直性脊柱炎患者僵直疼痛、神疲乏力等问题,有助于改善整体临床症状,也可提升生活质量[8-9],但鲜有关于膏方治疗强直性脊柱炎的临床报道,大部分仅局限于用药经验、个案报道,缺乏循证医学依据[8]。课题组前期以益肾温督膏方、补肾活血膏方(由阳和汤、独活寄生汤等方加减而成) 治疗强直性脊柱炎,显示了较好的疗效和安全性[10-11],而本研究考察补肾活血膏方对肾虚血瘀证强直性脊柱炎患者的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料 2016 年7 月至2019 年3 月于上海中医药大学附属龙华医院、上海中医药大学附属岳阳中西医结合医院、上海光华中西医结合医院风湿科门诊及病房住院的183 例强直性脊柱炎患者,其间失访、脱落16 例,最终完成全部治疗和随访观察的共167 例(3 家医院患者分别为72、40、55例),以是否接受补肾活血汤或补肾活血膏方为暴露因素形成队列,分为对照组(55 例),年龄最小23 岁,最大64 岁; 暴露组54 例,年龄最小21岁,最大61 岁; 高暴露组58 例,年龄最小18 岁,最大63 岁,3 组其他一般资料见表1,可知差异无统计学意义(P>0.05),具有可比性。研究经上海中医药大学附属龙华医院伦理委员会批准(BF.20160401502)。
表1 3 组一般资料比较(±s)Tab.1 Comparison of general data among the three groups (±s)
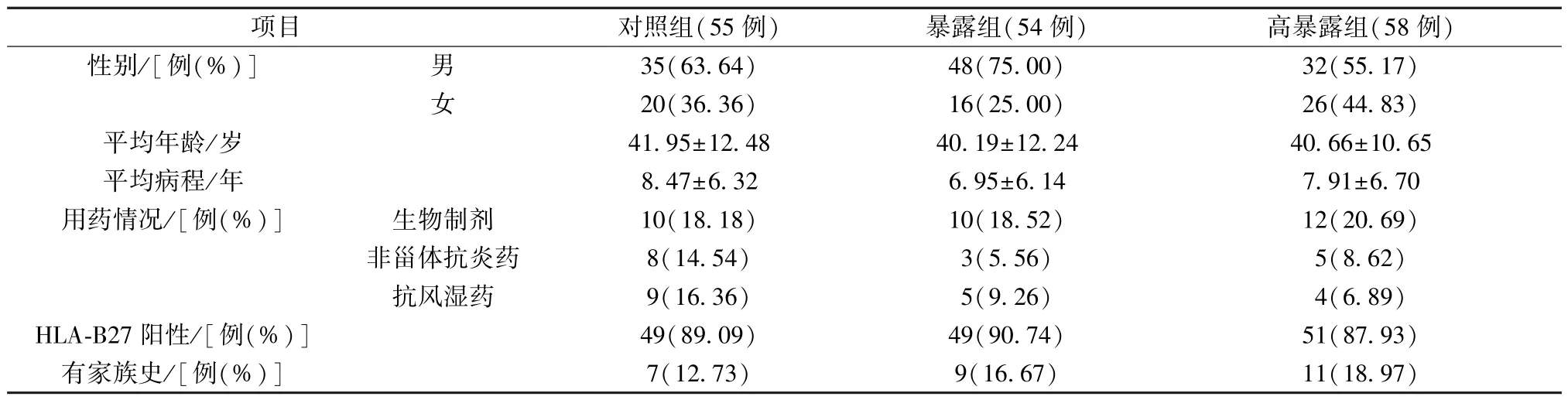
表1 3 组一般资料比较(±s)Tab.1 Comparison of general data among the three groups (±s)
项目对照组(55 例)暴露组(54 例)高暴露组(58 例)性别/[例(%)]男35(63.64)48(75.00)32(55.17)女20(36.36)16(25.00)26(44.83)平均年龄/岁41.95±12.4840.19±12.2440.66±10.65平均病程/年8.47±6.326.95±6.147.91±6.70用药情况/[例(%)]生物制剂10(18.18)10(18.52)12(20.69)非甾体抗炎药8(14.54)3(5.56)5(8.62)抗风湿药9(16.36)5(9.26)4(6.89)HLA-B27 阳性/[例(%)]49(89.09)49(90.74)51(87.93)有家族史/[例(%)]7(12.73)9(16.67)11(18.97)
1.2 诊断标准
1.2.1 西医(强直性脊柱炎) 参照1984 年修订的纽约标准[12],根据临床表现、影像学检查确诊。
1.2.2 中医(肾虚血瘀证) 参照国家中医药管理局“十一五” 重点专科协作组大偻(强直性脊柱炎) 诊疗方案[13],主证①腰背刺痛,部位固定;②腰背僵硬,晨起活动不利,次证①神疲乏力;②腰膝酸软,耳鸣; ③面色少华; 舌质淡或紫,苔薄或少苔,脉沉细或沉弦或涩。主证符合2 条,次证符合2 条或2 条以上,兼见相应舌脉者即可辨证。
1.3 纳入标准 ①符合“1.2” 项下诊断标准,影像学提示骶髂关节炎Ⅱ级或III 级; ②年龄18 ~65 岁,性别不限; ③患者签署知情同意书,并遵守相关要求。
1.4 排除标准 ①晚期脊柱强直、脊柱关节僵直畸形,影像学提示为Ⅳ级或Ⅳ级以上; ②合并其他严重的活动性炎症性疾病; ③合并其他风湿免疫性疾病; ④妊娠期或哺乳期妇女; ⑤拟进行强直性脊柱炎手术、针灸等其他措施; ⑥合并严重心脑血管、肾脏病、肝肾功能不全等严重原发性疾病;⑦有精神病、肿瘤或沟通认知功能障碍; ⑧严重过敏体质,或对本研究药物过敏; ⑨同期已参加其他临床试验。
1.5 治疗手段
1.5.1 对照组 采用常规治疗,包括非甾体抗炎药、抗风湿药、皮质类固醇激素、生物制剂等,但不进行手术,疗程2 年。
1.5.2 暴露组 在对照组基础上给予补肾活血汤剂,组方药材补骨脂15 g、骨碎补15 g、仙灵脾15 g、狗脊10 g、桑寄生30 g、熟地30 g、川牛膝15 g、当归10 g、川芎10 g、红花5 g,由上海中医药大学附属龙华医院中药房提供,处方由中级以上高年资中医师开处,随症加减,每年至少服用8 个月,疗程2 年。
1.5.3 高暴露组 在暴露组基础上给予补肾活血膏方,组方药材熟地黄、鸡血藤、阿胶、鹿角胶、龟甲胶、鳖甲胶、补骨脂、狗脊、骨碎补、续断、仙灵脾、桑寄生、杜仲、巴戟肉、黄芪、生地黄、女贞子、当归、旱莲草、川芎、忍冬藤、独活、僵蚕、三棱、莪术、红花、三七、延胡索、丹参、土鳖虫、炮穿山甲、全蝎、蜈蚣、鸡内金、谷芽、焦山楂、陈皮、砂仁等,随症加减,一人一方,以木糖醇为矫味剂,由上海中医药大学附属龙华医院制剂室制成膏方,分为120 个小包装,每天早晚各1包,可烊化开水冲服或嚼服,用药时间冬至到立春,约45~60 d,疗程2 年。
1.6 指标检测
1.6.1 疾病活动度 采用强直性脊柱炎国际评估工作组(ASAS) 制定的巴氏强直性脊柱炎活动指数(BASDAI) 和强直性脊柱炎疾病活动评分-C 反应蛋白 (ASDAS-CRP),其中前者是对疲乏、中轴、外周关节疼痛、晨僵、触痛或压痛的评分,总分10 分,得分越高,疾病活动度越高,<4 分为轻度活动,4 ~6 分为中度活动,>6 分为重度活动;后者计算公式为ASDAS-CRP =0.121×背痛+0.058×晨僵持续时间+0.11×患者总体评估+0.073×外周关节肿胀或压痛+0.579×ln (CRP+1),判断标准[13-14]为不活动,ASDAS-CRP <1.3; 中疾病活动,1.3≤ASDAS-CRP<2.1; 高疾病活动,2.1≤ASDAS-CRP<3.5; 极高疾病活动,ASDAS-CRP≥3.5。
1.6.2 功能评价 采用ASAS 推荐的巴氏强直性脊柱炎功能指数(BASFI)、脊柱痛、患者总体评价评分 (PGA) 和巴氏强直性脊柱炎度量指数(BASMI)[9-10,13],其中BASFI 采用VAS 法,共10个问题,每个问题0~10 分,取平均分; BASMI 包括测量耳缘到墙的距离、腰部弯曲、颈部旋转、腰部侧弯、踝间距,根据其程度评分0 ~2 分; 脊柱痛、患者总体评价评分(PGA) 均采用VAS 法,评分范围均为0~10 分,得分越高,症状越重,功能越差。
1.6.3 影像学评价 采用GE Discovery MR750 扫描仪进行磁共振成像检查,在骶髂关节斜冠状位进行加拿大脊柱关节炎研究协会 (SPARCC) 评分[15],包括骨髓水肿累及范围、水肿强度和水肿深度,满分72 分,得分越高,骶髂关节骨髓水肿程度越重。
1.6.4 生活质量 采用强直性脊柱炎生活质量调查问卷(ASQoL)[16],总分0 ~18 分,得分越高,生存质量越差。
1.6.5 中医证候评分 参照国家中医药管理局“十一五” 重点专科协作组大偻(强直性脊柱炎)诊疗方案[13]进行分级和评分,得分总和即为中医证候评分。
1.6.6 炎症指标 包括血沉(ESR)、C 反应蛋白(CRP)、白介素-6 (IL-6)、肿瘤坏死因子-α(TNF-α)、IL-17、IL-23、IL-35、中性粒细胞与淋巴细胞比(NLR)、血小板/淋巴细胞(PLR),进行血常规检查后采用自动化血液分析仪计算NLR和LMR,免疫比浊法检测CRP 水平,魏氏法检测ESR,酶联免疫吸附实验检测IL-6、TNF-α、IL-17、IL-23、IL-35 水平。
1.6.7 安全性指标 每3 个月检测1 次血常规、尿常规、心电图、肝功能、肾功能,并记录治疗期间不良事件,对实验、临床出现的异常情况与药物相关性进行分析。
1.7 疗效评价 根据ASAS[13-14]制定如下标准,①ASAS20,与基线值比较,4 项指标 (脊柱痛、BASFI、PGA 和BASDAI 最后2 道问题的平均得分) 中3 项改善程度至少达到20%,并且绝对分值至少有1 分的进步,剩余指标恶化程度<20%并且<1 分; ②ASAS40,与基线值比较,上述4 项指标中3 项改善程度至少达到40%,绝对分值至少有2 分的进步,无恶化指标; ③ASAS5/6,与基线值比较,6 项指标(脊柱痛、BASFI、PGA、BASDAI最后2 道问题平均得分、CRP、脊柱活动度) 中至少有5 项改善程度至少达到20%; ④BASDAI50,与基线值比较,BASDAI 改善程度达50%。
1.8 统计学处理 通过SPSS 24.0 软件进行处理,符合正态分布的计量资料以(±s) 表示,多个时间点比较采用重复测量方差分析,组间比较采用独立样本t检验,而不符合者以中位数表示,组间比较采用Mann-WhitneyU秩和检验; 计数资料以百分率表示,组间比较采用卡方检验。Logistic 回归分析考察影响疗效的因素,以影响因子为自变量。以P<0.05 为差异具有统计学意义。
2 结果
2.1 临床疗效 治疗后12、24 个月,暴露组、高暴露组ASAS20、ASAS40、ASAS5/6、BASDAI50例数多于对照组(P<0.05); 治疗后12 个月,高暴露组ASAS20、ASAS40、ASAS5/6、BASDAI50例数多于暴露组,但差异无统计学意义 (P>0.05); 治疗后24 个月,高暴露组 ASAS40、ASAS5/6、BASDAI50 例数多于暴露组(P<0.05),高暴露组ASAS20 例数多于暴露组,但差异无统计学意义(P>0.05),见表2~3。

表2 3 组临床疗效比较(治疗后12 个月) [例(%) ]Tab.2 Comparison of clinical effects among the three groups ( 12 months after the treatment )[case (%) ]
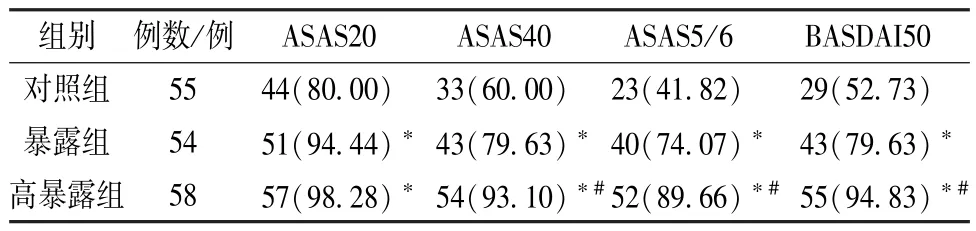
表3 3 组临床疗效比较(治疗后24 个月) [例(%) ]Tab.3 Comparison of clinical effects among the three groups ( 24 months after the treatment )[case (%) ]
再对临床疗效影响因素进行单因素、多因素分析,自变量包括年龄、病程、影像学分级、中医证候、用药时间、用药情况(生物制剂、抗风湿药、补肾活血汤剂、补肾活血膏方),结果见表4。由此可知,多个自变量因素与临床疗效相关,而且存在交互效应(P<0.05); 经Logistic 回归分析校正混杂因素后,补肾活血汤、补肾活血膏方均可提高临床疗效(P<0.05)。
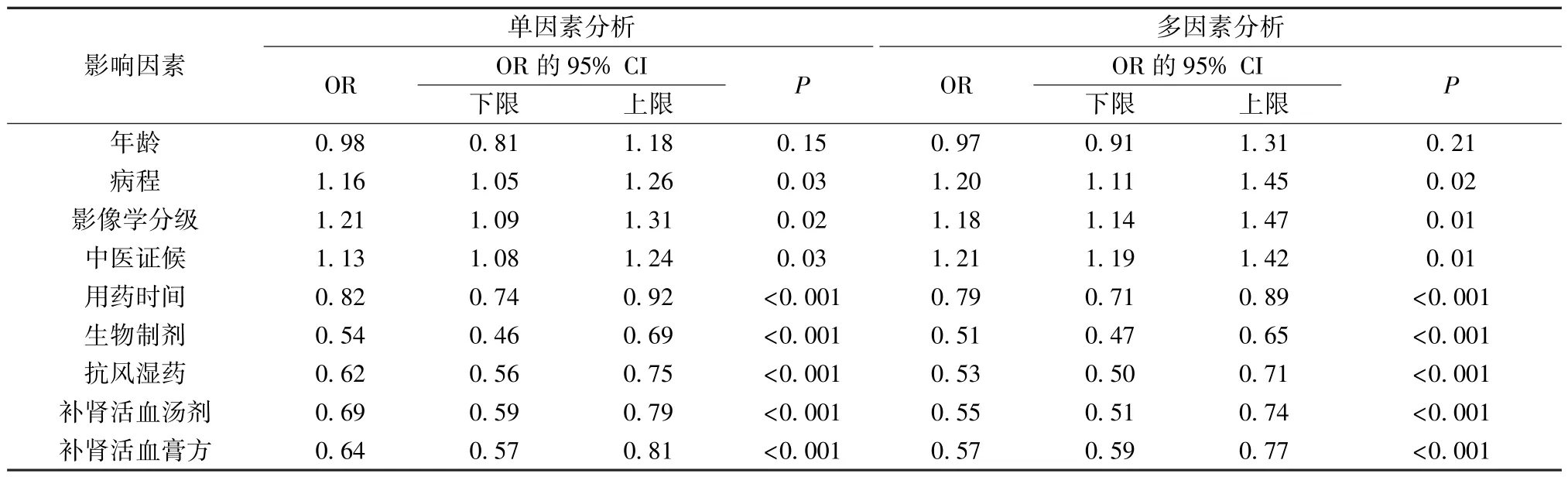
表4 临床疗效影响因素的单因素、多因素分析结果Tab.4 Results for univariate and multivariate analysis of influencing factors of clinical effects
2.2 BASDAI 评分、ASDAS-CRP 治疗后12、24个月,3 组BASDAI 评分、ASDAS-CRP 降低(P<0.05); 暴露组和高暴露组BASDAI 评分、ASDASCRP 低于同期对照组 (P<0.05); 高暴露组BASDAI 评分、ASDAS-CRP 低于同期暴露组(P<0.05),见表5。
表5 3 组BASDAI 评分、ASDAS-CRP 比较(±s)Tab.5 Comparison of BASDAI scores and ASDAS-CRPs among the three groups (±s)
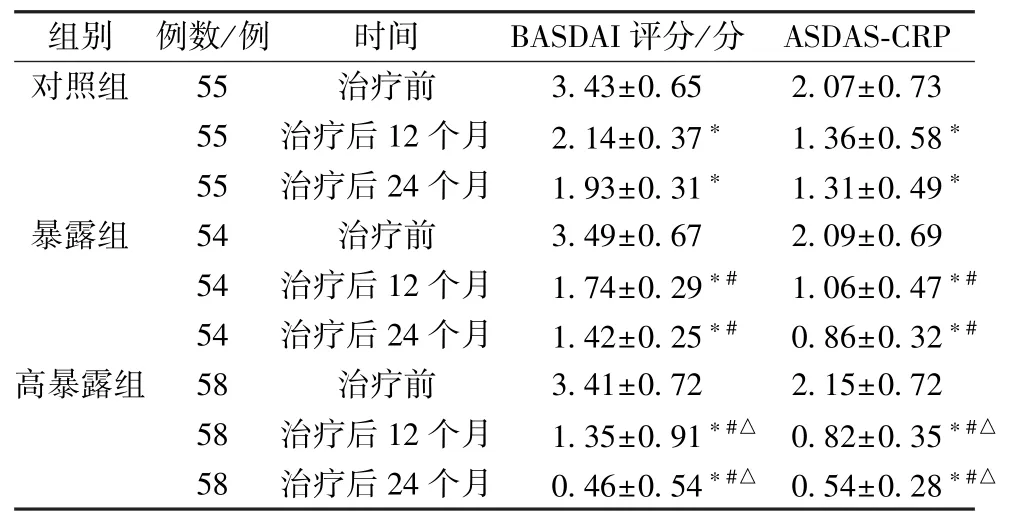
表5 3 组BASDAI 评分、ASDAS-CRP 比较(±s)Tab.5 Comparison of BASDAI scores and ASDAS-CRPs among the three groups (±s)
注: 与同组治疗前比较,∗P<0.05; 与对照组治疗后同一时间点比较,#P<0.05; 与暴露组治疗后同一时间点比较,△P<0.05。
组别 例数/例时间BASDAI 评分/分 ASDAS-CRP对照组55治疗前3.43±0.652.07±0.73 55治疗后12 个月2.14±0.37∗1.36±0.58∗55治疗后24 个月1.93±0.31∗1.31±0.49∗暴露组54治疗前3.49±0.672.09±0.69 54治疗后12 个月1.74±0.29∗#1.06±0.47∗#54治疗后24 个月1.42±0.25∗#0.86±0.32∗#高暴露组58治疗前3.41±0.722.15±0.72 58治疗后12 个月1.35±0.91∗#△ 0.82±0.35∗#△58治疗后24 个月0.46±0.54∗#△ 0.54±0.28∗#△
再对BASDAI 评分、ASDAS-CRP 进行单因素、多因素分析,结果见表6~7。由此可知,时间、生物制剂、抗风湿药、补肾活血汤剂、补肾活血膏方等因素均与两者有相关性(P<0.05),而且存在交互效应; 经多重线性回归分析校正后,补肾活血汤、补肾活血膏方可明显降低两者(P<0.05)。
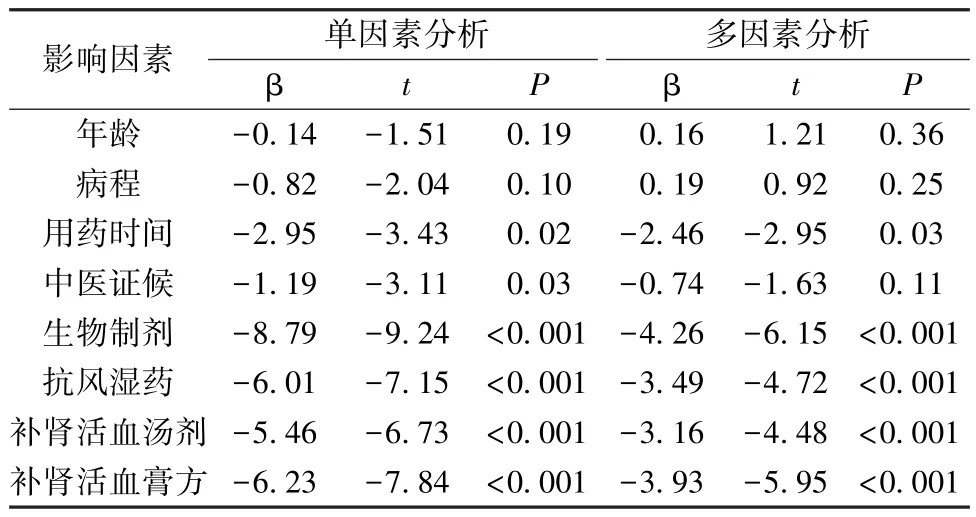
表6 BASDAI 评分影响因素的单因素、多因素分析结果Tab.6 Results for univariate and multivariate analysis of influencing factors of BASDAI scores

表7 ASDAS-CRP 影响因素的单因素、多因素分析结果Tab.7 Results for univariate and multivariate analysis of influencing factors of ASDAS-CRPs
2.3 BASFI 评分、脊柱痛评分、PGA 评分、BASMI 评分 治疗后12、24 个月,3 组BASFI 评分、脊柱痛评分、PGA 评分、BASMI 评分降低(P<0.05); 暴露组和高暴露组四者低于同期对照组(P<0.05); 高暴露组四者低于同期暴露组(P<0.05),见表8。
表8 3 组BASFI 评分、脊柱痛评分、PGA 评分、BASMI 评分比较(±s)Tab.8 Comparison of BASFI scores,spine pain scores,PGA scores and BASMI scores among the three groups (±s)

表8 3 组BASFI 评分、脊柱痛评分、PGA 评分、BASMI 评分比较(±s)Tab.8 Comparison of BASFI scores,spine pain scores,PGA scores and BASMI scores among the three groups (±s)
注: 与同组治疗前比较,∗P<0.05; 与对照组治疗后同一时间点比较,#P<0.05; 与暴露组治疗后同一时间点比较,△P<0.05。
组别例数/例时间BASFI 评分/分脊柱痛评分/分PGA 评分/分BASMI 评分/分对照组55治疗前4.96±0.754.75±0.815.09±0.744.87±0.65 55治疗后12 个月2.89±0.53∗2.08±0.47∗2.48±0.46∗2.21±0.42∗55治疗后24 个月1.91±0.36∗1.72±0.35∗2.01±0.34∗1.87±0.29∗暴露组54治疗前4.87±0.724.83±0.765.13±0.774.93±0.68 54治疗后12 个月2.23±0.46∗#1.67±0.31∗#1.92±0.33∗#1.84±0.41∗#54治疗后24 个月1.37±0.34∗#1.25±0.27∗#1.51±0.29∗#1.19±0.24∗#高暴露组58治疗前4.91±0.744.88±0.795.06±0.744.81±0.69 58治疗后12 个月1.76±0.38∗#△1.22±0.28∗#△1.40±0.31∗#△1.29±0.35∗#△58治疗后24 个月0.94±0.23∗#△0.74±0.25∗#△1.04±0.22∗#△0.91±0.23∗#△
2.4 SPARCC 评分、ASQoL 评分、肾虚血瘀证评分 治疗后12、24 个月,3 组SPARCC 评分、ASQoL 评分、肾虚血瘀证评分降低(P<0.05); 暴露组和高暴露组三者低于同期对照组(P<0.05);高暴露组三者低于同期暴露组 (P<0.05),见表9。
表9 3 组SPARCC 评分、ASQoL 评分、肾虚血瘀证评分比较(±s)Tab.9 Comparison of SPARCC scores,ASQoL scores and Kidney Deficiency and Blood Stasis Syndrome scores among the three groups (±s)

表9 3 组SPARCC 评分、ASQoL 评分、肾虚血瘀证评分比较(±s)Tab.9 Comparison of SPARCC scores,ASQoL scores and Kidney Deficiency and Blood Stasis Syndrome scores among the three groups (±s)
注: 与同组治疗前比较,∗P<0.05; 与对照组治疗后同一时间点比较,#P<0.05; 与暴露组治疗后同一时间点比较,△P<0.05。
组别例数/例时间SPARCC 评分/分ASQoL 评分/分肾虚血瘀证评分/分对照组55治疗前14.27±2.5412.65±2.2114.47±4.29治疗后12 个月7.95±1.83∗8.08±1.78∗12.24±3.83∗治疗后24 个月5.27±1.26∗6.45±1.57∗10.65±3.57∗暴露组54治疗前14.08±2.5712.58±2.1215.13±4.31治疗后12 个月6.55±1.57∗#6.16±1.49∗#8.96±1.76∗#治疗后24 个月4.12±1.15∗#4.87±1.33∗#5.45±1.29∗#高暴露组58治疗前14.33±2.4812.45±2.3714.87±4.06治疗后12 个月5.11±1.24∗#△5.28±1.36∗#△7.14±1.45∗#△治疗后24 个月3.26±0.94∗#△3.11±0.89∗#△3.45±0.96∗#△
2.5 ESR、CRP 水平、NLR、PLR 比较 治疗后12、24 个月,3 组ESR、CRP 水平、NLR、PLR 降低(P<0.05); 暴露组和高暴露组四者低于同期对照组(P<0.05); 高暴露组ESR、CRP 低于同期暴露组 (P<0.05),而NLR、PLR 无明显变化(P>0.05),见表10。
表10 3 组ESR、CRP 水平、NLR、PLR 比较(±s)Tab.10 Comparison of ESRs,CRP levels,NLRs and PLRs among the three groups (±s)

表10 3 组ESR、CRP 水平、NLR、PLR 比较(±s)Tab.10 Comparison of ESRs,CRP levels,NLRs and PLRs among the three groups (±s)
注: 与同组治疗前比较,∗P<0.05; 与对照组治疗后同一时间点比较,#P<0.05; 与暴露组治疗后同一时间点比较,△P<0.05。
组别例数/例时间ESR/(mm·h-1)CRP/(mg·L-1)NLRPLR对照组55治疗前26.68±4.859.74±1.872.63±0.91149.74±40.25治疗后12 个月17.95±3.43∗7.11±1.56∗2.16±0.83∗124.65±28.83∗治疗后24 个月15.42±2.57∗5.90±1.27∗1.72±0.65∗104.77±18.46∗暴露组54治疗前25.74±5.179.53±1.922.66±0.87147.57±42.64治疗后12 个月15.03±2.84∗#5.87±1.42∗#1.71±0.62∗#106.45±26.58∗#治疗后24 个月13.27±2.19∗#4.76±1.03∗#1.48±0.56∗#93.72±15.49∗#高暴露组58治疗前26.18±5.059.65±1.852.59±0.89145.05±45.78治疗后12 个月13.24±1.87∗#△4.27±0.93∗#△1.52±0.66∗#98.85±24.13∗#治疗后24 个月10.06±1.64∗#△3.82±0.79∗#△1.41±0.53∗#90.45±14.46∗#
2.6 IL-6、TNF-α、IL-17、IL-23、IL-35 水平 治疗后12、24 个月,3 组IL-6、TNF-α、IL-17、IL-23 水平降低 (P<0.05),IL-35 水平升高 (P<0.05); 暴露组和高暴露组IL-6、TNF-α、IL-17、IL-23 水平低于同期对照组(P<0.05),IL-35 水平更高(P<0.05); 高暴露组IL-6、TNF-α、IL-17、IL-23 水平低于同期暴露组(P<0.05),IL-35 水平更高(P<0.05),见表11。
表11 3 组IL-6、TNF-α、IL-17、IL-23、IL-35 水平比较(±s)Tab.11 Comparison of IL-6,TNF-α,IL-17,IL-23 and IL-35 levels among the three groups (±s)
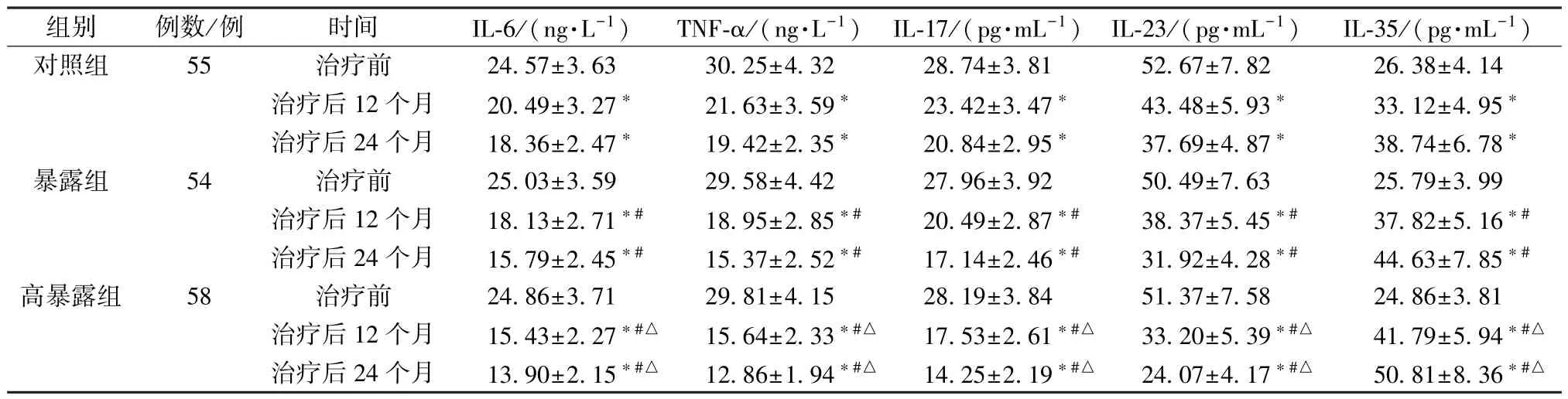
表11 3 组IL-6、TNF-α、IL-17、IL-23、IL-35 水平比较(±s)Tab.11 Comparison of IL-6,TNF-α,IL-17,IL-23 and IL-35 levels among the three groups (±s)
注: 与同组治疗前比较,∗P<0.05; 与对照组治疗后同一时间点比较,#P<0.05; 与暴露组治疗后同一时间点比较,△P<0.05。
组别例数/例时间IL-6/(ng·L-1)TNF-α/(ng·L-1) IL-17/(pg·mL-1) IL-23/(pg·mL-1)IL-35/(pg·mL-1)对照组55治疗前24.57±3.6330.25±4.3228.74±3.8152.67±7.8226.38±4.14治疗后12 个月20.49±3.27∗21.63±3.59∗23.42±3.47∗43.48±5.93∗33.12±4.95∗治疗后24 个月18.36±2.47∗19.42±2.35∗20.84±2.95∗37.69±4.87∗38.74±6.78∗暴露组54治疗前25.03±3.5929.58±4.4227.96±3.9250.49±7.6325.79±3.99治疗后12 个月18.13±2.71∗#18.95±2.85∗#20.49±2.87∗#38.37±5.45∗#37.82±5.16∗#治疗后24 个月15.79±2.45∗#15.37±2.52∗#17.14±2.46∗#31.92±4.28∗#44.63±7.85∗#高暴露组58治疗前24.86±3.7129.81±4.1528.19±3.8451.37±7.5824.86±3.81治疗后12 个月15.43±2.27∗#△15.64±2.33∗#△17.53±2.61∗#△33.20±5.39∗#△41.79±5.94∗#△治疗后24 个月13.90±2.15∗#△12.86±1.94∗#△14.25±2.19∗#△24.07±4.17∗#△50.81±8.36∗#△
2.7 安全性指标 3 组不良反应均为轻、中度,经对症处理后治愈,无严重不良反应发生,见表12。其中,高暴露组不良反应配合滋阴清热中药、调整为饭后用药后缓解,暴露组不良反应可能由非甾体抗炎药长期服用、合并使用阿奇霉素所致,对照组不良反应可能与使用甲氨蝶呤、抗风湿药有关。
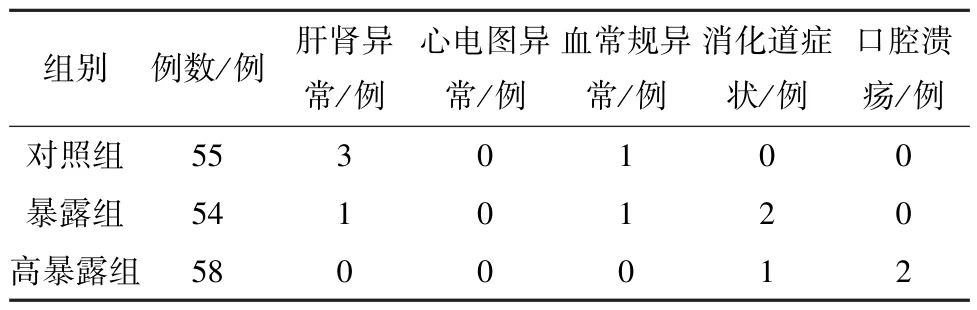
表12 3 组不良反应Tab.12 Adverse reactions in the three groups
3 讨论
目前,临床仍无法彻底改变新骨形成及关节强直,长期用药会使患者面临多种副作用,故安全有效的治疗强直性脊柱炎措施仍为临床迫切需要[17]。中医认为,肾督亏虚、阳气不足是强直性脊柱炎发病之本,国医大师焦树德、朱良春教授[8,18]均认为本病内因为肾督阳虚,风、寒、湿、热之邪乘虚而入痹阻督脉为发病之标实,是引起本病活动的诱因,瘀血阻络是病理关键,并贯穿始终[18],故治疗上强调补肾强督、活血通络之法。
陈湘君教授[6]认为,治疗强直性脊柱炎应强调益肾壮督治本为先,多投以阳和汤合独活寄生汤,药用鹿角片、桑寄生、狗脊、杜仲等温督补肾、强壮筋骨,阿胶、龟甲胶、鳖甲胶、熟地黄、当归等补肾填精、滋阴补血,其中阿胶、鹿角胶、龟甲胶、鳖甲胶等胶类药物,均为血肉有情之品,能营督填精。前期研究显示,益肾温督膏方能明显改善中医证候、关节疼痛、晨僵、疲倦[10],降低强直性脊柱炎小鼠炎症因子(IL-6、IL-23) 水平和关节炎症指数,减轻炎症细胞浸润,改善关节炎症反应[19]。
课题组强调,治疗强直性脊柱炎时要轻外邪、重痰瘀,流畅血脉是关键,“通则不痛,不通则痛”,故化痰活血要贯穿始终[6-7],一则祛寒湿,二则利关节,三则促进气血流通、温运阳气,常用中药包括苏木、接骨木、延胡索、川芎、当归、赤芍、三棱、莪术、全蝎、蜈蚣、乌梢蛇、土鳖虫、炮穿山甲等,并且膏滋厚腻,久服纳呆,故还要重视调畅中州、固护胃气,在补肾活血膏方中宜加入健脾和胃消食中药,如鸡内金、谷芽、焦山楂等。本研究发现,补肾活血膏方能降低ASDAS-CRP、BASFI、BASDAI 评分、脊柱痛、PGA、BASMI、SPARCC、ASQoL 和肾虚血瘀证评分和疾病活动情况,减轻骨髓水肿、疼痛等临床症状,提高关节功能和生活质量,升高ASAS40、ASAS5/6、BASDAI50例数,有着较好的临床疗效。
多种炎症因子参与了强直性脊柱炎的病理进程,其中ESR、CRP 广泛用于强直性脊柱炎炎症活动情况的评价,并且后者还用于评价预测结构损伤进展及治疗反应性,但均为非特异性炎症指标,影响因素多,异常比率低[20]; NLR 和PLR 是全身炎症指标,与强直性脊柱炎炎症活动密切相关,可用于评估本病炎症状态[21]。强直性脊柱炎发病部位有大量的巨噬细胞、单核细胞浸润,其分泌的多种炎症因子参与了关节附着点炎症损伤,其中TNF-α 可刺激滑膜细胞合成前列腺素E2,引起疼痛,并可抑制碱性磷酸酶、胶原蛋白合成,促进软骨细胞分泌纤维蛋白溶酶激活剂,造成骨、软骨破坏,加速关节炎性损伤[22]; 高水平IL-6 除了可引起关节病理损伤外,还能诱导CRP 和成纤维蛋白生成,诱发韧带骨化,并可启动Th17 细胞分化,抑制Treg 细胞,加剧炎症反应[22]; IL-17、IL-23是Th17 细胞效应因子,IL-23/IL-17 炎症轴是引起强直性脊柱炎的关键环节,可直接诱导成骨细胞生成,导致骨强直[23]; IL-35 是Treg 细胞分泌的抑制性因子,可促进Treg 细胞增殖,抑制Th17 细胞及其效应因子的产生,从而抑制炎症反应,有助于关节炎症状的减轻[24]。本研究方向,补肾活血膏方能降低ESR、CRP 水平、NLR、PLR、IL-6、TNFα、IL-17、IL-23 水平,升高IL-35 水平,从而抑制炎性损伤,控制病情进展。
综上所述,补肾活血膏方对强直性脊柱炎患者可起到抗炎作用,降低疾病活动度,减轻骨髓水肿,改善临床症状,提高关节功能和生活质量,有着较好的临床疗效和安全性。
