基于IL-25/NF-κB 信号通路探讨益气温阳护卫汤对支气管哮喘大鼠气道炎症的改善作用
2024-03-12夏阿信向双娣苏小璞黄帅亮余建玮
夏阿信,向双娣,苏小璞,黄帅亮,余建玮
(1.江西中医药大学,江西 南昌 330004; 2.江西中医药大学附属医院,江西 南昌 330006)
支气管哮喘是一种常见慢性气道炎症疾病,全球哮喘患者超过3 亿人,我国成年哮喘患者约4 000万人,其发病率逐年升高[1]。支气管哮喘不能根治,但可通过规范化治疗有效控制症状。支气管哮喘的本质是由多种炎症细胞、炎症介质、细胞因子等相互作用产生的慢性气道炎症[2],因此控制气道炎症是治疗支气管哮喘的关键。IL-25 是Th2 免疫应答的放大器,可以诱导Th2 细胞释放细胞因子如IL-4、IL-5 和IL-13 来增强2 型免疫应答,诱导IgE 产生和嗜酸性粒细胞增多,在策划和放大哮喘的过敏性炎症中起着关键作用[3]。NF-κB 是IL-25 的下游信号通路,可以调控多种炎症因子如IL-4、IL-5、IL-13 的表达来达到调节炎症反应的作用[4]。益气温阳护卫汤是国医大师洪广祥根据哮喘发病内因“气阳虚弱,卫气不足” 理论创制的防治支气管哮喘的临床有效方。以往研究表明,益气温阳护卫汤可以降低炎症因子水平,控制气道炎症达到防治哮喘的目的[5-6],但其作用机制尚不明确。本研究旨在探究益气温阳护卫汤抑制哮喘大鼠气道炎症的作用机制是否与IL-25/NF-κB 信号通路相关。
1 材料
1.1 动物 6 周龄SPF 级雄性SD 大鼠60 只,体质量180~200 g,购自斯贝福(北京) 生物技术有限公司 [实验动物生产许可证号SCXK (京)2019-0010],于江西中医药大学标准动物房内饲养,温度20~24 ℃,相对湿度40% ~60%,通风良好,自由饮食饮水。本研究经江西中医药大学伦理委员会批准(伦理号JZLLSC20220786)。
1.2 药物 益气温阳护卫汤由黄芪200 g、白术150 g、防风150 g、白芍100 g、桂枝100 g、生姜100 g、大枣100 g、炙甘草50 g、仙茅100 g、仙灵脾150 g 组成,共取生药1 200 g,药材由江西中医药大学附属医院陈浩副主任鉴定为正品。白术、防风、桂枝、白芍、生姜提取挥发油,其余药材先加8 倍量冷水浸泡30 min,沸后再煎煮1 h; 第2 次加6 倍量水,煎煮40 min,去渣后过滤,合并滤液,浓缩,与挥发油混合成合剂,调至生药量2 g/mL,于4 ℃冰箱密封保存。醋酸地塞米松片(国药准字H35020394,规格0.75 mg/片,批号LB2198) 购自浙江仙琚制药股份有限公司。
1.3 试剂 卵清蛋白(OVA) (美国Sigma 公司,货号A5503); 氢氧化铝(国药集团化学试剂有限公司,批号20210528); 苏木素-伊红(HE) 染色试剂盒 (南昌雨露实验器材有限公司,批号220608); IL-4、IL-5、IL-13 ELISA 试剂盒(江苏酶免实业有限公司,批号 MM-0191R1、MM-0094R1、MM-0085R1); IL-25 抗体(美国SAB 公司,批号5312); TRAF6 抗体(武汉爱博泰克生物科技有限公司,批号A16991); DAB 显色试剂盒(武汉赛维尔生物科技有限公司,批号G1212-200T); IκBα 抗体、p-IκBα 抗体、NF-κB p65 抗体、p-NF-κB p65 抗体(美国Cell Signaling Technology 公司,批号4812S、2859S、8242S、3033S)。
1.4 仪器 PARI Turbo BOY 型超声雾化器(德国百瑞公司); KD-TS3A 全自动脱水机(浙江省金华市科迪仪器设备有限公司); DM2500 生物显微镜[徕卡显微系统(上海) 有限公司]; XT-2000i 全自动血液分析仪(日本希森美康公司); CFX 荧光定量PCR 仪、Chemi Doc XRS 凝胶成像仪(美国Bio-Rad 公司); M200PRO-多功能酶标仪(江西华科精密仪器有限公司)。
2 方法
2.1 分组、造模与给药 将60 只SD 大鼠适应性喂养7 d 后,随机分为对照组、模型组、地塞米松组和益气温阳护卫汤低、中、高剂量组,每组10只,参考文献[7] 报道建立哮喘模型。第1 天,对照组大鼠腹腔注射1 mL 生理盐水注射液,其余各组大鼠分别腹腔注射新鲜配制的卵清蛋白氢氧化铝混悬液1 mL (含卵清蛋白100 mg 及氢氧化铝100 mg) 致敏,并于第8 天重复第1 天的操作注射1 次。第15 天开始予以2% OVA 雾化吸入激发哮喘,每天雾化1 次,每次30 min,持续2 周。每天雾化OVA 前1 h,根据人和大鼠体表面积换算给药剂量,按照5 mL/kg 灌胃,对照组给予生理盐水,益气温阳护卫汤低、中、高剂量组分别给予1、2、4 g/mL 药液,地塞米松组给予0.2 mg/mL 药液,持续2 周。最后1 次雾化吸入后24 h 内,用20%乌拉坦(6 mL/kg) 腹腔注射麻醉。
2.2 肺泡灌洗液收集及炎症细胞分类计数 结扎左侧支气管,用1 mL 生理盐水进行支气管肺泡灌洗,重复3 次。将回收的支气管肺泡灌洗液(BALF) 使用全自动血液分析仪进行炎症细胞分类计数; 剩余BALF 于4 ℃、1 500 r/min 离心10 min,取上清液于-80 ℃保存,待进行ELISA 检测。
2.3 HE 染色观察肺组织病理变化 取大鼠右肺中叶置于4%多聚甲醛中浸泡固定。将固定好的肺组织流水冲洗过夜,全自动脱水机脱水,石蜡包埋,切片机切4 μm 厚的石蜡切片,60 ℃烤片2 h,行HE 染色,中性树胶封片,于光学显微镜下观察肺组织病理状态。
2.4 免疫组化法检测肺组织IL-25 蛋白表达 石蜡切片脱蜡至水,柠檬酸抗原修复缓冲液高温修复,3%双氧水溶液阻断内源性过氧化物酶,3%BSA 封闭,一抗4 ℃孵育过夜,孵育二抗,DAB显色,苏木素复染细胞核,脱水封片,于显微镜下观察,细胞核为蓝色,阳性表达为棕黄色,用Image J 软件分析阳性表达面积所占的比例。
2.5 ELISA 法检测BALF 中IL-4、IL-5 和IL-13 水平 按照ELISA 试剂盒说明书进行检测。根据标准物的浓度绘制标准曲线,计算样品的实际浓度。
2.6 RT-qPCR 法检测肺组织IL-25、TRAF6 mRNA表达 采用TRIzol 法提取肺组织总mRNA,根据逆转录试剂盒说明书,将提取的RNA 反转录成cDNA,再使用荧光定量PCR 仪进行扩增,以βactin为内参,采用2-ΔΔCT公式进行分析,引物由武汉赛维尔生物科技有限公司合成,序列见表1。

表1 引物序列Tab.1 Primer sequences
2.7 Western blot 法检测肺组织IL-25/NF-κB 信号通路相关蛋白表达 提取肺组织总蛋白,按照BCA 蛋白浓度测定法进行蛋白定量,95 ℃金属浴进行蛋白变性,SDS-PAGE 凝胶电泳,转膜,5%BSA 溶液封闭,加一抗于4 ℃冰箱孵育过夜,TBST 洗膜30 min,孵育二抗1 h,再次洗膜30 min,条带滴加显影液,放入化学凝胶成像仪显影,用Image J 软件分析和处理蛋白条带的灰度值。
2.8 统计学分析 通过SPSS 25.0 软件进行处理,计量资料以(±s) 表示,组间比较采用单因素方差分析,方差齐用LSD 检验,以α=0.05 为检验水准。P<0.05 为差异有统计学意义。
3 结果
3.1 大鼠一般状态及行为学观察 除对照组外,模型组和给药组大鼠在致敏第8 天后均出现轻微的咳嗽。第15 天雾化吸入OVA 后不久大鼠出现四肢挠鼻抓耳,咳嗽喘息,四处窜动,过一会就静卧不动。大鼠雾化后,毛发逐渐粗糙,失去光泽,食欲不振,食量变小,喜卧,精神不佳等现象。对照组大鼠无异常表现。给药组经地塞米松和益气温阳护卫汤干预后,大鼠一般状态及行为改变较模型组均有不同程度的改善。
3.2 益气温阳护卫汤对支气管哮喘大鼠BALF 中炎症细胞的影响 与对照组比较,模型组中的白细胞(WBC)、嗜酸性粒细胞(EOS)、嗜碱性粒细胞(BAS)、中性粒细胞 (NEU)、淋巴细胞(LYM) 及单核细胞 (MON) 数量升高 (P<0.01); 与模型组比较,地塞米松组和益气温阳护卫汤各剂量组上述炎症细胞数量均减少(P<0.05,P<0.01),见表2。
表2 各组大鼠BALF 中炎症细胞数量比较(×109/mL,±s,n=9)Tab.2 Comparison of inflammatory cells in BALF of rats in each group (×109/mL,±s,n=9)
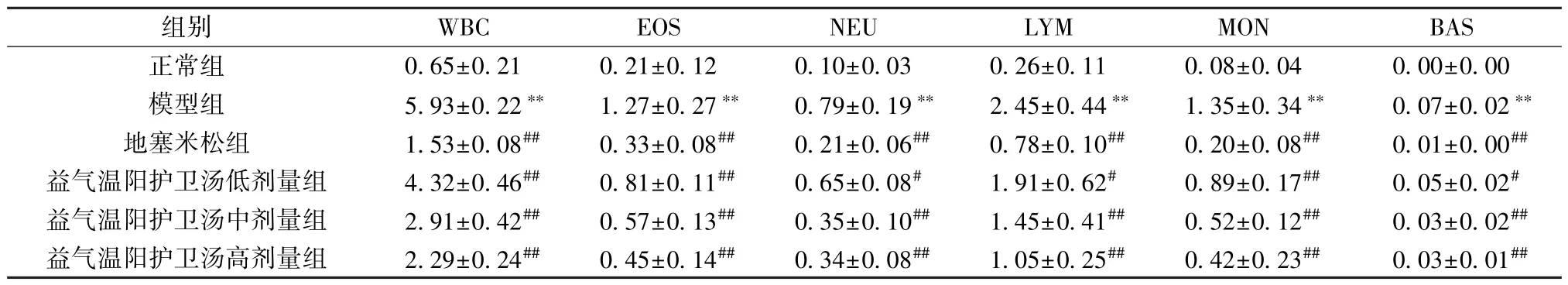
表2 各组大鼠BALF 中炎症细胞数量比较(×109/mL,±s,n=9)Tab.2 Comparison of inflammatory cells in BALF of rats in each group (×109/mL,±s,n=9)
注: 与对照组比较,∗∗P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别WBCEOSNEULYMMONBAS正常组0.65±0.210.21±0.120.10±0.030.26±0.110.08±0.040.00±0.00模型组5.93±0.22∗∗1.27±0.27∗∗0.79±0.19∗∗2.45±0.44∗∗1.35±0.34∗∗0.07±0.02∗∗地塞米松组1.53±0.08##0.33±0.08##0.21±0.06##0.78±0.10##0.20±0.08##0.01±0.00##益气温阳护卫汤低剂量组4.32±0.46##0.81±0.11##0.65±0.08#1.91±0.62#0.89±0.17##0.05±0.02#益气温阳护卫汤中剂量组2.91±0.42##0.57±0.13##0.35±0.10##1.45±0.41##0.52±0.12##0.03±0.02##益气温阳护卫汤高剂量组2.29±0.24##0.45±0.14##0.34±0.08##1.05±0.25##0.42±0.23##0.03±0.01##
3.3 益气温阳护卫汤对支气管哮喘大鼠肺组织病理形态学的影响 与对照组比较,模型组肺组织支气管管壁增厚,管腔狭窄变形,平滑肌增生,杯状细胞化生,黏性分泌物增多,大量炎性细胞浸润;与模型组比较,益气温阳护卫汤各剂量组及地塞米松组肺组织炎症浸润情况得到不同程度改善,见图1。

图1 各组大鼠肺组织病理形态(HE,×200)Fig.1 Pathological morphology of rat lung tissue in each group (HE,×200)
3.4 益气温阳护卫汤对支气管哮喘大鼠肺组织IL-25 蛋白表达的影响 与对照组比较,模型组大鼠肺组织切片显示棕色细胞增多,IL-25 蛋白表达升高(P<0.01); 与模型组比较,地塞米松组和益气温阳护卫汤各剂量组肺组织IL-25 蛋白表达降低(P<0.01),见图2。
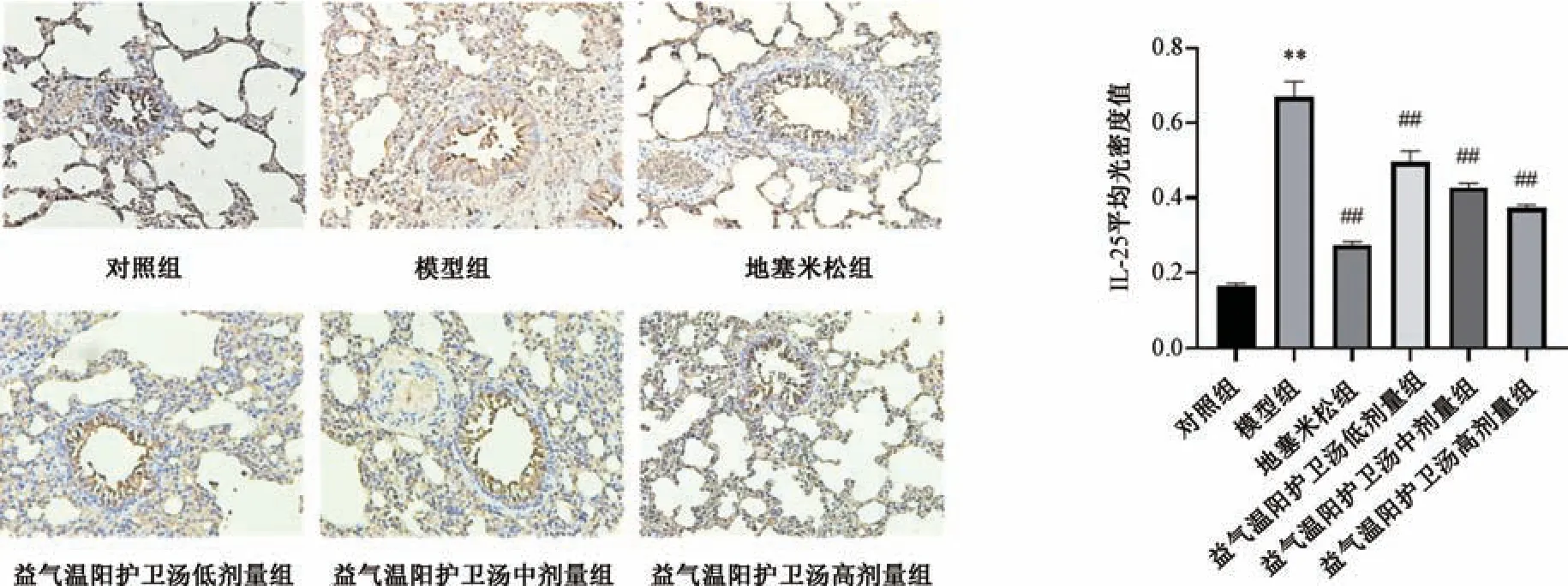
图2 各组大鼠肺组织IL-25 蛋白表达(IHC,±s,×200,n=3)Fig.2 Expression of IL-25 protein in rat lung tissue of each group (IHC,±s,×200,n=3)
3.5 益气温阳护卫汤对支气管哮喘大鼠BALF 中IL-4、IL-5、IL-13 水平的影响 与对照组比较,模型组大鼠BALF 中IL-4、IL-5、IL-13 水平升高(P<0.01); 与模型组比较,地塞米松组和益气温阳护卫汤各剂量组大鼠BALF 中IL-4、IL-5、IL-13水平降低(P<0.01),见表3。
表3 各组大鼠BALF 中IL-4、IL-5、IL-13 水平比较(ng/L,±s,n=9)Tab.3 Comparison of IL-4,IL-5 and IL-13 levels in rat BALF of each group (ng/L,±s,n=9)
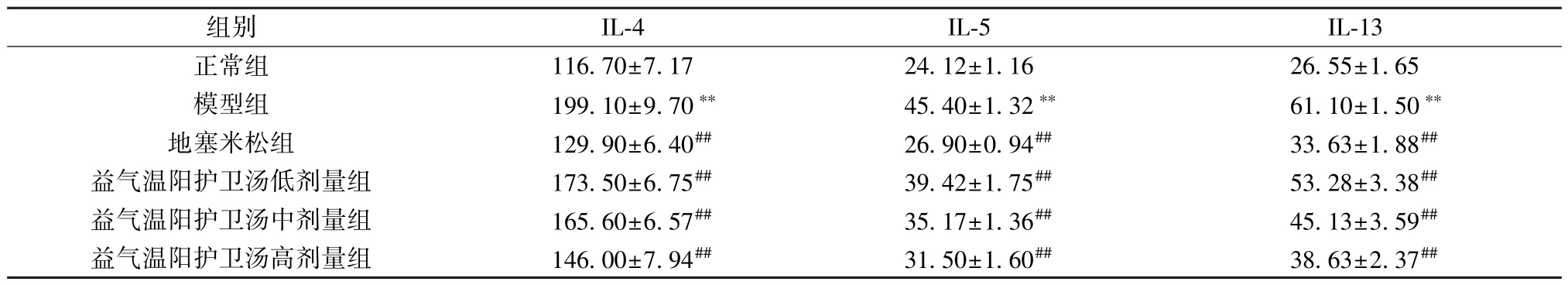
表3 各组大鼠BALF 中IL-4、IL-5、IL-13 水平比较(ng/L,±s,n=9)Tab.3 Comparison of IL-4,IL-5 and IL-13 levels in rat BALF of each group (ng/L,±s,n=9)
注: 与对照组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别IL-4IL-5IL-13正常组116.70±7.1724.12±1.1626.55±1.65模型组199.10±9.70∗∗45.40±1.32∗∗61.10±1.50∗∗地塞米松组129.90±6.40##26.90±0.94##33.63±1.88##益气温阳护卫汤低剂量组173.50±6.75##39.42±1.75##53.28±3.38##益气温阳护卫汤中剂量组165.60±6.57##35.17±1.36##45.13±3.59##益气温阳护卫汤高剂量组146.00±7.94##31.50±1.60##38.63±2.37##
3.6 益气温阳护卫汤对支气管哮喘大鼠肺组织IL-25、TRAF6 mRNA 表达的影响 与对照组比较,模型组大鼠肺组织IL-25、TRAF6 mRNA 表达升高(P<0.01); 与模型组比较,地塞米松组和益气温阳护卫汤各剂量组大鼠肺组织IL-25、TRAF6 mRNA 表达降低(P<0.01),见表4。
表4 各组大鼠肺组织IL-25、TRAF6 mRNA 表达比较(±s,n=3)Tab.4 Comparison of IL-25 and TRAF6 mRNA expressions in rat lung tissue of each group (±s,n=3)
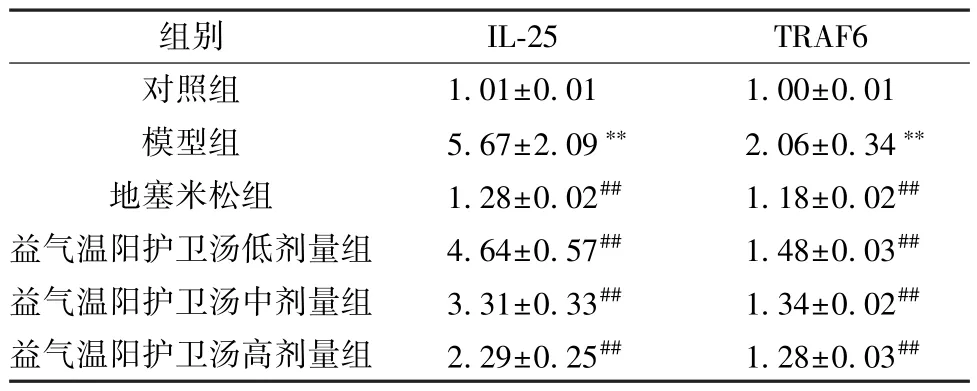
表4 各组大鼠肺组织IL-25、TRAF6 mRNA 表达比较(±s,n=3)Tab.4 Comparison of IL-25 and TRAF6 mRNA expressions in rat lung tissue of each group (±s,n=3)
注: 与对照组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别IL-25TRAF6对照组1.01±0.011.00±0.01模型组5.67±2.09∗∗2.06±0.34∗∗地塞米松组1.28±0.02##1.18±0.02##益气温阳护卫汤低剂量组4.64±0.57##1.48±0.03##益气温阳护卫汤中剂量组3.31±0.33##1.34±0.02##益气温阳护卫汤高剂量组2.29±0.25##1.28±0.03##
3.7 益气温阳护卫汤对支气管哮喘大鼠肺组织IL-25/NF-κB 信号通路相关蛋白表达的影响 与对照组比较,模型组大鼠肺组织IL-25、TRAF6、p-IκBα/IκBα、p-NF-κB p65/NF-κB p65 蛋白表达升高(P<0.01); 与模型组比较,地塞米松组和益气温阳护卫汤各剂量组大鼠肺组织IL-25、TRAF6、p-IκBα/IκBα、p-NF-κB p65/NF-κB p65 蛋白表达均降低(P<0.01),见图3、表5。

图3 各组大鼠肺组织IL-25/NF-κB 信号通路相关蛋白条带图Fig.3 Protein bands of IL-25/NF-κB signaling pathway in rat lung tissue of each group
表5 各组大鼠肺组织IL-25/NF-κB 信号通路相关蛋白表达比较(±s,n=3)Tab.5 Comparison of expressions of IL-25/NF-κB signaling pathway related proteins in rat lung tissue of each group (±s,n=3)

表5 各组大鼠肺组织IL-25/NF-κB 信号通路相关蛋白表达比较(±s,n=3)Tab.5 Comparison of expressions of IL-25/NF-κB signaling pathway related proteins in rat lung tissue of each group (±s,n=3)
注: 与对照组比较,∗∗P<0.01; 与模型组比较,##P<0.01。
组别IL-25TRAF6p-IκBα/IκBαp-NF-κB p65/NF-κB p65对照组0.36±0.050.52±0.010.32±0.030.36±0.01模型组0.78±0.03∗∗0.82±0.02∗∗0.82±0.82∗∗0.72±0.09∗∗益气温阳护卫汤低剂量组0.58±0.10##0.73±0.01##0.63±0.14##0.56±0.03##益气温阳护卫汤中剂量组0.48±0.05##0.68±0.04##0.46±0.02##0.50±0.02##益气温阳护卫汤高剂量组0.43±0.07##0.67±0.01##0.44±0.03##0.47±0.01##地塞米松组0.36±0.03##0.62±0.02##0.39±0.03##0.43±0.02##
4 讨论
支气管哮喘中医学称“哮病”,国医大师洪广祥指出“气阳虚弱是哮喘发作的重要内因”。气阳虚弱重在肺、脾、肾三脏,肺失宣降,脾失运化,肾失蒸化水液,形成痰瘀互结,内伏于肺,导致哮喘发病。洪广祥根据众多古代医籍记载和长期临床经验提出“益气温阳护卫法” 防治哮喘的观点,并拟定了益气温阳护卫汤,该方通过温补肺脾肾三脏阳气,使肺的宣发肃降功能、脾之运化水湿功能、肾之蒸化水液功能得以正常,使痰消瘀散,气道炎症减轻,气道反应性降低,以减少或控制哮喘的反复发作,从而达到防治哮喘的目的[8]。
支气管哮喘是一种常见的慢性气道炎症性疾病,可导致咳嗽、喘息、呼吸急促和胸闷等症状[9]。哮喘症状是主要由气道炎症引起的,炎症细胞浸润,支气管黏膜充血水肿,黏液分泌增多,导致气道重塑和气道高反应性[10]。大量研究表明,细胞因子在支气管哮喘发病机制中产生重要的作用[11]。当受到过敏原刺激时,抗原被树突状细胞捕获后,诱导Th0 细胞向Th2 细胞分化并激活产生炎症因子,如IL-4、IL-5 和IL-13[12]。IL-4 和IL-13可以诱导B 细胞合成IgE,导致肥大细胞和嗜碱性粒细胞致敏,从而释放促炎介质,刺激黏液高分泌和气道高反应性,而IL-5 主要负责嗜酸性粒细胞的成熟和募集[13]。本研究发现,益气温阳护卫汤可以改善大鼠哮喘症状; 降低哮喘大鼠BALF 中炎症细胞数量及IL-4、IL-5 和IL-13 水平; 改善肺组织支气管结构及炎症细胞浸润情况,减少黏液分泌和上皮杯状细胞化生,抑制气道炎症反应。
IL-25 也称为IL-17E,是IL-17 细胞因子家族的独特成员,可以局部或全身地促进和增强辅助性T 型2 (Th2) 反应[14]。研究表明,IL-25 及其同源受体IL-17RB/RA 的表达在哮喘病症中显著上调[15]。研究还发现IL-25 可以诱导典型的嗜酸性粒细胞炎症、气道高反应性和气道重塑,表现为杯状细胞增生,上皮下胶原沉积和血管生成[16]。IL-25在与IL-17RB/IL-17RA 复合物结合后,ACT1 被招募到IL-17RB 的SEFIR 结构域上,ACT1 再招募TRAF6 至受体IL-17RB 上激活下游NF-κB 信号通路[17]。NF-κB 通路是参与生理过程和疾病发生的重要细胞信号通路之一,它在控制免疫功能、炎症、应激反应、分化、凋亡和细胞存活方面起重要作用[18]。在细胞未受到刺激时,NF-κB 与抑制性IκBα 蛋白结合,以非活性状态存在于细胞质中[19],当机体受到过敏原刺激时,IκBα 会迅速磷酸化并被降解,与NF-κB 解离,然后NF-κB 转位进入核内并激活靶基因,诱导Th2 细胞应答分泌促炎细胞因子如IL-4、IL-5、IL-13,从而参与调控炎症反应[20]。本实验结果显示,益气温阳护卫汤能够下调肺组织IL-25、TRAF6 mRNA 和蛋白表达,抑制IκBα、NF-κB p65 磷酸化,说明益气温阳护卫汤能够有效抑制IL-25/NF-κB 信号通路活化,抑制炎症反应。
综上所述,益气温阳护卫汤可有效缓解哮喘大鼠的哮喘症状,抑制气道炎症,其作用与抑制IL-25/NF-κB 信号通路活化,减少炎症因子表达有关。
