慢性高氧对小鼠肺功能的影响研究
2024-03-12唐俊李可欣张凤梅
唐俊,李可欣,张凤梅
(1.重庆医科大学附属第一医院,重庆 400016;2.重庆医科大学附属大学城医院,重庆 400030;3.重庆医科大学实验动物中心,重庆 400016)
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是一种复杂的过程,一些产前和/或产后因素会干扰下呼吸道发育,导致严重的终身疾病。Northway[1]等于1967年首次使用术语“支气管肺发育不良”来描述需要机械通气的早产儿中由气压伤和氧损伤引起的慢性肺部损伤。BPD的病理特征表现为隔膜减少和肺泡发育不全,导致大肺泡简化,气体交换面积减少。肺血管平滑肌增生,肺泡毛细血管异常,间质纤维增生和肺泡隔膜增多,病死率和再入院率较高[2]。氧疗是通过消除缺氧因素后来治疗缺氧的治疗措施,是导致BPD的高危因素之一[3]。高浓度氧容易在体内形成损害肺部的高活性氧自由基,对患儿的远期发育具有一定影响[4,5]。BPD引起的慢性呼吸道疾病是早产最常见的长期并发症。近年来对BPD发病机制的了解有所增加,但BPD导致肺损伤的机制尚未完全阐明。目前的治疗方法主要有控制感染肺、保护性通气、氧疗,给以NO等,但常用的治疗措施效果较为有限,暂无特效药物及其他治疗方法[6]。
BPD可导致严重的肺损伤[7,8],可持续性造成肺功能减弱。虽然肺损伤是BPD的标志性特征,但文献报道的多种高氧诱导BPD动物模型均无法对肺功能进行充分评估。目前大多研究是通过HE染色和定量组织学肺损伤评分评估肺功能,但这些方法均无法有效地评价肺功能。因此,本研究旨在探讨慢性高氧对小鼠气道阻力及肺功能的影响,为研究BPD肺功能提供参考。
一、材料与方法
(一)实验动物
经重庆医科大学实验动物中心采购,实验动物生产许可证编号为SCX K(渝)2022-0 010的SPF级C57BL/6J新生小鼠。该实验在重庆医科大学实验动物中心进行,实验动物使用许可证号为SYXK(渝)2022-0016。
(二)仪器设备
无创动物肺功能检测仪(FinePointe™NAM)、100%医用氧气(重庆朝阳气体有限公司)、数字测氧仪(CY-100,杭州立华仪器有限公司)。
(三)模型制备
随机将20只出生24h内的SPF级的C57BL/6J小鼠分为对照组和高氧组,每组10只。在自制的密闭氧箱中(40cm×30cm×25cm)放置高氧组小鼠,持续缓慢输入100%的氧气,使 FIO2保持在85%左右,并将空气组放置在同一室内[9]。每天将高氧组与对照组的母鼠进行更换,避免氧浓度过高导致中毒,降低其喂养能力。每日开箱1h,完成称重、加水、加料及换垫料等工作。高氧干预21天后进行肺功能检测,使用4%多聚甲醛固定各组小鼠左肺,右肺于-80℃进行冻存。
(四)小鼠基础肺功能测定
使用FinePointe™ NAM动物肺功能仪器对各组小鼠进行基础肺功能检测。日龄为21d时,每组随机取5只小鼠。将处于清醒、活动自如状态的小鼠类放入全身体积描计箱,待其稳定后,持续监测肺功能指标变化10min并计算平均值[10]。
(五)肺组织形态学分析
将左肺固定于4%多聚甲醛24h后,经脱水透明和石蜡包埋,切片为4~5μm,经脱蜡水化后,制成HE染色切片,在光镜下观察组织病理和形态的变化。
1.放射状肺泡计数(Radical alveolar counts,RAC)
每组随机抽取3~5个样本,每个样本随机选取一个切面,每个切面随机选取5个不重叠视域(×200),以每个视域下肺泡的平均数为肺泡计数[11]。
2.平均肺泡截距(Mean linear intercept,MLI)
在显微镜视域(×200)中央画十字交叉线,对所有与交叉线相交的肺泡间隔数(NS)进行计算,进行十字线总长(L)的测算;对每个视域的平均内衬间隔计算(MLI=L/NS),取其平均数,表示肺泡平均内径[12]。
(六)统计学分析
资料分析采用SPSS 21.0软件,两组资料均经过t检验,P<0.05表示差异具有统计学意义。
二、结果
(一)不同组21日龄小鼠的体重及死亡率的比较
对照组的小鼠状态正常,体重随日龄上升。21天时空气组、高氧小鼠体重分别为(7.84±0.24)g,(5.21±0.61)g。空气组、高氧组21日龄小鼠的存活率分别为100%、70 %,如图1所示。

图1 慢性高氧影响新生鼠体重及生存率
(二)慢性高氧导致小鼠肺组织发育受损
与对照组相比,高氧组小鼠肺泡间隔变厚、破裂,肺泡数量减少,且肺泡腔变大(图2)。高氧组MLI明显升高,RAC值明显下降,这表明高氧组小鼠肺组织功能不全,发育受阻。
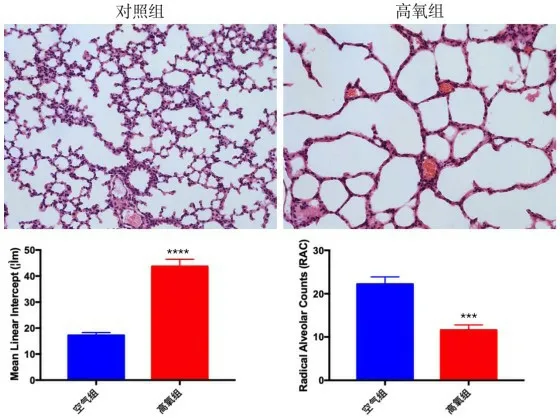
图2 小鼠肺组织病理形态改变(HE,200 ×)

图3 各组小鼠肺功能比较
(三)小鼠的肺功能变化
与对照组相比,高氧组的呼吸频率(Frequency of breathing,F),潮气量(Tidal volume,TV),肺通气量(Minute volume,MV),呼气峰流速(Peak expiratory flow,PEF),吸气峰流速(Peak inspiratory flow,PIF)、50%呼气流量(The Expiratory Flow at 50% Expired Volume,EF50)值均降低。特异性气道阻力(Specific airway resistance,SRAW)明显增加,表明慢性高氧导致小鼠的肺功能受损。
(四)慢性高氧对远期肺发育的影响
为了进一步探讨慢性高氧对小鼠远期发育的影响。将高氧组小鼠置于85%O2处理21天后,将小鼠置于正常室内空气中喂养(21%O2)至小鼠8周龄,检测其肺形态学及肺功能的变化。与对照组相比,高氧组小鼠肺泡腔扩大,肺泡数量减少,肺发育紊乱(图4)。

图4 慢性高氧对远期小鼠肺发育的影响
(五)慢性高氧对远期肺功能的影响
与对照组相比,高氧组的呼吸频率、肺通气量值显著降低,而特异性气道阻力显著增加,表明慢性高氧导致小鼠远期肺功能受损(图5)。

图5 慢性高氧对远期小鼠肺功能的影响
三、讨论
肺发育可以概括为五个阶段:胚胎期、假腺期、小管期、囊泡期和肺泡期,这一发育过程从宫内生命早期开始,并在出生后的第一年继续进行。越来越多的证据表明,早期暴露于氧化应激会导致肺部发育过程改变,使肺部更容易患上许多早产儿的典型疾病,例如呼吸窘迫综合征、支气管肺发育不良和持续性肺动脉高压等。正常的肺泡发育是由体积大、数量少的囊泡向体积小、数量多的肺泡转化的过程,但在肺泡发育的囊泡形成期将新生动物暴露于高氧下,使肺泡正常发育过程受阻,肺泡腔扩大、数量减少,肺泡正常结构消失,肺泡隔膜增厚,肺组织纤维化,即囊泡期向肺泡发育期的转化受到阻滞。这一过程可以模拟人类新生儿BPD的病理特征[13-15]。
肺功能是呼吸系统疾病必不可少的检查之一,在疾病诊断、病情发展、预后评估等方面都有广泛的应用,在临床上意义重大[16]。F、MV、TV、PEF、PIF等是临床常用反映肺功能的重要指标。本研究通过使用85%高氧诱导21d成功建立新生儿支气管肺发育不良的动物模型,与正常组小鼠相比,高氧组小鼠发育缓慢,21d体重较轻,死亡率升高。通过HE染色研究两组小鼠肺组织病理形态的变化,发现与对照组相比,高氧组小鼠肺泡腔扩大,肺泡数量减少,肺发育紊乱。通过肺功能仪对各组小鼠进行基础肺功能检测,结果显示,高氧组肺组织结构紊乱,特殊气道阻力增加,F、MV、TV、Frc、PIF、PEF、EF50值均显著下降,提示高氧可致小鼠肺损伤。接下来,本研究对慢性高氧对远期肺发育及肺功能的影响进行了探索,将高氧组小鼠置于85% 高氧处理21d后,将小鼠 置于正常室内空气中喂养至8周龄,结果发现与对照组相比,高氧组小鼠在正常环境成长至8周龄时,肺发育仍然相对缓慢,且肺功能受损情况仍未改善,这表明高氧对小鼠发育期及远期肺功能均有较大损害。近期有文献研究发现,在婴儿期被诊断患有支气管肺发育不良的儿童患有呼吸系统疾病风险较正常儿童更高,发育中的肺暴露于高氧会导致活性氧的产生,从而导致细胞损伤和细胞凋亡、炎症增加和肺水肿,这些不良因素可能导致青少年乃至成人时期呼吸系统疾病风险增加和肺功能下降[17]。
综上所述,慢性高氧可诱导新生鼠肺发育不良、损害肺功能,并对远期肺发育产生持续影响。本研究为研究BPD机制及治疗方法提供了理想的动物模型,奠定了可靠的实验依据和重要的理论基础。
