抗髓过氧化物酶抗体-抗中性粒细胞胞浆抗体相关肥厚性硬脊膜炎1例
2024-03-11李婛杨仕林占茂芳韩翔陈淑芬
李婛,杨仕林,占茂芳,韩翔,陈淑芬
肥厚性硬脑膜脊膜炎(HP)可分为肥厚性硬脑膜炎(HCP)和肥厚性硬脊膜炎(HSP)。相较于HCP,HSP的发病率更低。本文报道1例抗髓过氧化物酶(MPO)抗体-抗中性粒细胞胞浆抗体(ANCA)相关HSP患者如下。
1 病例患者,女性,75岁,因“双下肢麻木无力5个月,行走不能2个月”于2021年3月10日入住复旦大学附属华山医院神经内科。患者于2020年10月开始无明显诱因出现双下肢无力,走路有踩棉花感。患者2021年1月开始上述症状加重,出现行走不稳、发飘、需人搀扶行走。病程中有便秘,无明显小便障碍。病程中否认发热、腰背部疼痛、明显体重下降,否认皮疹及关节肿痛病史。既往有高血压病史20余年,血压最高160/90 mmHg(1 mmHg=0.133 kPa),平日服用氨氯地平片5 mg/d,血压控制好。否认既往肝炎、结核病等传染病史,否认手术外伤史,否认疫地、疫水接触史,否认类似家族遗传病史。否认特殊食物药物过敏史。入院体格检查:双上肢肌力、肌张力正常,双下肢近端肌力Ⅲ-级,远端肌力Ⅳ-级,肌张力正常。指鼻试验稳准,跟-膝-胫试验无法完成,胸腰部束带感,T10以下深浅感觉障碍,双侧Babinski征及Chaddock征(+)。闭目难立征及直线行走不能配合。实验室检查:血常规、肝肾功能、血脂、电解质、弥散性血管内凝血(DIC)、肿瘤标志物正常。HIV、类脂质抗体试验(RPR)、梅毒螺旋体抗体试验(TPPA)、肝炎标志物、结核感染T细胞检测(T-SPOT)均阴性。外周血抗核抗体1∶1000,抗MPO抗体162.9 RU/mL,,抗中性粒细胞胞浆抗体(pANCA)阳性,血沉84 mm/h,高敏C反应蛋白9.59 mg/L,抗ds-DNA阴性,IgG4(-),IgA 4.16 g/L,IgG 19.2 g/L,余免疫指标未见异常。腰穿CSF检查:压力190 mmH2O(1 mmH2O=0.0098 kPa),白细胞96×106/L,红细胞10×106/L,单核细胞90%,潘氏试验();糖1.7 mmol/L,氯120 mmol/L,蛋白>15000 mg/L。同步血糖6.4 mmol/L。CSF细菌、真菌及结核涂片及培养均阴性。CSF gene-Xpert阴性,乳胶凝集试验阴性。CSF病原学二代测序阴性。脊髓MRI:T5~12脊膜结节样增厚,T1低信号,T2低信号,增强后T1Flair相病灶有明显强化,脊髓受压(图1)。头颅MRI未见明显硬脑膜强化。硬脊膜活检(图2):HE染色示镜下见硬膜组织,大量淋巴细胞、浆细胞及组织细胞弥漫浸润,血管周围炎症细胞浸润,血管玻璃样变性;免疫组化染色示CD20(部分+),CD3(部分+),Ki67(生发中心30%),CD138(-),CD68(部分+),IgG4(-),PAX-5(部分+),S-100(-),CD1a(-);碘酸雪夫染色(-),聚丙烯酰胺凝胶中蛋白质(-)。结合HE染色及免疫组化结果,考虑炎性病变。
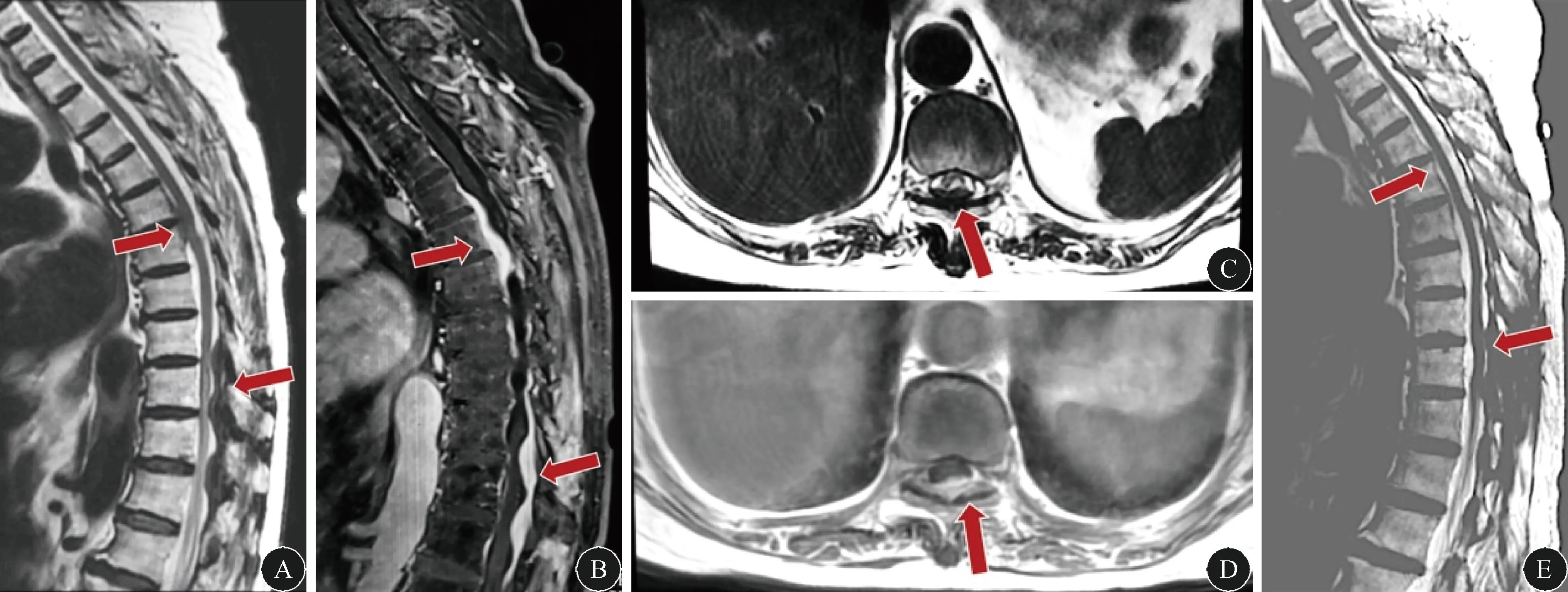
图1 脊髓MRI平扫及增强检查A:脊髓MRI平扫矢状位T2序列T5-12水平硬脊膜结节样增厚,为低信号病灶;B:脊髓MRI增强矢状位T1序列T5-12水平硬脊膜有明显强化;C:脊髓MRI平扫T2水平位可见硬脊膜增厚,伴有脊髓受压,为低信号病灶;D:脊髓MRI增强T1水平位可见增厚的硬脊膜有明显强化;E:治疗后3个月复查脊髓MRI,T2序列矢状位可见硬脊膜增厚情况较前相比明显缓解。
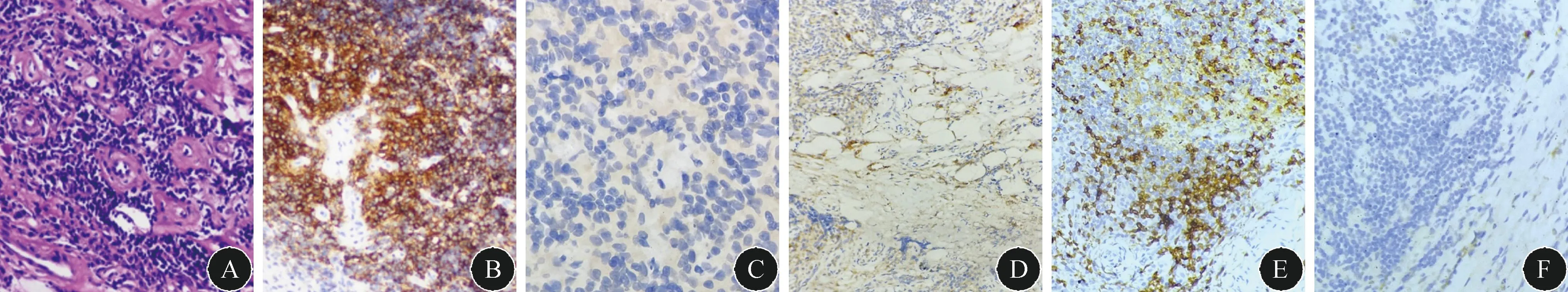
图2 硬脊膜活检病理检查A:镜下可见硬膜组织,纤维组织增生,血管壁玻璃样变性,血管周围大量炎症细胞、浆细胞及组织细胞浸润(HE染色,200×);B:CD20染色阳性(免疫组化染色,200×);C:IgG4染色阴性(免疫组化染色,400×);D:CD68阳性(免疫组化染色,200×);E:CD3染色阳性(免疫组化染色,200×);F:S100染色阴性(免疫组化染色,200×)。
定位诊断:患者双下肢肌力下降,双侧病理征阳性,定位于双侧锥体束受累;存在双下肢深浅感觉障碍,定位于脊髓丘脑束及后索受累;存在便秘,小便功能不受累,考虑髓外病变可能大。综上所述,考虑为不全横贯性脊髓病变,髓外来源可能。患者T10以下针刺觉减退,故纵向定位于T7水平。定性诊断:患者为老年女性,隐匿起病,逐步进展的脊髓病变,脊髓MRI提示多节段硬脊膜增厚伴相应节段脊髓受压,增强后有明显强化,符合HSP影像学改变。腰穿CSF检查示白细胞轻度增高,以单个核细胞升高为主,蛋白超过检测上限,糖略低,考虑可能与蛛网膜下腔受压梗阻有关。CSF细菌、真菌及结核培养均阴性,病原学二代测序阴性,排除感染相关HCP可能。病灶组织活检未见明显肿瘤依据,故排除肿瘤相关HCP。患者外周血MPO较正常人升高8倍,pANCA阳性,血沉升高,组织病理学检查示大量炎症细胞浸润,因此考虑为MPO-ANCA相关HSP。
明确诊断后给予皮质类固醇激素治疗,患者双下肢麻木无力症状有明显缓解,双下肢肌力恢复至近端V-级,远端V级,已能独立行走。复查脊髓MRI增强硬脊膜增厚情况较前有明显缓解(图1E)。患者出院1年,仅用皮质类固醇激素治疗,双下肢麻木消失,四肢肌力、肌张力正常,病理征未引出。
2 讨论HSP是一种罕见的疾病,可引起灾难性的神经损伤。本病病因多样,主要包括免疫相关、感染相关、肿瘤相关及特发性HSP,好发于40~60岁人群(57%),女性多见(71%),发病率低[1]。MPO-ANCA相关HSP目前报道较少。Yokoseki等[2]提出,ANCA相关的HSP可能是ANCA相关系统性血管炎仅局限于神经系统的一种疾病状态。虽然其发病机制尚不完全清楚,但越来越多的证据[3]表明,HSP可能与异常自身免疫等有关。
HSP常见症状包括瘫痪(71%)、肢体麻木(64%)、膀胱和直肠功能障碍(43%),少数以背痛(29%)为首发症状[1]。本例以双下肢麻木无力为首发症状。脊髓血管或脊髓神经的直接受压是导致症状出现的主要原因。本病最常见的受累部位为颈髓和胸髓,全脊髓受累相对少见。椎管腹侧硬脊膜比背侧更敏感,更易累及。本例病变在胸髓,不同节段均有受累,不仅累及腹侧,也有累及背侧。
MRI是目前HSP最有效且直观的影像学检查方法,弥漫性硬脊膜增厚和脊髓受压,且背侧硬脊膜较明显,硬膜外显示出脂肪信号是HSP的影像学特点。HSP病变硬膜组织在MRI平扫上可表现为T1等或低信号,T2低信号,增强后可见明显强化,多呈条索状,背侧硬脊膜较腹侧增厚明显[1]。本例影像学表现符合上述描述。
活检是HSP的诊断金标准。既往研究[4]认为,ANCA相关HP的病理学改变主要包括肉芽肿性病变、血管炎、组织坏死及炎症细胞浸润(T淋巴细胞、B淋巴细胞、浆细胞等)。40%的患者可仅表现为大量炎症细胞浸润[5]。本例脊髓硬膜组织活检未见肉芽肿性病变及血管炎,仅有大量炎症细胞浸润,符合ANCA相关HSP的病理改变。因此,一旦影像学检查提示HSP,应积极查找病因,必要时可通过活检明确诊断。
本例患者外周血MPO 8倍升高,pANCA阳性,且有明显血沉增高,故考虑为MPO-ANCA相关HSP。活检排除了如淋巴瘤及脊索瘤等肿瘤性病变。CSF常规虽提示白细胞增多,糖下降,但CSF培养未见细菌、真菌或结核等,CSF病原学二代测序亦未发现病原体DNA,结合患者存在髓外压迫、脊髓梗阻情况,CSF糖水平降低及蛋白水平升高可能与CSF循环受阻相关,加之使用皮质类固醇激素后临床症状及影像学检查均有明显好转,可排除感染性病变相关HSP。患者活检病理IgG4染色及S100染色均阴性,可排除IgG4相关HSP及Rossai-Dorfman病。综上所述,该患者MPO-ANCA相关HSP诊断可能性最大。
MPO-ANCA相关HSP对皮质类固醇激素及免疫抑制治疗敏感,多数患者通过免疫治疗症状可快速缓解。皮质类固醇激素疗程尚未统一,部分患者在治疗期间可出现病情恶化。目前认为,皮质类固醇激素单药治疗有复发倾向,因此在皮质类固醇激素减量过程中可加用免疫抑制剂[6]。本例患者使用皮质类固醇激素后症状明显好转。多数接受减压手术患者的神经功能缺损显著改善。复发率高是HSP长期预后中的主要问题。Dumont等[7]研究认为,术前出现发热、红细胞沉降率增快、白细胞增多、C反应蛋白水平升高等有硬膜炎征象的患者预后较差,复发率高于无炎症征象的患者。
综上所述,在临床诊疗过程中应注意识别HSP典型的MRI影像,诊断为HSP的患者应进行ANCA检测或其他自身免疫性疾病的筛查。一旦怀疑HSP,应积极排查潜在的病因,早期诊断,早期治疗。手术减压与术后类固醇治疗可能是最好的治疗选择。
作者贡献说明李婛提出选题,设计、采集、分析、解释数据,撰写、修改文章;杨仕林采集、统计分析数据,指导文章修改;占茂芳采集数据、分析数据;陈淑芬指导选题、设计研究,指导起草、修改文章;韩翔指导文章修改,提供技术材料
