血清IL-11水平在急性脑梗死患者诊断和预后中的评估价值及其与血清脑源性神经营养因子的相关性
2024-03-11赵晶钱进军
赵晶,钱进军
脑梗死是一种以高发病率、高残疾率和高死亡率为特征的急性缺血性脑血管病,是导致死亡的第二大原因[1-2]。大量研究[3-4]揭示,炎症和免疫是影响脑梗死进展和预后的关键因素。IL-11是IL家族成员中的一员[5],Zhang等[6]通过卒中小鼠模型首次证实了脑组织中IL-11在缺血条件下表达降低,且IL-11治疗后卒中小鼠神经系统评分和梗死体积均得到改善,高度提示IL-11在脑梗死中发挥神经保护作用。然而,IL-11在脑梗死患者血清中的表达及其与脑梗死预后的关联目前尚无报道。因此,本文以脑梗死患者为研究对象,观察并分析了IL-11在脑梗死患者血清中的表达,以期寻找一种可靠的辅助脑梗死诊断和预后评估的血清学指标。另外,脑源性神经营养因子(BDNF)是脑梗死后维持梗死区域神经元细胞存活的重要神经营养因子,对脑梗死预后结局具有重要影响[7],本文还分析了脑梗死患者血清IL-11水平与及BDNF的关系,为探索IL-11的作用机制奠定临床基础。
1 对象与方法
1.1 对象 (1)脑梗死组:收集2019年2月至2021年9月江苏大学附属第四人民医院神经内科住院的首发急性脑梗死患者102例,均符合《中国急性缺血性脑卒中诊治指南2018》[8]中脑梗死的诊断标准,年龄>18岁,病程≤24 h,未进行静脉溶栓或取栓治疗。男58例,女44例;年龄50~80岁,平均(64.19±7.33)岁;病程(12.85±7.14)h。(2)正常对照组:收集年龄、性别匹配的健康体检人群64名,男37名,女27名;年龄53~78岁,平均(65.77±6.14)岁。排除标准:(1)既往有急性脑梗死病史;(2)合并其他疾病导致的肢体功能障碍,并影响日常生活;(3)进行静脉溶栓或取栓治疗;(4)合并恶性肿瘤;(5)合并脑外伤;(6)入院前有抗凝、抗血栓、激素类、免疫抑制剂等治疗史;(7)合并严重心、肝、肾功能不全。本研究通过江苏大学附属第四人民医院医学伦理委员会审核批准(201921),所有受试者知情同意,均签署纸质版知情同意书。
1.2 方法
1.2.1 一般资料的收集 入院后收集受试者的年龄、性别、病程、吸烟史、饮酒史、高血压、糖尿病、心房颤动(房颤)、冠心病情况。吸烟史定义为每天吸烟≥1支,且持续吸烟时间不少于1年。饮酒史定义为饮酒量≥50 g/周,且持续饮酒时间不少于1年。
1.2.2 血液指标的检测 所有受试者抽取清晨空腹血5 mL,对其常规处理分离血清。采用自动生化检测仪检测糖化血红蛋白(HbA1c)、空腹血糖、肌酐、尿素氮、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和总胆固醇(TC)水平,采用ELISA测定血清IL-11、BDNF水平,具体操作按照试剂盒说明书严格执行。
1.2.3 脑梗死体积的评估 所有脑梗死患者在入组后48 h内完成头颅MRI扫描,在MRI图像上手动勾勒出DWI异常的区域。将DWI异常的面积相加并乘以切片厚度(mm)和交叉间隙(mm),每例患者的总DWI病灶体积计算3次,取平均值作为梗死体积[9]。
1.2.4 神经缺损情况及预后的评价 所有入组的脑梗死患者于入组时采用NIHSS评分评价神经缺损程度。于90 d时采用mRS评分评价预后,mRS≤2分为预后良好,mRS>2分为预后不良。评分均由两位经验丰富的神经内科医师进行操作并记录。

2 结 果
2.1 各组间一般临床资料的比较 见表1、表2。脑梗死组高血压比率及HbA1c、LDL水平显著高于正常对照组(均P<0.05),余未见差异有统计学意义。根据mRS评分将脑梗死组患者分为预后良好亚组58例及为预后不良亚组44例。预后不良亚组的年龄、糖尿病比率、HbA1c水平、入院时NIHSS评分、脑梗死体积显著高于预后良好亚组(均P<0.05),其余差异均无统计学意义。
表1 脑梗死组和正常对照组临床资料的比较[±s,例(%)]
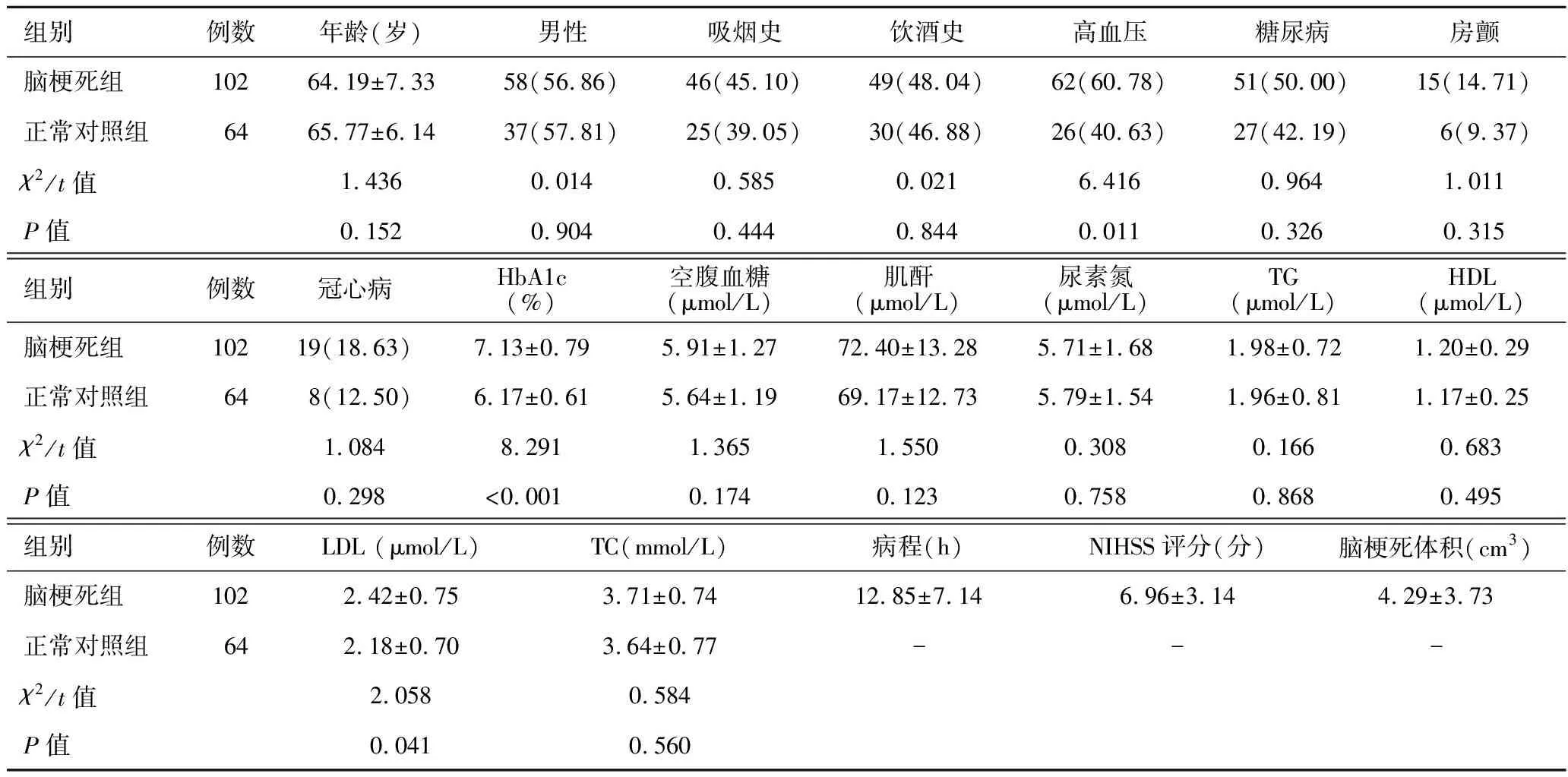
表1 脑梗死组和正常对照组临床资料的比较[±s,例(%)]
组别例数年龄(岁)男性吸烟史饮酒史高血压糖尿病房颤脑梗死组10264.19±7.3358(56.86)46(45.10)49(48.04)62(60.78)51(50.00)15(14.71)正常对照组6465.77±6.1437(57.81)25(39.05)30(46.88)26(40.63)27(42.19)6(9.37)χ2/t值1.4360.0140.5850.0216.4160.9641.011P值0.1520.9040.4440.8440.0110.3260.315组别例数冠心病HbA1c(%)空腹血糖(μmol/L)肌酐(μmol/L)尿素氮(μmol/L)TG(μmol/L)HDL(μmol/L)脑梗死组10219(18.63)7.13±0.795.91±1.2772.40±13.285.71±1.681.98±0.721.20±0.29正常对照组648(12.50)6.17±0.615.64±1.1969.17±12.735.79±1.541.96±0.811.17±0.25χ2/t值1.0848.2911.3651.5500.3080.1660.683P值0.298<0.0010.1740.1230.7580.8680.495组别例数LDL (μmol/L)TC(mmol/L)病程(h)NIHSS评分(分)脑梗死体积(cm3)脑梗死组1022.42±0.753.71±0.7412.85±7.146.96±3.144.29±3.73正常对照组642.18±0.703.64±0.77---χ2/t值2.0580.584P值0.0410.560
表2 预后良好亚组和预后不良亚组临床资料的比较[±s,例(%)]

表2 预后良好亚组和预后不良亚组临床资料的比较[±s,例(%)]
组别例数年龄(岁)男性吸烟史饮酒史高血压糖尿病房颤预后良好亚组5863.19±7.2830(51.72)26(44.83)26(44.83)33(56.90)23(39.66)11(18.97)预后不良亚组4466.72±7.7725(56.82)20(45.45)23(52.27)29(65.90)28(63.64)4(9.10)χ2/t值2.3560.2610.0040.5560.8535.7551.945P值0.0200.6090.9500.4560.3560.0160.163组别例数(n)冠心病HbA1c(%)空腹血糖(μmol/L)肌酐(μmol/L)尿素氮(μmol/L)TG (μmol/L)HDL (μmol/L)预后良好亚组5812(20.69)6.98±0.775.98±1.2172.81±13.635.58±1.331.97±0.641.19±0.20预后不良亚组447(15.91)7.33±0.665.83±0.9771.86±11.965.87±1.722.01±0.681.22±0.33χ2/t值0.3772.4160.6740.3670.9610.3040.568P值0.5390.0170.5020.7140.3390.7620.571组别例数LDL (μmol/L)TC(mmol/L)病程(h)入院NIHSS评分(分)脑梗死体积(cm3)预后良好亚组582.33±0.713.66±0.6812.62±6.525.52±2.332.52±2.17预后不良亚组442.55±0.633.78±0.7213.17±7.198.86±3.946.51±5.29χ2/t值1.6260.8610.4035.3455.202P值0.1070.3920.678<0.001<0.001
2.2 各组间血清IL-11水平的比较 脑梗死组血清IL-11水平[(325.71±43.59)ng/mL]显著低于正常对照组[(391.46±35.67)ng/mL](t=10.123,P<0.001)。脑梗死预后不良亚组血清IL-11水平[(295.98±41.31)ng/mL]显著低于预后良好亚组[(348.26±29.68)ng/mL](t=7.438,P<0.001)。
2.3 血清IL-11水平与NIHSS评分和脑梗死体积的相关性分析 见图1、2。脑梗死患者血清IL-11表达与NIHSS评分(r=-0.603,P<0.001)及脑梗死体积(r=-0.681,P<0.001)呈负相关关系。

图1 血清IL-11水平与入院时NIHSS评分的相关性分析散点图

图2 血清IL-11水平与脑梗死体积的相关性分析散点图
2.4 脑梗死患者预后影响因素的Logistics回归分析 见表3。以脑梗死预后为因变量,对年龄、糖尿病比率、HbA1c、NIHSS评分、脑梗死体积和血清IL-11水平进行Logistics回归分析。结果显示,IL-11为影响脑梗死患者预后的保护性因素(OR=0.814,P=0.009),脑梗死体积(OR=2.262,P<0.001)和NIHSS评分(OR=2.107,P=0.006)为影响脑梗死预后的危险因素。
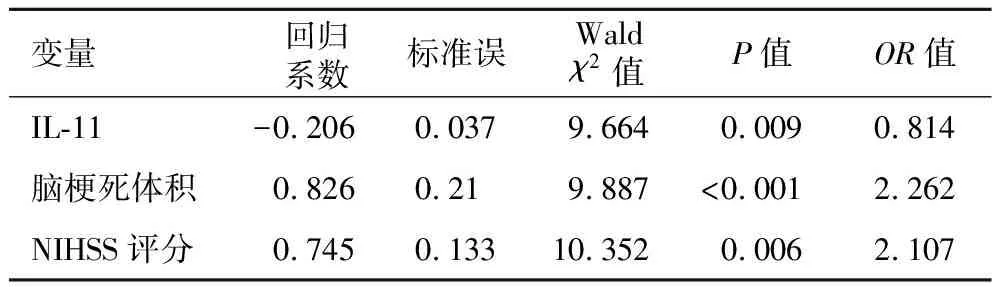
表3 脑梗死患者预后影响因素的Logistics回归分析
2.5 IL-11在脑梗死诊断和预后中的价值 见图3、图4。当IL-11应用于脑梗死的诊断时,ROC曲线下面积为0.841,灵敏性为91.18%,特异性为72.42%,截断值为378.47;当IL-11应用于脑梗死预后预测时,ROC曲线下面积为0.786,灵敏性为67.09%,特异性为87.93%,截断值为310.94。

图3 IL-11在脑梗死诊断分析中的ROC曲线

图4 IL-11在脑梗死预后预测中的ROC曲线
2.6 血清IL-11水平与脑梗死患者血清BDNF水平的相关性分析 见图5。脑梗死患者血清IL-11水平与血清BDNF水平的相关系数为r=0.711,P<0.01。

图5 脑梗死患者血清IL-11水平与血清BDNF水平的相关性分析散点图
3 讨 论
大量临床研究和动物实验[4,10-12]揭示了脑梗死后病理生理过程的复杂性,包括炎症反应、氧化应激和神经元凋亡等。目前已公认炎症反应是卒中进展和预后最为相关的核心因素之一[4],但其潜在的分子机制还有待进一步探索。IL-11在生物体内具有多种功能,研究[13-15]多集中于其对肿瘤和慢性炎症的调控作用,CNS疾病中的研究则较为稀缺。但随着研究的深入,Zhang等[16]发现,IL-11在早期复发缓解型多发性硬化症患者中可诱导Th17细胞分化和扩增。动物研究[17]也显示IL-11可加重复发缓解型实验性自身免疫性脑脊髓炎小鼠的病情,诱导CNS脱髓鞘。IL-11在脑梗死中调控作用也被逐渐挖掘。Zhang等[6]在大脑中动脉栓塞的鼠模型上观察到了脑缺血后IL-11 mRNA和蛋白表达降低,在补充IL-11后可减少脑缺血后的神经胶质活化和促炎细胞因子的表达,并可通过抑制腺苷酸活化蛋白激酶(AMPK)改善脑缺血后的氧化应激损伤和细胞凋亡,从而在脑缺血中发挥保护作用。在此基础上,本研究发现,脑梗死患者血清IL-11表达显著降低,同时脑梗死预后良好亚组血清IL-11表达显著高于预后不良亚组,即使在校正协因素后仍有显著性差异,与动物层面研究[6]一致,高度提示IL-11在脑梗死中的神经保护作用。
本研究结果显示,血清IL-11水平和NIHSS评分、脑梗死体积均呈负相关关系,提示IL-11或可作为评估脑梗死病情的良好外周血指标,用于早期病情评估。另外,脑梗死预后结局与患者的生活质量和预期寿命密切相关,是卒中治疗领域关注的重点问题[18]。本研究根据脑梗死患者90 d的预后结局进行了亚组分析,进一步探索了血清IL-11水平与脑梗死预后之间的关系,并通过Logistics回归结果证实了IL-11是影响脑梗死预后的独立保护性因素,提示早期低水平的IL-11可能对预后不良结局的发生具有促进作用。此外,ROC曲线分析结果也提示,血清IL-11水平或可应用于脑梗死的辅助诊断和预后评估,值得在临床中进一步推广和验证。有研究显示,脑梗死后BDNF信号通路的激活与维持神经细胞凋亡密切相关,在脑梗死后发挥重要的神经功能保护作用[7],并且白细胞介素家族成员与BDNF在其他神经系统疾病中亦存在较多的联系[19-20]。因此推测,IL-11可能也参与了脑梗死后的BDNF信号的调控,而本研究中相关性结果亦显示出IL-11与BDNF具较高的相关性,高度提示了IL-11可能参与了卒中后神经营养因子紊乱的过程,这需要在动物实验中进一步验证。
综上所述,本研究关注了脑梗死患者血清IL-11水平的变化,揭示了脑梗死后血清IL-11水平的变化,并证实了血清IL-11是影响脑梗死患者预后的独立保护性因素,对脑梗死的辅助诊断和90 d预后评估具有一定的应用价值。本研究仍存在不足之处,包括未对脑梗死分型进行观察、无法控制治疗方案的均一性、未考虑梗死灶部位对脑梗死预后因素的影响、缺乏对IL-11的动态监测结果和更为远期的预后观察数据等,相关研究仍有待进一步完善。
作者贡献说明赵晶提出选题,设计、实施研究,采集、分析、解释数据,撰写、修改文章;钱进军指导选题、设计研究,指导起草、修改文章
