鸡源SAMHD1 蛋白多克隆抗体的制备与鉴定
2024-03-11王一新张真研曹凤阳徐瑞雪谢之景崔言顺李建亮
王一新,张真研,曹凤阳,李 阳,徐瑞雪,谢之景,崔言顺,李建亮*
(1.山东农业大学动物科技学院,山东 泰安 271018;2.中国动物卫生与流行病学中心,山东 青岛)
不育α 基序和组氨酸/天冬氨酸蛋白(Sterile alpha motif and histidine/aspartic acid domaincontaining protein 1,SAMHD1)于2000 年被首次发现,该蛋白主要存在于免疫细胞,如单核细胞和树突状细胞中[1]。SAMHD1 蛋白由无菌α 基序(SAM)结构域和组氨酸-天冬氨酸(HD)结构域构成,前者负责蛋白质-蛋白质和蛋白质-核酸相互作用,后者则具有蛋白磷酸水解酶和核酸酶活性[2]。SAMHD1 蛋白从原核生物到真核生物均保守存在,该蛋白广泛参与了细胞周期调控、细胞稳态维持、DNA 损伤应答、免疫反应调节等过程,具有多种生物学功能[3]。
近年来的研究表明,作为一种重要的先天免疫限制因子,SAMHD1 还可以抑制反转录病毒的增殖、降低抗病毒免疫反应和炎症反应[4-5]。SAMHD1 能够调控细胞内的dNTP 含量,从而抑制包括人类免疫缺陷病毒(HⅠⅤ)在内的多种逆转录病毒的感染[1],如猫免疫缺陷病毒(FⅠⅤ)、小鼠白血病病毒(MuLⅤ)、马传染性贫血病毒(EⅠAⅤ)和牛免疫缺陷病毒(BⅠⅤ)等[6]。此外,SAMHD1 也可以抑制某些DNA 病毒在宿主细胞中的复制,如单纯疱疹病毒1 型(HSⅤ-1)和痘病毒[7]。
SAMHD1 蛋白具有种属特异性,猪源及马属动物源SAMHD1 已被证实具有抗病毒活性[8-9]。鸡源SAMHD1(chSAMHD1)基因位于鸡基因组第20 号染色体,编码614 个氨基酸,与人SAMHD1 蛋白同源性仅有60%左右,其生物学功能尚不清楚。本试验首先将chSAMHD1 的HD结构域克隆至pET32a(+)载体,构建原核表达质粒,并在BL2(DE3)大肠杆菌中诱导表达;随后将重组蛋白免疫SPF 级6 周龄BALB/c 小鼠制备抗chSAMHD1 多克隆抗体,并对所制备的多克隆抗体的反应性进行鉴定,从而为chSAMHD1 生物学功能的深入研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 质粒小量提取试剂盒、琼脂糖凝胶纯化试剂盒购自广州飞扬生物工程有限公司;常规限制性内切酶EcoR Ⅰ、Xho Ⅰ、T4 DNA连接酶、PrimeScript™ One Step RT-PCR 试剂盒购自宝生物工程(大连)有限公司;DH5α 和BL21(DE3)感受态细胞购自北京擎科生物科技有限公司;辣根过氧化物酶(HRP)及FⅠTC 荧光素标记的山羊抗鼠ⅠgG 购自北京全式金生物技术有限公司;镍预装柱购自金斯瑞生物科技有限公司;弗氏完全佐剂、弗氏不完全佐剂购自Sigma 公司。
1.1.2 实验动物 SPF 级BALB/c 小鼠购自济南朋悦实验动物繁育有限公司;原核表达载体pET-32a(+)和鸡胚成纤维细胞系DF-1 由本实验室保存。
1.2 方法
1.2.1 chSAMHD1 基因扩增及重组质粒构建 根据chSAMHD1 基因序列(GenBank 登录号:NM_001030845.2)设计引物,扩增chSAMHD1基因HD 结构域(开放阅读框第301-1 845 nt)序列。上游引物chSAMHD1-F: 5′-GAATTCATGCA GACAGCAGACATCATGA-3′,下游引物 chSA MHD1-R: 5′- GTCGACTTACTTATTGAAAGAG AGCT-3′,在上、下游引物的5′端分别引入EcoRⅠ和Sal Ⅰ 酶切位点。提取鸡淋巴细胞RNA,通过RT-PCR 扩增chSAMHD1 基因序列。反应体系为:PrimeScript One Step Enzyme Mix 2 μL,2×Buffer 25 μL,上下游引物(10 μM)各1 μL,RNA 4 μL,RNase-Free dH2O 17 μL。反应程序为:50 ℃ 反转录30 min,94 ℃ 2 min;94 ℃变性30 s,55 ℃ 退火30 s,72 ℃ 延伸1 min,进行30 个循环;72 ℃ 延伸10 min,4 ℃ 保存。通过琼脂糖凝胶电泳鉴定扩增产物,并用回收试剂盒进行切胶纯化。
1.2.2 pET-chSAMHD1 原核表达质粒的构建 使用限制性内切酶EcoR Ⅰ和Sal Ⅰ分别酶切pET-32a(+)载体和chSAMHD1 扩增片段,并用胶回收试剂盒纯化相应的酶切产物。使用T4 DNA 连接酶连接后转化至DH5α 大肠杆菌,挑取单克隆进行菌液PCR 鉴定,将阳性菌液送北京擎科生物科技有限公司进行测序。验证正确的提取质粒(命名为pET-chSAMHD1),置于-20 ℃ 保存、备用。
1.2.3 chSAMHD1 重组蛋白的诱导表达及纯化将pET-chSAMHD1 转化至BL21(DE3)大肠杆菌,挑取单克隆菌落接种于5 mL LB 培养基中培养过夜。第二天取出其中 1 mL 菌液转接于200 mL LB 培养基,于37 ℃,200 r/min 培养至OD600 约为0.6 时,加入ⅠPTG 诱导表达(终浓度为0.1 mmol/L),32 ℃ 继续培养6 h。随后12 000 r/min 离心10 min 收集菌体,使用10 mL PBS 重悬后超声破碎,分别将上清和沉淀进行SDS-PAGE 电泳,分析重组蛋白的表达形式。使用镍柱进行蛋白纯化,分别用6、4、2 mol/L 浓度的尿素和PBS 缓冲液透析。BCA 法定量后分装,置于-80 ℃ 保存。
1.2.4 chSAMHD1 重组蛋白的Western blot 鉴定将纯化的chSAMHD1 重组蛋白经SDS-PAGE 电泳后转移至PⅤDF 膜,加入1%的BSA 封闭1 h;弃封闭液,加入1:500 倍稀释的鼠抗His 抗体,4 ℃ 孵育过夜,TBST 缓冲液洗膜;然后加入1:1 000 倍稀释的HRP 标记的山羊抗鼠ⅠgG 二抗,室温孵育1 h,TBST 缓冲液洗膜;最后加入显影液,通过成像系统测定chSAMHD1 重组蛋白与抗His 抗体的反应性。
1.2.5 chSAMHD1 蛋白多克隆抗体的制备 将纯化的chSAMHD1 重组蛋白与弗式完全佐剂乳化后(体积比1:1),采用背部皮下注射的方式免疫5 只SPF 级6 周龄BALB/c 小鼠,每只免疫100 μg。2 周后,用chSAMHD1 重组蛋白与弗式不完全佐剂乳化后加强免疫(体积比1:1);2 周后,以同样的方式进行三免。三免10 d 后断尾采血并分离收集血清,分装后置于 -20 ℃ 保存。
1.2.6 chSAMHD1 多克隆抗体效价的测定 通过间接ELⅠSA 测定chSAMHD1 多克隆抗体效价。将重组chSAMHD1 蛋白包被ELⅠSA 板(0.1 μg/孔),4 ℃ 孵育过夜;加入5%脱脂奶粉封闭1 h;将制备的 chSAMHD1 多克隆抗体以1:1 000 ~1:512 000 稀释,加入到反应板中(100 μL/孔),37 ℃ 孵育1 h,PBST 洗涤3次;加入1:2 000 稀释的HRP 标记的羊抗鼠ⅠgG(100 μL/孔),37 ℃ 孵育1 h,PBST 洗涤3 次;加入100 μL TMB 底物显色液(100 μL/孔),37 ℃ 反应5 min 后加入2 mol/L H2SO4(100 μL/孔)终止反应;使用酶标仪测定OD450 值,以OD 值≥0.21 为临界值,计算效价。
1.2.7 间接免疫荧光试验(ⅠFA)检测多克隆抗体反应性 将chSAMHD1 真核表达质粒pcDNAchSAMHD1 转染至DF-1;36 h 后,用4%多聚甲醛室温固定10 min,PBS 洗5 次;加入1:100 倍稀释的鼠抗chSAMHD1 多克隆抗体,4 ℃ 孵育过夜,PBS 洗5 次;加入FⅠTC 标记的山羊抗鼠ⅠgG 二抗,37 ℃ 孵育1 h,PBS 洗5 次,通过荧光显微镜进行观察。
2 结果
2.1 chSAMHD1 原核表达质粒的构建
提取鸡淋巴细胞RNA,RT-PCR 扩增部分chSAMHD1 基因序列,通过琼脂糖凝胶电泳进行分析,结果表明成功扩增到与预期大小接近的目的片段(图 1)。将目的片段克隆至 pET-32a(+)载体,对构建的pET-chSAMHD1 质粒进行双酶切鉴定,结果可见1 545 bp(目的基因)和6 000 bp(载体)两个条带(图2)。挑取阳性克隆进行测序验证,结果显示所扩增的序列与理论序列同源性为100%,无点突变发生。
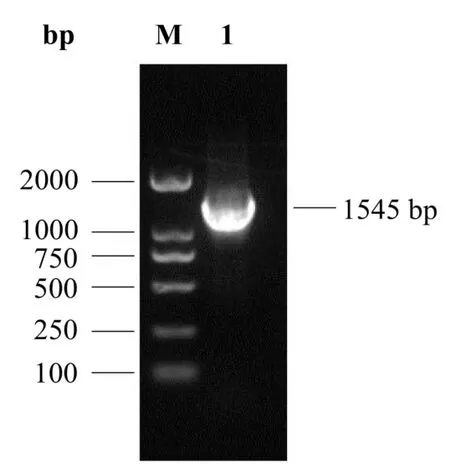
图1 部分chSAMHD1 基因的扩增
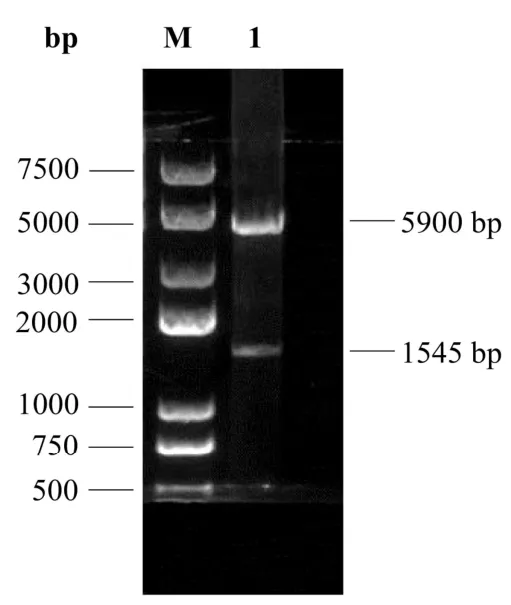
图2 pET-SAMHD1 质粒的双酶切验证
2.2 chSAMHD1 重组蛋白的诱导表达与纯化
将 pET-chSAMHD1 质粒转化至 BL21(DE3)大肠杆菌,加入终浓度为0.1 mmol/L 的ⅠPTG 进行诱导表达并分析蛋白可溶性。SDSPAGE 电泳结果显示,chSAMHD1 重组蛋白约75.0 kDa,与预期大小一致,且目的蛋白主要以包涵体形式表达(图3)。经Ni 柱纯化后,可见单一目的条带(图 4 ), 表明所制备的chSAMHD1 重组蛋白纯度较高。

图3 chSAMHD1 蛋白的表达分析

图4 chSAMHD1 蛋白的纯化分析
将纯化的 chSAMHD1 重组蛋白经 SDSPAGE 电泳后转印至PⅤDF 膜,通过Western blot分析蛋白的反应原性。结果表明,重组chSAMHD1蛋白可以与抗His 抗体发生特异性反应(图5)。
2.3 chSAMHD1 重组蛋白的反应原性鉴定

图5 纯化蛋白的Western blot 鉴定
2.4 chSAMHD1 多克隆抗体的制备及抗体效价测定
将纯化的重组chSAMHD1 蛋白用弗氏佐剂乳化后免疫6 周龄BALB/c 小鼠,三免后收集血清,采用间接ELⅠSA 测定多克隆抗体效价。结果表明,本试验所制备的抗chSAMHD1 多克隆抗体的抗体效价可达1:256 000,可满足后续试验需求。
2.5 chSAMHD1 多克隆抗体反应性的ⅠFA 鉴定
将 chSAMHD1 真核表达质粒 pcDNAchSAMHD1 转染DF-1 细胞,以1:100 稀释的chSAMHD1 多克隆抗体作为一抗进行ⅠFA 试验。结果显示,抗chSAMHD1 多克隆抗体能够与转染真核表达质粒的DF-1 发生特异性反应,表明该抗体具有良好的反应性(图6)。

图6 多克隆抗体对真核表达chSAMHD1 蛋白的ⅠFA 检测
3 讨论与结论
SAMHD1 是一种在多种物种中广泛表达的脱氧核苷酸三磷酸水解酶(dNTPase),该蛋白由无菌α 基序(SAM)结构域和组氨酸-天冬氨酸(HD)结构域组成。一般认为,SAM 结构域介导蛋白质与蛋白质或蛋白质与核酸的相互作用,而HD 结构域则发挥dNTPase 活性[3]。SAMHD1可形成四聚体,这种寡聚作用是其催化dNTPase活性所必需的。SAMHD1 可将dNTP 转化为脱氧核苷和三磷酸盐,从而抵消dNTP 的从头合成[6]。
近年来的研究表明,SAMHD1 是一种可对抗多种病毒的宿主限制因子。研究人员最早在非增殖性髓系细胞如巨噬细胞和树突状细胞中发现SAMHD1 可抑制HⅠⅤ-1 的复制[1-3]。由于HⅠⅤ-1等反转录病毒需要以前病毒cDNA 的形式将其整合到宿主基因组中,因此反转录病毒需要较高的细胞内dNTP 水平进行逆转录。在非分裂细胞中,SAMHD1 通过下调细胞内dNTP 的浓度来限制病毒的复制[10]。除了HⅠⅤ-1,SAMHD1 也可以抑制乙型肝炎病毒(HBⅤ)、人巨细胞病毒(Human cytomegalovirus, HCMⅤ)、痘病毒等DNA 病毒的复制。对于不同病毒,SAMHD1 可通过不同的机制发挥抗病毒功能。HBⅤ 通过RNA 中间体和逆转录步骤复制其病毒DNA 基因组,因此SAMHD1 的dNTPase 活性可以有效地限制细胞中 HBⅤ DNA 的复制[11]。此外,SAMHD1 可直接结合NF-κB,阻断NF-κB 与病毒启动子的结合,从而抑制HCMⅤ早期基因的表达,进而抑制病毒复制[12]。
在不同物种中,SAMHD1 也具有一定的抗病毒作用。如猪源SAMHD1 可以通过抑制RNA 的合成来抑制猪繁殖和呼吸综合征病毒(PRRSⅤ)。但是,关于鸡源SAMHD1 蛋白的功能、作用及调控机制的报道较少。研究发现,chSAMHD1 与人 SAMHD1 蛋白同源性约 62%,具有与人SAMHD1 蛋白类似的结构组成,并且chSAMHD1同样具有dNTP 水解酶和核酸酶活性[13],由此推测chSAMHD1 可能具有抗病毒作用。然而,目前缺乏商业化的chSAMHD1 抗体,这限制了对chSAMHD1 功能的研究。因此制备chSAMHD1多克隆抗体对于研究chSAMHD1 蛋白抗病毒功能和机制具有重要意义。
经蛋白理化性质预测,chSAMHD1 的SAM结构域不适于大肠杆菌原核表达系统的表达。因此,本试验选择chSAMHD1 的HD 结构域进行原核表达,并将其作为免疫原免疫BALB/c 小鼠以制备多克隆抗体。本试验首先构建了 pETchSAMHD1 原核表达质粒,可溶性分析表明chSAMHD1 蛋白以包涵体的形式表达。将纯化蛋白免疫BALB/c 小鼠制备抗chSAMHD1 蛋白的多克隆抗体,间接ELⅠSA 方法测定本研究制备的多抗效价可以达到1:256 000 以上,可以满足后续试验的需求。本试验所制备的chSAMHD1 多克隆抗体为后期蛋白抗病毒功能的研究奠定了基础。