基于IL-6 介导的JAK1/STAT3 信号通路探讨竹叶石膏汤合清气化痰丸对COPD 大鼠的改善作用
2024-03-10陈云坤李秀华张文斌
陈云坤,王 杰,李秀华,张文斌*
(1.重庆市中医院呼吸与危重症医学科,重庆 400011; 2.重庆市中医院呼吸内科,重庆 400011)
呼吸系统疾病给全世界带来了巨大的健康负担,每年有3 亿人患COPD,导致多达300 万人死亡,是全球第三大死因。然而,COPD 的发病机制尚未完全阐明,研究表明其与吸烟、职业粉尘和化学品、空气污染、气道上皮细胞慢性炎症、氧化应激反应增强、蛋白酶和抗蛋白酶系统失衡有关,整个过程与许多细胞因子和信号通道有关[1-3]。有研究表明,多种炎症细胞可以在COPD 机制下释放炎症因子和炎症趋化因子,通过信号转导子以及转录激活子通路(Janus kinase/signal transducer and activator of transcription,JAK/STAT) 信号通路参与细胞增殖、分化、凋亡和炎症反应等病理生理机制[4]。吸烟或感染等外界刺激会激活气道上皮细胞释放大量炎症介质,造成体内中性粒细胞、巨噬细胞等炎症相关细胞以活性状态聚集于气道内,进而与JAKs 受体结合激活JAK1/STAT3 信号通路,促进COPD 炎症反应复发,导致呼吸道、肺组织以及血管的损伤,并产生一系列呼吸道临床症状引起COPD 急性发作[5-7]。本研究通过建立COPD 大鼠模型,给予竹叶石膏汤合清气化痰丸进行干预,通过对大鼠肺功能以及相关蛋白表达进行检测,探讨竹叶石膏汤合清气化痰丸治疗COPD 发病的潜在机制。
1 材料
1.1 动物 SPF 级雄性SD 大鼠48 只,10~12 周龄,体质量(200±50) g,购自湖南省斯莱克景达实验动物有限公司[实验动物生产许可证号SCXK (湘) 2019-0004],饲养于重庆市中医院实验动物中心[实验动物使用许可证号SYXK (渝) 2020-0001],室温(23±2)℃,相对湿度(60±5)%,清洁通风,自由饮水进食,适应性喂养7 d。动物实验经重庆市中医院伦理委员会批准(伦理号2017-KY-12)。
1.2 药物 竹叶石膏汤合清气化痰丸由淡竹叶15 g、生石膏30 g、法半夏15 g、麦冬20 g、人参10 g、甘草6 g、黄芩10 g、瓜蒌子30 g、胆南星12 g、陈皮15 g、苦杏仁10 g、枳实15 g、鱼腥草30 g、浙贝母10 g、竹茹15 g 组成,按照剂量分成三等分,参考临床等效剂量换算为高剂量,确定低、中、高剂量分别为5、10、15 g/kg。各药材根据以上比例配制后加水煎煮2 次,调至生药量2 g/mL,于冰箱中冷藏备用。
1.3 试剂 Superscript ⅡRT、SYBR Green 试剂盒(美国Thermo Fisher Scientific 公司,批号18064014、11735032);MaxVisionTM试剂盒(福州迈新生物技术开发有限公司,批号KIT-5002); 二氨基联苯胺(北京百奥莱博科技有限公司,批号QN1149-DGR); IL-6、JAK1、STAT3、SOCS3 抗体(英国Abcam 公司,批号ab6672、ab125051、ab31370、ab16030)。
2 方法
2.1 模型建立 大鼠按随机数字表法分为正常组,模型组,中药低、中、高剂量组及中药低、中、高剂量+伊他替尼组,每组6 只。采用气道滴注脂多糖(lipopolysaccharide,LPS) 联合烟熏方法建立COPD 模型,在自制50 cm×40 cm×40 cm 玻璃吸烟染毒箱内加20 支香烟烟丝混合点燃烟熏,每天2 次,每次30 min,隔2 d 休息1 次,第1、14天,每只大鼠气道内滴入200 μL 1 g/L LPS,当天不予以吸烟; 正常组大鼠置于吸烟染毒箱内呼吸正常空气,气道内滴入0.2 mL 生理盐水。造模28 d 后开始给药,中药低、中、高剂量组分别每天灌胃给予5、10、15 g/kg 竹叶石膏汤合清气化痰丸(1.4 mL/100 g); 中药低、中、高剂量+伊他替尼组分别灌胃给予相应剂量竹叶石膏汤合清气化痰丸,同时皮下注射30 mg/kg伊他替尼; 正常组和模型组灌胃给予等量生理盐水,连续给药2 周。
2.2 肺功能检测 采用大鼠肺功能检测仪测量大鼠呼气峰流速 (peak expiratory flow,PEF)、吸气峰流速 (peak inspiratory flow,PIF)、分钟通气量(minute volume,MV)。
2.3 HE 染色观察肺组织病理形态 大鼠肺组织用含4%多聚甲醛的PBS 溶液在4 ℃下固定24 h,石蜡包埋后切成3 μm 薄片,脱蜡脱水,苏木精和伊红染色,于光学显微镜下观察组织形态,并拍摄照片。
2.4 RT-qPCR 法检测肺组织IL-6、JAK1、STAT3 和SOCS3 mRNA 表达 收集各组大鼠肺组织,采用TRIzol 法提取组织总RNA,随后使用Superscript ⅡRT 试剂将RNA 逆转录成cDNA。配制反应体系(0.5 μL Template DNA、10 μL SYBR Green、0.4 μL ROX Reference Dye Ⅱ、正反向引物各0.8 μL、双蒸水补充体积至20 μL) 进行扩增反应,反应条件为95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,共40 个循环,通过2-ΔΔCT法计算目的基因相对表达。引物序列见表1。

表1 引物序列
2.5 免疫印迹法检测肺组织IL-6、JAK1、STAT3、SOCS3蛋白表达 使用RIPA 试剂裂解大鼠肺组织,提取总蛋白,BCA 法定量,95 ℃加热5 min 进行变性。制备10% SDSPAGE 凝胶,每条泳道上样30 μg 蛋白,电泳分离后将其转移到PVDF 膜上,封闭,加稀释的一抗孵育1 h,然后加二抗孵育1~2 h,通过增强的化学发光试剂显色,通过Image J 1.8.0 软件分析蛋白条带和内参β-actin 的光密度值,以两者比值表示蛋白相对表达。
2.6 免疫组化法检测肺组织IL-6、JAK1、STAT3、SOCS3蛋白表达 采用4%多聚甲醛固定大鼠肺组织,脱水后石蜡包埋,制备5 μm 切片,脱蜡、水合后将载玻片与3% H2O2孵育10 min,与0.1%胰蛋白酶孵育20 min,滴加一抗,在4 ℃下孵育过夜,次日与HRP-聚合物偶联的二抗在37 ℃下孵育1 h,DAB 染色3 min,苏木精复染细胞核,于倒置显微镜下观察,阳性染色为棕黄色。通过Image J 软件分析肺组织蛋白的平均光密度(AOD) 值(累计光密度/有效目标分布区域面积),其数值越大,蛋白阳性表达越高。
2.7 统计学分析 通过Graphpad Prism 8.0.1 软件进行处理,计量资料以(±s) 表示,组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 竹叶石膏汤合清气化痰丸对COPD 大鼠肺功能的影响 与正常组比较,模型组大鼠PIF、PEF、MV 降低(P<0.05); 与模型组比较,中药各剂量组和中药各剂量+伊他替尼组PIF、PEF 升高(P<0.05),中药中、高剂量组和中药各剂量+伊他替尼组MV 升高(P<0.05); 与中药各剂量组比较,中药各剂量+伊他替尼组PIF、MV 降低 (P<0.05); 与中药中、高剂量组比较,中药中、高剂量+伊他替尼组PEF 降低(P<0.05),见表2。
表2 竹叶石膏汤合清气化痰丸对COPD 大鼠肺功能的影响(±s,n=6)

表2 竹叶石膏汤合清气化痰丸对COPD 大鼠肺功能的影响(±s,n=6)
注: 与正常组比较,▲P<0.05; 与模型组比较,*P<0.05; 与中药低剂量组比较,#P<0.05; 与中药中剂量组比较,&P<0.05; 与中药高剂量组比较,ΔP<0.05。
组别PIF/(mL·s-1)PEF/(mL·s-1)MV/mL正常组5.42±0.163.01±0.0743.48±1.91模型组1.20±0.07▲1.63±0.10▲22.71±1.88▲中药低剂量组2.28±0.18*2.01±0.10*30.67±1.33中药中剂量组3.50±0.24*#2.40±0.19*#35.23±0.84*#中药高剂量组3.88±0.07*&2.65±0.06*41.33±1.14*&中药低剂量+伊他替尼组1.84±0.09*#1.88±0.11*25.03±0.84*#中药中剂量+伊他替尼组2.02±0.10*&2.01±0.23*&29.29±1.04*&中药高剂量+伊他替尼组2.34±0.15*Δ2.09±0.09*Δ33.70±1.65*Δ
3.2 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织形态学的影响 如图1 所示,正常组大鼠肺组织清晰可见,支气管壁结构较规则,无明显损伤,仅见少量炎性细胞浸润,并且未观察到黏液栓、黏液、黏膜充血水肿等; 模型组大鼠肺组织多处腺体增生,大量炎性细胞浸润,管壁增厚,肺泡壁结构严重受损、变薄、破裂,继而导致肺大泡形成,肺泡数量减少; 与模型组比较,中药中、高剂量组大鼠肺组织病理损伤明显得到改善,支气管壁变薄、局部脱落,炎症细胞浸润和充血水肿减轻,肺大泡减少,并且肺泡腔的破坏、扩张和融合得到缓解; 中药中、高剂量+伊他替尼组大鼠肺泡扩张和融合得到改善,炎症细胞浸润和黏膜充血减少,以中药高剂量+伊他替尼组更优。

图1 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织形态学的影响(HE,×400)
3.3 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织IL-6、JAK1、STAT3 和SOCS3 mRNA 表达的影响 与正常组比较,模型组大鼠肺组织IL-6、JAK1、STAT3 mRNA 表达升高(P<0.05),SOCS3 mRNA 表达降低(P<0.05); 与模型组比较,中药各剂量组大鼠肺组织IL-6、JAK1、STAT3 mRNA表达降低(P<0.05),SOCS3 mRNA 表达升高(P<0.05);与中药各剂量组比较,中药各剂量+伊他替尼组IL-6、JAK1、STAT3 mRNA 表达升高(P<0.05),SOCS3 mRNA 表达降低(P<0.05),见表3。
表3 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织IL-6、JAK1、STAT3 和SOCS3 mRNA 表达的影响(±s,n=3)

表3 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织IL-6、JAK1、STAT3 和SOCS3 mRNA 表达的影响(±s,n=3)
注: 与正常组比较,▲P<0.05; 与模型组比较,*P<0.05; 与中药低剂量组比较,#P<0.05; 与中药中剂量组比较,&P<0.05; 与中药高剂量组比较,ΔP<0.05。
组别IL-6JAK1STAT3SOCS3正常组1.00±0.011.00±0.031.00±0.091.00±0.02模型组8.09±0.32▲8.08±0.32▲8.07±0.30▲0.15±0.01▲中药低剂量组6.14±0.12*6.05±0.27*6.21±0.40*0.38±0.01*中药中剂量组4.31±0.17*#4.13±0.10*#4.06±0.29*#0.72±0.05*#中药高剂量组2.03±0.06*2.04±0.03*&1.97±0.18*&0.88±0.03*&中药低剂量+伊他替尼组8.11±0.20#7.71±0.45#8.11±0.28#0.16±0.01#中药中剂量+伊他替尼组7.17±0.12*&7.02±0.13&6.90±0.30&0.24±0.01&中药高剂量+伊他替尼组6.22±0.04*Δ6.35±0.35*Δ6.15±0.21*Δ0.41±0.03*Δ
3.4 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织IL-6、JAK1、STAT3 和SOCS3 蛋白表达的影响
3.4.1 免疫印迹检测 如图2 所示,与正常组比较,模型组大鼠肺组织IL-6、JAK1、STAT3 蛋白表达升高 (P<0.05),SOCS3 蛋白表达降低(P<0.05); 与模型组比较,中药各剂量组大鼠肺组织IL-6、JAK1、STAT3 蛋白表达降低(P<0.05),SOCS3 蛋白表达升高(P<0.05); 与中药各剂量组比较,中药各剂量+伊他替尼组IL-6、JAK1、STAT3蛋白表达升高 (P<0.05),SOCS3 蛋白表达降低 (P<0.05)。
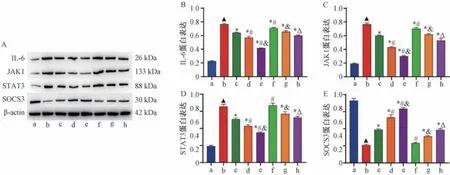
图2 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织IL-6、JAK1、STAT3、SOCS3 蛋白表达的影响(±s,n=3)
3.4.2 免疫组化检测 如图3 ~6 所示,正常组IL-6、JAK1、STAT3 阳性表达较少,IL-6 主要表达于细胞核,SOCS3 阳性表达较强,呈深褐色,SOCS3 主要在细胞质中表达。与正常组比较,模型组IL-6、JAK1、STAT3 阳性表达最多,IL-6 主要在细胞核和细胞质表达,JAK1、STAT3定位于细胞核或细胞质,SOCS3 呈弱阳性表达; 与模型组比较,中药各剂量组IL-6、JAK1、STAT3 阳性表达减少,IL-6、JAK1、STAT3 主要表达于细胞质或细胞核,SOCS3阳性表达增强,主要定位于细胞质或质膜; 与中药各剂量组比较,中药各剂量+伊他替尼组IL-6、JAK1、STAT3 阳性表达增加,SOCS3 阳性表达减少。与正常组比较,模型组IL-6、JAK1、STAT3 的AOD 值升高(P<0.05),SOCS3 的AOD 值降低(P<0.05); 与模型组比较,中药各剂量组IL-6、JAK1 的AOD 值降低(P<0.05),中药中、高剂量组STAT3 的AOD 值降低(P<0.05),SOCS3 的AOD 值升高(P<0.05); 与中药各剂量组比较,中药各剂量+伊他替尼组IL-6 的AOD 值升高(P<0.05); 与中药高剂量组比较,中药高剂量+伊他替尼组SOCS3 的AOD 值降低(P<0.05)。

图3 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织IL-6 表达的影响(免疫组化,×400,±s,n=3)
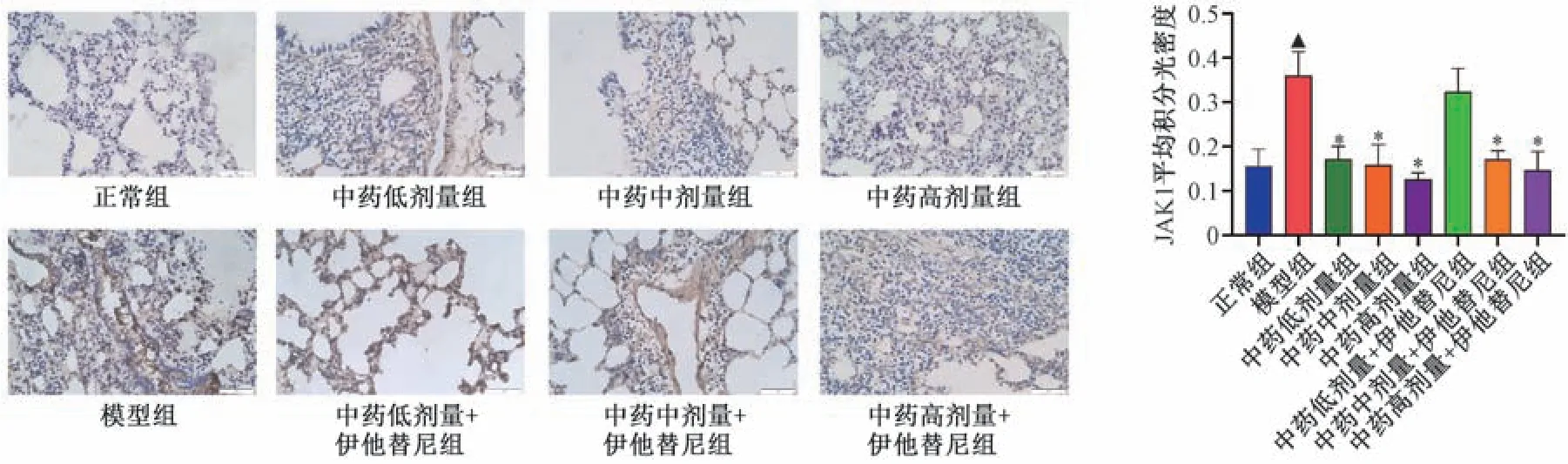
图4 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织JAK1 表达的影响(免疫组化,×400,±s,n=3)

图5 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织STAT3 表达的影响(免疫组化,×400,±s,n=3)

图6 竹叶石膏汤合清气化痰丸对COPD 大鼠肺组织SOCS3 表达的影响(免疫组化,×400,±s,n=3)
4 讨论
COPD 是临床上常见的呼吸系统疾病之一,以持续气流受限为主要表现,伴随呼吸困难、咳嗽、咳出黏液(痰)和喘息,严重影响患者的生存与生活质量[8-10]。炎症因子在COPD 的发生发展中起主导作用,涉及多种炎症细胞、细胞因子和炎症介质,包括中性粒细胞、巨噬细胞、T 淋巴细胞、IL-6、L-8 和肿瘤坏死因子-α 等,其中IL-6 是COPD 气道炎症中的重要促炎因子,在COPD 患者痰液、肺实质和血液中都发现IL-6 不同程度的升高[11-12]。
本研究发现,中药各剂量组均能改善COPD 模型大鼠肺功能,缓解肺气流受限、通气功能障碍,并减缓肺组织疾病和支气管壁炎症,同时还发现,IL-6、JAK1、STAT3 mRNA 和蛋白表达在COPD 大鼠肺组织中均升高,说明COPD 的发生发展与JAK1/STAT3 的持续激活和过表达及肺组织信号转导通路异常密切相关。STAT3 的激活水平与IL-6 表达呈正相关。以往研究也表明,STAT3 在肺泡上皮细胞中可被IL-6 激活,导致STAT3 持续激活和过度表达,与气道炎症和肺气肿的发生密切相关[13-14]。许光兰等[15]研究发现,清金化痰颗粒可下调COPD 急性期大鼠STAT3 过度表达,抑制IL-6 表达的升高,减轻气道炎症。此外,王成阳等[16]研究也发现,JAK1、STAT3、p-STAT3 在COPD 大鼠模型中过度表达,JAK1 活化后,迅速激活STAT3 使其磷酸化,p-STAT3 反过来又促进炎症因子表达的升高,进而加重COPD。在烟熏和LPS 联合诱导下,大鼠肺组织中促炎因子IL-6 表达增加,结合细胞表面的IL-6R,进一步诱导JAK1 磷酸化。JAK1 激活迅速与STAT3 结合使STAT3 磷酸化并被激活。此外,有研究表明,抑制STAT3 后,能够导致LPS 诱导的IL-6 基因及蛋白表达降低[17]。本研究结果表明,竹叶石膏汤合清气化痰丸通过下调JAK1、STAT3 蛋白表达,抑制其过度表达,缓解大鼠肺部组织炎症,降低IL-6 炎症因子表达,抑制JAK1/STAT3 通路。
本研究还表明了竹叶石膏汤合清气化痰丸可上调SOCS3 基因和蛋白表达。JAK/STAT 信号通路的IL-6 依赖性激活受到SOCS 蛋白家族成员的严格调控,SOCS1/SOCS3上调的快速反馈有效抑制生理条件下STAT3 的磷酸化,目前普遍认为SOCS3 是STATs 的靶基因,能够直接抑制STATs 的活化[13,18]。最新研究发现,IL-6 能够与JAK/STAT信号通路上的受体结合引起炎症反应并可启动SOCS3 基因表达,起负反馈调节作用[19-20]。本研究结果还表明,添加伊他替尼后会抑制竹叶石膏汤合清气化痰丸提升肺功能和抑制炎症相关基因和蛋白表达的能力。本研究初步表明,竹叶石膏汤合清气化痰丸可能通过调控IL-6 介导的JAK/STAT 通路减缓COPD 炎症和发作。
