基于自噬调控的黄芪药理作用研究进展
2024-03-10程馨玮
程馨玮,高 萍
(1.华中科技大学同济医学院附属武汉儿童医院药学部,湖北 武汉 430015; 2.华中科技大学同济医学院附属同济医院药学部,湖北 武汉 430030)
黄芪是被广泛应用的传统中药材,为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Bge.var.mongholicus(Bge.) Hsiao 或膜荚黄芪A.membranaceus(Fisch.) Bge.的干燥根,具有扶正补气之功效。黄芪的药理作用广泛,具有抗炎、抗氧化、抗衰老、免疫调节等生物活性,在抗心脑血管疾病、病毒感染、肿瘤、衰老等方面具有重要作用[1]。近年研究发现,黄芪对多种疾病的干预效果均与其调控细胞自噬有着密切关系[2]。因此,本文对黄芪及其活性成分调控细胞自噬的分子机制和药理作用进行总结,以期为黄芪治疗自噬相关疾病提供新的探索方向,为其他中药在细胞自噬领域的研究提供参考。
1 自噬概述
1.1 定义 自噬是一个吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,不仅可以消除细胞内错误折叠的蛋白质、功能受损的细胞器以及入侵的微生物,还能作为一种动态循环媒介,为细胞更新和内环境稳态平衡提供新的组件和能量,以协助细胞应对各种应激和不利条件[3],但自噬过度激活反而会降解细胞核导致细胞死亡[4]。
1.2 分类与过程 根据细胞中被降解物质与溶酶体结合的形态和机制的差异,自噬分为巨自噬、微自噬和分子伴侣介导的自噬。通常研究的自噬是指巨自噬,其过程包括自噬的激活,自噬体的形成、延伸、成熟及自噬体与溶酶体的融合[5]。当细胞处于应激环境下,如氧化应激、能量缺乏、缺氧等,腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK) 等蛋白能够广泛抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 从而启动自噬。当自噬被激活后,由自噬相关基因蛋白 13(Autophagy-related gene13,Atg13)、unc-51 样自噬激活激酶1 (unc-51-like kinase 1,ULK1) 和黏着斑激酶家族相互作用蛋白200kda 形成ULK 复合体锚定于自噬囊泡上[6-7],募集并动员包含VSP34、Beclin1、p150 和Atg14 的Ⅲ型磷脂酰肌醇3-激酶(phosphoinositide 3-kinases,PI3K) 复合体。Ⅲ型PI3K 复合体能够结合自噬囊膜组分,引导更多Atg 蛋白定位[8]。随后,经过Atg12-Atg5 和微管相关蛋白1轻链3 (light chain 3,LC3) 2 个类泛素化结合修饰过程[9],自噬囊泡膜逐渐延伸。LC3 经过切割、泛素修饰、共价结合脂分子磷脂酰乙醇胺形成LC3-Ⅱ,附着在自噬囊泡膜上,参与自噬囊泡的延伸并最终闭合形成自噬体。自噬体与溶酶体融合形成自噬溶酶体[7],最终经溶酶体内的蛋白酶发挥作用完成对内容物的降解。
1.3 在疾病中的作用 自噬是维持细胞稳态的重要机制。近年来的研究发现,自噬与神经紊乱、发育异常、炎症性疾病、衰老、癌症等多种疾病的发生发展息息相关[10]。对于人体正常组织器官,自噬上调被认为是一种对细胞应激的适应性反应,是机体的自我保护机制之一。自噬作为降解聚集蛋白和受损细胞器的主要机制,其功能障碍与多种神经退行性疾病有关,如阿尔茨海默病、帕金森病、亨廷顿病、肌萎缩侧索硬化症等[11]。然而过度的自噬也会造成器官损伤,在新生儿缺血性脑损伤疾病中,自噬的过度激活可导致神经细胞大量死亡[4]; 缺血-再灌注心肌损伤模型中,再灌注阶段观察到自噬表达大规模增加和心肌细胞死亡[12]。癌症发展的不同阶段,自噬分别起着抑制或促进肿瘤作用: 肿瘤发生早期,自噬可阻止肿瘤的发生发展,并上调肿瘤对化疗药物的敏感性; 晚期阶段相反,自噬会促进已形成的肿瘤的生存生长并提高肿瘤的侵袭性[13]。
2 黄芪对自噬的调控及临床意义
近年来研究发现,自噬是黄芪发挥生物活性的重要药理机制。黄芪含有多种活性成分,包括多糖、皂苷类、黄酮类及氨基酸、微量元素等,目前对自噬的调控机制研究多集中于黄芪多糖、黄芪甲苷和毛蕊异黄酮。
黄芪对自噬的调控具有两重性,其具体的调节方向可能与细胞本身的自噬水平相关。一方面,当细胞内自噬水平处于抑制状态时,黄芪能够上调自噬活性。在糖尿病大鼠模型中,黄芪甲苷可增加自噬相关信号的表达,改善肝功能和血糖稳态[14],减轻肾足细胞的凋亡,改善大鼠糖尿病肾病[15],缓解施旺细胞凋亡导致的周围神经病变[16],为糖尿病及其并发症的治疗提供一种新的策略; 黄芪甲苷还可通过增强自噬减轻细胞的炎症反应和吸烟导致的肺损伤[17]; 黄芪甲苷也可作为抗先兆子痫的保护剂和治疗剂,通过诱导细胞自噬实现对氧化应激诱导的滋养层细胞损伤的保护作用[18]。在黄芪多糖作用下,宫颈癌细胞[19]、胃癌细胞[20]、胰腺癌细胞[21]的自噬相关蛋白表达升高,癌细胞对化疗药物敏感性增加。
另一方面,黄芪能够下调细胞的过度自噬。毛蕊异黄酮以剂量依赖性抑制血管紧张素Ⅱ诱导肾小球系膜细胞的自噬[22],还可抑制慢性肾脏病大鼠的骨骼肌细胞自噬,缓解骨骼肌萎缩[23],对大鼠慢性肾脏疾病及其并发症有治疗或预防作用; 黄芪甲苷及黄芪注射液抑制缺血性心肌病大鼠心肌细胞的自噬、显著降低心肌重塑[24-25]; 黄芪多糖对高磷酸盐诱导损伤动脉平滑肌细胞损伤的保护作用,也是通过抑制过度自噬实现的[26]。
3 黄芪调节自噬的相关信号通路
3.1 PI3K/AKT 通路 黄芪可通过mTOR 依赖和非依赖性途径影响PI3K/蛋白激酶B (protein kinase B,PKB 或称AKT) 通路,从而调节自噬。Ⅰ型PI3K 可促使AKT 磷酸化而使其激活,活化的AKT 能够抑制结节硬化复合物,减弱其对GTP 形式的Ras 家族蛋白脑组织同源类似物(ras homolog enriched in brain,Rheb) 的水解作用,使得Rheb-GTP 积累并进一步活化mTORC1,从而抑制自噬的启动[27]。众多研究表明,黄芪甲苷和黄芪多糖可以抑制细胞PI3K/AKT/mTORC1 通路促进自噬,延缓疾病进展[16,28-30]。磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN) 是PI3K/AKT/mTORC1 通路的负调节因子,能够直接阻止AKT 磷酸化进程[31-32]。黄芪多糖可增加PTEN 的表达,抑制AKT 的磷酸化,有助于自噬的启动[33]。Lv 等[34]研究表明microRNA-155 可抑制Rheb 的转录从而增强细胞自噬活性。在黄芪甲苷作用下,microRNA-155 的表达上调并促进细胞自噬,减轻施旺细胞凋亡所致的髓鞘损伤[16]。而在自噬水平异常增加的病理状态,如缺氧-复氧所致的心肌细胞损伤,黄芪甲苷和黄芪多糖也能够激活PI3K/AKT/mTORC1 通路抑制自噬[35-36],其具体调控机制尚不明确。
另一方面,黄芪还可以影响AKT 其他底物,即通过非mTOR 依赖性通路调节自噬。AKT 能够增加下游分子质量为160 ku 的蛋白激酶B 的底物蛋白(AKT substrate of 160 ku,AS160) 的磷酸化,致使后者将GDP 转化为GTP 的作用受到抑制,引起Ras 相关蛋白14 过早在吞噬体膜聚集,而抑制自噬体的成熟,最终抑制自噬活性[37]。Lu 等[30]发现,黄芪甲苷能显著抑制PI3K/AKT/AS160 通路的激活,增加细胞自噬,改善慢性糖尿病大鼠肾功能的损伤。
3.2 MAPK 信号通路 丝裂原活化激酶(mitogen-activated protein kinases,MAPK) 通路包括细胞外信号调控的蛋白激酶(extracellular regulated protein kinases,ERK)、c-Jun N端激酶(c-Jun N-terminal kinase,JNK) 和p38 有丝分裂原活化蛋白激酶(P38MAPK),共同调节细胞的生长、分化、应激、自噬、炎症反应等多种重要的生理/病理活动[38],但这3 种蛋白对自噬的调节位点不尽相同。p38 MAPK 既可通过抑制ULK1 的活性,阻断其与Atg13 的相互作用[39],亦可通过降低PTEN 的磷酸化水平来调节自噬[40]。Wu等[41]发现,黄芪甲苷通过抑制p38 MAPK,激活自噬,增加Ⅰ型胶原蛋白的积聚,保护中波紫外线诱导的光老化细胞,提示黄芪甲苷在抗光老化治疗中具有潜在的应用前景。ERK 对自噬的调控具有两面性,一方面,激活的ERK 可增加LC3 表达、LC3-Ⅰ向LC3-Ⅱ的转化、诱导Baclin-1 表达等,促进自噬[42]; 另一方面,ERK 抑制溶酶体相关膜蛋白1、2 表达,阻止溶酶体与自噬体结合,从而阻断自噬流[43]。Ding 等[22]研究发现,毛蕊异黄酮通过剂量依赖方式抑制肾系膜细胞ERK 的表达从而抑制自噬,发挥肾脏保护作用。JNK 信号通路主要是通过磷酸化B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2) 家族蛋白,使Baclin-1 从Bcl-2/Baclin-1 复合体中游离出来并与Vsp34、Atg14、p500 结合形成Ⅲ型PI3K 复合体,发挥促进自噬作用[44-45]。黄芪甲苷对JNK 通路有抑制作用,但目前研究仅限于凋亡、炎症相关疾病[46]。
3.3 AMPK 通路 AMPK 通路是细胞内生物能量调节的关键分子感受器[47],也是自噬的主要正调控因子。AMPK 通过磷酸化mTORC1、ULK1 和PI3K 复合物中的自噬相关蛋白直接促进自噬,或通过调节叉头盒状O 转录因子3(forkhead box O3,FOXO3a)、转录调节因子EB 等转录因子调节下游自噬相关基因的表达间接促进自噬[48]。AMPK的活性受其上游激酶,如钙/钙调蛋白依赖性蛋白激酶(calmodulin-dependent protein kinase kinase,CaMKK) 和肝激酶B1 (the liver kinase B1,LKB1) 的调节。LKB1/AMPK能量通路影响代谢应激过程中的增殖和凋亡,是自噬关键调节因子[49]。黄芪多糖对CaMKK 和LKB1 表达均有促进作用[50]。黄芪总皂苷能够通过激活LKB1/AMPK 通路诱导乳腺癌细胞自噬,抑制肿瘤细胞生长和迁徙[51]。此外,黄芪多糖还能够直接激活AMPK 诱导自噬,对脂多糖诱导的巨噬细胞炎症模型发挥抑制作用[52],从而保护过度运动诱发的心肌损伤[53]。然而,黄芪不同活性成分对于AMPK通路可产生不同的作用。例如,在慢性肾病小鼠模型中,毛蕊异黄酮能够抑制AMPK 和FOXO3a,从而下调LC3I/II和ATG7 的表达,减少自噬小体的形成,缓解骨骼肌萎缩[23]。
3.4 PINK1/Parkin 信号通路 线粒体在产生能量的同时也会生成并释放副产物活性氧类 (reactive oxygen species,ROS)[54],从而对细胞内大分子物质和线粒体造成损伤,受损的线粒体会产生更多的ROS。过量的ROS 会损伤细胞,也会触发线粒体自噬这一细胞自我保护机制,以清除受损的线粒体、降低ROS 水平并稳定细胞内线粒体的功能[55]。PTEN 诱导激酶1 (PTEN induced putative kinase1,PINK1) 和Parkin 蛋白是调控线粒体自噬的特异性蛋白。PINK1 能够识别并聚集在受损伤线粒体外膜[56],Parkin 则能够促进线粒体外膜蛋白的泛素化,泛素化的线粒体可在多种自噬受体调节蛋白及LC3 协助下移动到自噬囊泡。在不同疾病中,黄芪甲苷对PINK1/Parkin 通路可表现出不同的调控作用,在5-氟尿嘧啶诱导的小鼠心肌损伤模型中,过度的自噬导致细胞死亡和心肌受损,黄芪甲苷可降低PINK1/Parkin 信号通路蛋白表达,从而抑制线粒体自噬水平,发挥心肌细胞保护作用[57]; 在心肌再灌注损伤模型中,黄芪甲苷亦可下调PINK1 和Parkin 的表达,抑制过度线粒体自噬,而且呈剂量依赖性[25,58]。同时也有研究发现黄芪甲苷也能够激活该通路发挥细胞保护作用。在蓝光诱导损伤的视网膜色素上皮细胞中,黄芪甲苷可通过上调细胞PINK1/Parkin 信号通路,抑制细胞产生大量ROS,缓解细胞线粒体损伤和细胞凋亡,维持细胞活力和自噬过程[59]。Su 等[15]的研究也发现,黄芪甲苷能够促进核因子E2 相关因子2 和KELCH 样ECH 关联蛋白1 的解离,上调PINK1 诱导的线粒体自噬,发挥对糖尿病大鼠的肾脏的保护作用。
3.5 其他通路 缺氧诱导因子-1 (hypoxia induciblef actor1,HIF-1) /BCL2 反应蛋白 3 ( BCL2 interacting protein3,BNIP3,BNIP3) 通路属于非典型的自噬调节通路。HIF-1 诱导BNIP3 基因表达,BNIP3 与Beclin-1 竞争结合BCL2,然后通过从BCL2 释放Beclin-1 而诱导自噬[60]。激素所致股骨头坏死模型中,黄芪多糖通过下调microRNA-206,靶向增加HIF-1α 进而诱导BNIP3 表达增加,促进细胞自噬和抑制细胞凋亡,有效改善激素性股骨头坏死[61]。
Kruppel 样因子2 (Kruppel-like factor 2,KLF2) /混交激酶域蛋白(mixed lineage kinase domain-like,MLKL) 是新的自噬调节通路。磷酸化的MLKL 能够被转运到质膜上,增加其通透性,导致溶酶体功能下降[62]。KLF2 和自噬相关分子(beclin、ATG7 等) 的变化呈正相关[63]。Ma 等[64]研究表明,KLF2 是MLKL 的负调控因子,而毛蕊异黄酮能上调KLF2-MLKL 介导的自噬,显著抑制动脉粥样硬化的形成。
沉默信息调节因子2 相关酶1 (silent information regulator factor 2 related enzyme 1,SIRT1) 是细胞中具有脱乙酰化功能的蛋白,有研究表明SIRT1 通过促进细胞核LC3 的脱乙酰化从而上调饥饿诱导的自噬[65]。Wang 等[66]发现,黄芪甲苷可增加SIRT1 的表达,激活自噬和NF-κB途径,抑制葡萄糖诱导的足细胞上皮-间充质转化,改善肾功能,但这一作用可被SIRT1 抑制剂逆转。
4 结语和展望
众多研究表明,黄芪可通过调控自噬发挥抗炎、抗凋亡等保护性作用,进而缓解多种疾病,如癌症、糖尿病及心肌损伤的发生发展。该药是通过直接或间接作用于PI3K/AKT、AMPK、MAPK、PINK1/Parkin 等多条信号通路来调控细胞自噬水平,调节机制见图1。与其他自噬调节剂如雷帕霉素、3-甲基腺嘌呤等不同的是,黄芪对细胞自噬的调节具有两重性,其对自噬的抑制或促进作用可能与其活性成分、使用剂量、靶细胞的浓度以及细胞本身的病理生理条件有关。因此,未来的研究中还需要深入挖掘黄芪及其活性成分双向调节自噬的具体机制,了解不同机制之间的潜在相互影响,从而阐明影响黄芪自噬双重调节的因素,为其临床治疗的应用提供理论依据。
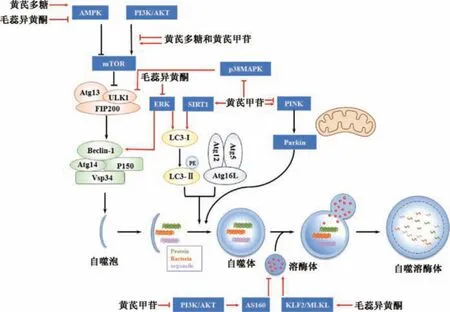
图1 黄芪调控细胞自噬的分子机制
