川芎中苯酞类成分药理作用及药动学研究进展
2024-03-10李字棋刘日群刘小金张国松王文茜胡鹏翼
李字棋,刘日群,刘小金,郑 琴,张国松,王文茜,胡鹏翼
(江西中医药大学,现代中药制剂教育部重点实验室,创新药物与高效节能降耗制药设备国家重点实验室,江西 南昌 330004)
川芎为伞形科植物川芎的干燥根茎,《神农本草经》中将其列为上品,记载“主中风入脑头痛,寒痹,筋挛缓急,金创,妇女闭血无子”,目前我国临床上常用于治疗偏头痛、心脑血管疾病[1]。川芎化学成分的研究始于20 世纪80 年代,苯酞类化合物作为川芎挥发油的主要成分,截止到2021 年大约已分离出70 多个,可分为单苯酞和二聚体苯酞2 类[2]。现代药理研究发现,川芎苯酞类成分具有治疗心脑血管疾病、抗炎、镇痛等多种药理作用[3]。川芎苯酞类成分中Z-藁本内酯(Z-LIG) 含量最高,其次是洋川芎内酯类化合物(A、I、H)、3-丁烯基苯酞(BP) 和正丁基苯酞(NBP)。基于此,本文对川芎主要苯酞类成分化学结构、药理作用、相关作用机制及其药动学进行综述,以期为该类成分的进一步开发利用提供一定参考。
1 化学结构
苯酞类化合物是邻羟甲基苯甲酸中的羟基和羧基之间发生分子内酰化反应形成苯并五元内酯环的芳香醇类化合物,主要分为以下2 类[4]。
1.1 单苯酞类 单苯酞类含一个苯酞结构母核,大部分是油状物,分为简单苯酞类和羟基苯酞类。简单苯酞类结构中无含氧取代基,主要差异为六元环的饱和程度和侧链的构型[4]。1963 年,日本学者首次从川芎中分离出蛇床内酯、新蛇床内酯(NOL)、Z-LIG 3 种化合物。目前,从川芎中提取出的简单苯酞类有7 个,分别为E-藁本内酯、ZLIG、洋川芎内酯A (SEA)、NBP、BP、NOL、蛇床内酯[5],结构见图1。
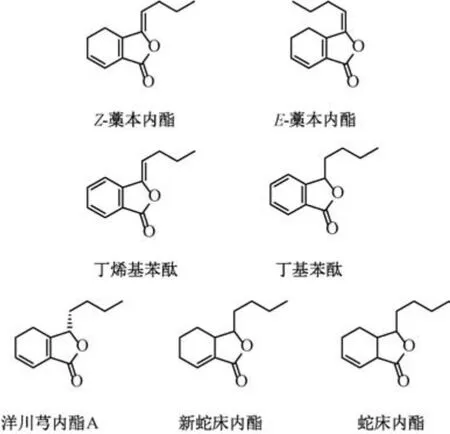
图1 川芎中简单苯酞类成分结构
羟基苯酞类是简单苯酞类衍生物,六元环或者侧链上连有羟基、羰基、氯原子。目前,从川芎中分离鉴定的羟基苯酞类有35 个,包括4-羟基-3-丁基苯酞、4,7-二羟基-3-丁基苯酞、Z-4,5-二羟基-3-丁烯基苯酞、洋川芎内酯B~J、E-洋川芎内酯E、洋川芎内酯L、洋川芎内酯N、Z-7-羟基-3-丁烯基苯酞、洋川芎内酯K、洋川芎内酯M、洋川芎内酯Q、2- (1-oxopentyl) -benzoic acid methyl ester、洋川芎内酯R、洋川芎内酯S、4,5-二氢-3,1′-二羟基-3-戊基苯酞、chuanxiongnolide R1、chuanxiongnolide R2、(6S,7S) -3-丁基-3,6,7-四羟基-4,5,6,7- 四氢苯酞、(6R,7R) -3-丁基-3,6,7-四羟基-4,5,6,7-四氢苯酞、Z-6,7-epoxyligustilide、chuanxiongins A~F、藁本内酯苷A[5]。
1.2 二聚苯酞类 二聚苯酞是一类单本酞的二聚物,大多数为晶状体,通过环加成、狄尔斯-阿尔德等反应生成[4]。目前,从川芎中分离鉴定的二聚苯酞化合物有25 个,包括Z-6,8′,7,3′-二聚藁本内酯、欧当归内酯A、Z′-3,8-二氢-6,6′,7,3′a-二聚藁本内酯、Z′-4,5-二氢-3,3a′,8,6′-二聚藁本内酯、tokinolide B、riligustilide、洋川芎内酯O、洋川芎内酯P、wallichilide、3′,6,8′,3a-二聚藁本内酯、chuanxiongdiolide R1、chuanxiongdiolide R2、chuanxiongnolide A、chuanxiongnolideB、chuanxiongnolideL1~L5、ansaspirolide、chuanxiongdiolide A、chuanxiongdiolide B、angelicide、Z-ligustilide dimmer E-232、Z,Z′-3,3′,8,8′-diligustilide[5]。
2 药理作用
2.1 抗脑缺血 NBP 是2004 年经国家食品药品监督管理局批准上市,用于治疗缺血性脑卒中的药物[6]。除NBP外,其他苯酞类成分也具有潜在抗脑缺血作用。鼻内给药Z-LIG 可以保护大鼠短暂性大脑中动脉闭塞(MCAO) 引起的脑损伤,减少脑梗死体积,改善大鼠中风模型的神经功能、血脑屏障破坏和脑水肿; 体外能够增强受氧葡萄糖剥夺-复氧(OGD/R) 损伤的PC12 细胞的活力,同时减少细胞凋亡和细胞坏死,其机制可能是通过激活丝裂原活化蛋白激酶 (MAPK) 途径诱导保护性热休克蛋白70(HSP70) 表达,核因子E2 相关因子2 (Nrf2) 和HSP70细胞应激反应通路在Z-LIG 对缺血性损伤的保护中也起重要作用[7-8];Z-LIG 还可通过苷激酶B1-单磷酸腺苷活化蛋白激酶-雷帕霉素靶蛋白(LKB1-AMPK-mTOR) 信号通路促进自噬,并保护PC12 细胞免受OGD/R 诱导的凋亡[9]。Z-LIG 能够通过缺氧诱导因子1a (HIF-1a) /血管内皮生长因子通路及水通道蛋白-4 (AQP-4) 降低OGD 诱导的体外血脑屏障通透性[10];Z-LIG、洋川芎内酯A (SEA) 和洋川芎内酯I (SEI) 能够显著上调紧密连接蛋白claudin-5 蛋白和occludin 蛋白的表达,抑制OGD/R 的MDCK-MDR1 细胞损伤,降低OGD/R 诱导的体外血脑屏障通透性[11],从而改善脑缺血。SEH 显著降低MCAO 小鼠的神经评分、梗死体积和神经元死亡,并显著降低OGD/R 诱导的PC12 细胞死亡,可能机制为通过激活磷酸肌醇3-激酶(PI3K) /蛋白激酶B (AKT) /核因子kappaB (NF-Kb) 信号通路来抑制炎症因子释放,提高抗凋亡能力[12]; 另外SEH 也可通过环磷酸腺苷 (cAMP) -PI3K/AKT 信号通路,改善OGD/R 诱导的PC12 细胞损伤[13]。Zeng 等[14]采用永久性单侧颈总动脉结扎法建立小鼠全脑缺血模型,川芎经灌胃治疗7 天后,NOL 能有效改善脑缺血损伤。
2.2 神经保护 苯酞类成分通过不同通路对神经细胞发挥保护作用。Z-LIG 具有减轻脑梗死体积、神经损伤以及保护受损海马神经元作用,其机制可能与激活PI3K/Akt 通路、减轻缺血再灌注诱导的海马神经元凋亡有关[15]。ZLIG 对慢性脑低灌注大鼠模型有明显的神经保护作用,其机制与抗永久性双侧颈总动脉闭塞鼠皮质和海马神经元细胞凋亡及星形胶质细胞增殖有关[16]。Z-LIG 显著改善AD双转基因 (APP/PS1) 小鼠记忆障碍、淀粉样蛋白-β(Aβ) 水平和斑块负担,Z-LIG 对AD 的神经保护作用可能与APP 和Klotho 的α 加工和潜在的Aβ 清除有关[17]。还有研究表明,Z-LIG 对脑缺血损伤的神经保护作用与Klotho上调有关[18]。
有研究提出,脑中风后能够通过促进缺血区的血管生成和改善脑血管功能来减轻缺血性损伤[19]。Ren 等[20]研究发现,Z-LIG 经VEGF-eNOS 信号通路对缺血性中风引起的损伤神经发挥保护作用。Z-LIG 和SEH 通过抑制Prx1 (过氧化还原蛋白1) /TLR4/NF-kB 信号传导和随后的免疫、神经炎症损伤,对出血性中风提供有效的神经保护[21]。SEI 上调磷酸化细胞外调节激酶1/2 (p-Erk1/2)、核因子红系2 相关因子2/血氧合酶-1 (Nrf2/HO-1)、抑制半胱氨酰天冬氨酸特异性蛋白酶3 (caspase 3) 的表达,通过抗氧化和抗凋亡作用改善神经功能缺陷,减少梗死体积和脑水肿,发挥神经保护作用[22]。Luo 等[23]建立1-甲基-4 苯基吡啶(MPP+) 诱导大鼠肾上腺嗜铬细胞瘤细胞系(PC12细胞) 损伤体外模型,发现SEH 显著降低了神经毒性和细胞凋亡,其可能机制是SEH 通过活性氧(ROS) 介导的丝裂原活化蛋白激酶(MAPKA) 途径发挥神经保护作用。Wang 等[24]研究发现,SEI 对小鼠神经母细胞瘤(Neuro2a)细胞中谷氨酸诱导的细胞死亡具有保护作用,其可能机制是通过减弱JNK/Caspase-3 活化和细胞凋亡。
2.3 抗炎 研究发现,川芎能显示出较好的抗炎效果[25]。Schwager 等[26]发现,Z-LIG 经NF-κB 通路抑制小鼠巨噬细胞(RAW264.7 细胞) 中一氧化氮(NO) 和PGE2 的产生,发挥抗前列腺炎症作用。
马宁宁等[27]研究发现,川芎中SEA、Z-LIG 和NOL 有抗炎作用,抗炎机制可能通过阻碍炎症信号传递,影响下游蛋白表达。LIG 还可有效抑制Prx1、Prx2、Prx4 诱导的炎症反应[28]。KN 等[29]研究发现,BP 可以通过抑制大鼠脑小胶质细胞的NO、TNF-α、白细胞介素-1b 等促炎分子的释放,从而发挥抗炎的作用。Shao 等[30]利用雄性C57BL/6 小鼠建立体内骨关节炎模型,腹腔注射SEA 后,抑制Nod 样受体蛋白3 (NLRP3) 信号通路缓解骨关节炎。Huang 等[31]研究发现,川芎中SEI、SEH、NBP 分别能够抑制18.28%、17.69%、13.58% NO 的产生从而发挥抗炎作用。Zha 等[32]研究发现,SEI 对盲肠结扎和穿刺(CLP)小鼠模型中脓毒症引起的肺损伤具有抗炎作用,其可能的抗炎机制是抑制中性粒细胞胞外陷阱的形成。
2.4 抗氧化 王敏等[33]建立人神经母细胞瘤细胞系(SHSY5Y) OGD/R 模型,结果发现,SEI、Z-LIG 对细胞内ROS 水平、LDH 活力及细胞存活率具有一定的改善作用。Yang[34]等发现,SEI 对小鼠肝缺血再灌注损伤(I/R) 有潜在保护作用,体内,降低MDA 含量,提高HO-I 水平、SOD 和谷胱甘肽过氧化物酶 (GSH-Px) 活性; 体外,H2O2降低受SEI 给药保护的人胆管癌HuCCT1 细胞(HuCCT1) 存活率及ROS、MDA 水平; Nrf-2 向细胞核的转运增强,HO-1 表达上调。Z-LIG 通过toll 样受体4(TLR4) /髓样分化因子88 (MyD88) /NF-κB P65 信号通路改善博来霉素诱导的PF (肺纤维化),改善通气,减少成纤维细胞并少氧化应激和凋亡[35]。
2.5 抗肿瘤 研究发现,川芎中苯酞类、丁基苯酞衍生物对人细胞肺癌细胞系H460、人肝癌细胞系SMMC7721 细胞和人胃癌细胞系BGC823 有细胞毒性,SEA、NBP、SEH、Z-LIG 能明显抑制癌细胞的迁移和侵袭[36]。Wang 等[37]研究发现,Z-LIG 能选择性抗破坏性血液系统恶性肿瘤急性髓性白血病(AML) 活性及核受体(Nur77/NOR-1) 介导的细胞凋亡和分化。具体见表1。

表1 川芎苯酞类成分药理作用
3 药动学
3.1 吸收 SEA 口服、静脉、腹腔给药后被迅速吸收,在15 min 内就能达到峰时间,但口服生物利用度极低,只有8%。于泽等[38]建立大鼠在体单向灌流模型,利用HPLC 测定灌流液中SEI 含量,结果发现,SEI 在各肠道均有很好的吸收,而且在选定剂量范围内呈线性动力学过程,提示吸收可能以被动转运为主。
3.2 分布 大鼠口服SEI 后可通过血脑屏障,并广泛分布在大鼠的组织中,其曲线下面积依次为肾>肝>肺>肌肉>脑>心>胸腺>脾[39]。
3.3 代谢 Tao 等[40]探讨了Z-LIG 的体外代谢特征,研究发现LIG 在大鼠和人类肝细胞(37 ℃) 培养中表现出快速代谢和较高的内在清除率,半衰期分别是8、15 min,SEI是主要代谢产物; 藁本内酯的代谢途径包括环氧化、环氧化物水解、谷胱甘肽化、羟基化和芳构化。SEA 体外肝细胞半衰期依次为狗<猴<大鼠<小鼠<人,并鉴定出了14 种代谢物,分析出代谢途径为羟基化、环氧化、芳构化和谷胱甘肽(GSH) 结合[41]。大鼠灌胃100 mg/kg SEI 后,从胆汁中分离出SEI-6S-O-β-D-glucuronide (M1)、SEI-7S-O-β-D-glucuronide (M2)、SEI-7S-S-谷胱甘肽(M3) 和SEI-7RS-谷胱甘肽(M4) 4 种代谢物,并且SEI 的主要代谢途径是葡糖苷酸和谷胱甘肽共轭,在谷胱甘肽共轭过程中,第7位的构型可以反转[42]。SEI 在狗体内半衰期较短,口服生物利用度大于40%; 1~50 mg/kg 剂量范围内,血浆中显示出与剂量无关的药动学特征。
3.4 排泄 马聪等[43]测定了SEI 经过灌胃给药和尾静脉注射给药后的尿液、胆汁排泄动力学,研究发现SEI 在两者中排泄量少,累积排泄率<4%,给药后2 h 在胆汁中达到总排泄量的87%,表明药物体内消除速度较快。
4 结语与展望
川芎中苯酞类化合物不稳定,容易受温度、光照等因素的影响,因此导致苯酞类化合物结构的多样性,包括单苯酞类和二聚苯酞类,且每类均有数十种化合物被发现。药理作用、药动学等研究报道较多的为川芎单苯酞类成分,如藁本内酯、洋川芎内酯A、洋川芎内酯I 等。目前,川芎苯酞类成分的药理作用研究主要集中在心脑血管疾病、神经系统类、抗炎、抗氧化、抗菌和抗虫、抗肿瘤方面,并深入研究了这些药理作用的相关作用机制,为川芎苯酞类成分的进一步开发研究奠定了较好的基础。其中,川芎苯酞类成分在抗心脑血管疾病方面研究报道较多,同时其作用靶点和通路被发现的较多,但除正丁基苯酞外基本处于实验阶段,未进入临床。对于其他药理作用的研究,大部分还只是处于探究相关蛋白及相关调控因子的表达上。这些研究还大多停留在某个或几个信号通路及药效层面,没有全面系统的深入研究其作用机制与相关作用靶点的联系。药动学研究方面,川芎苯酞类中主要为藁本内酯、洋川芎内酯类化合物,其他苯酞类化合物研究报道较少,其特点均为吸收快、体内广泛分布、首过效应大、口服生物利用度低,这些可能制约其临床应用,可以考虑制备新剂型,如脂质体、纳米粒等。期望未来能够在此基础上,采用网络药理学和分子对接、生物信息学分析,多组分分析等相关技术全面深入的对川芎苯酞类的作用机制进行分子机制、基因以及信号通路等层面的整体分析,以便拓宽川芎苯酞类成分的临床上的运用。同时,药理作用与药动学研究同时进行,构建药效-药物代谢动力学模型,确定给药方案-血药浓度-药物效应三者之间的关系,为今后的药物发现和制剂开发提供参考。
