人参皂苷Re 与5 种环糊精主客体包合过程研究
2024-03-10赵鸿双吴天元陆勃帆
王 伟,赵鸿双,吴天元,李 铮,陆勃帆,李 慧,吴 巍
(长春中医药大学,吉林省人参科学研究院,吉林 长春 130117)
人参皂苷Re 是原人参三醇型单体皂苷之一[1],在抗心律失常、抗休克、抗血小板凝集方面具有很好的药理活性[2-3],但该成分水溶性较差,导致其生物利用度低,从而限制临床发展及新药开发[4]。包合技术是提高难溶性药物溶解度和生物利用度的方法,在药学领域应用广泛[5-7],药物被环糊精包合后溶解性和生物利用度均能明显改善,广泛应用于口服、注射原料药[8-10]。
课题组前期曾选择贝塔环糊精作为载体,制备人参皂苷Re 超分子包合物,发现原料药生物利用度显著提高。本实验研究阿尔法环糊精、贝塔环糊精、伽马环糊精、羟丙基贝塔环糊精、羟丙基伽马环糊精对人参皂苷Re 的包合作用,探讨其包合机制[11-12],并结合相溶解度法进行验证[13-15],以期为人参皂苷Re 临床应用提供基础,并为相关超分子药物定量构效关系的探讨提供参考依据[16-17]。
1 材料
Agilent 1200 高效液相色谱仪 (美国Agilent公司); SHZ-82 恒温水浴振荡锅(金坛市盛威实验仪器厂)。人参皂苷Re 对照品(上海源叶生物科技有限公司,纯度>98%)。阿尔法环糊精(相对分子质量972.84)、贝塔环糊精(相对分子质量1 134.98)、伽马环糊精 (相对分子质量1 297.12)、羟丙基贝塔环糊精 (相对分子质量1 541.54)、羟丙基伽马环糊精 (相对分子质量1 741) 均购自上海麦克林生化科技有限公司。乙腈、甲醇均为色谱纯(美国Fisher 公司); 其余试剂均为分析纯; 水为超纯水。
2 方法
2.1 分子构建及结构优化 各环糊精结构分别获得于剑桥晶体数据库[www.ccdc.cam.ac.uk/structures/,阿尔法环糊精(1100537)、贝塔环糊精(181781) 和伽马环糊精 (1978774)] 和ChemSpider 数据库 [www.chemspider.com,羟丙基贝塔环糊精(128446-35-5) 和羟丙基伽马环糊精(128449-34-4)]。采用Chemdraw 20.0 软件绘制人参皂苷Re 结构,将其保存为“.mol” 格式,Chemdraw 3D 保存最优构象。
2.2 量化计算法(Gaussian) 研究主客体形成的热力学参数 PM3 方法考虑了非键合原子之间的相互作用力,在研究超分子(比如环糊精分子)时可得到比较稳定的计算结果,并且B3LYP/6-31G (d) 方法在药物小分子的计算方面有较高的精确度。因此,本研究采用Gaussian06 软件包中的ONIOM (B3LYP /6-31G*: PM3) 分层算法对取代环糊精体系的包合反应进行模拟,即主体分子的5种环糊精采用PM3 算法,包合过程则采用B3LYP/6-31G*算法。
2.3 分子动力学模拟(MD) 主客体包合过程MD 以能量最小化处理后的结构为初始结构,利用Materials Studio 2020 (美国Accelrys 公司) 模块Amorphous Cell 中的Construction 建立人参皂苷Re、环糊精分子晶胞,cell 为周期性边界条件,盒子尺寸19.5 cm×19.5 cm×19.5 cm,设置比例为1 ∶1,密度为1 g/cm3,为了区别主体分子环糊精和客体分子人参皂苷Re,前者以线状模型表示,后者以球状模型表示。建立晶胞后,采用Forcite 对其进行能量最小化处理,再以其包含的Dynamics 模块进行恒温恒容(NVT) 模拟,当体系能量稳定后进行恒温恒压(NPT) 模拟,条件为Compass 力场,温度298、310 K,时间步长1 fs,其中NVT为50 ps,NPT 为1 000 ps,压力为1.0×10-4GP。
2.4 人参皂苷Re 相溶解度测定 精密称取各环糊精适量,分别制成浓度为5 ~100 mmol/L 的阿尔法环糊精、伽马环糊精、羟丙基贝塔环糊精、羟丙基伽马环糊精溶液,以及浓度为1~10 mmol/L 的贝塔环糊精溶液,加入过量人参皂苷Re,分别在25、37° C 下水浴振荡72 h,吸取0.8 mL,过滤,加500 μL 甲醇,混匀后再过滤,采用HPLC 法测定人参皂苷Re 含量。分析条件为Ascentis ® Express C18色谱柱(5 cm×3.0 mm,2.7 μm); 流动相乙腈-水 (15 ∶ 85); 体积流量1 mL/min; 柱温30 ℃; 检测波长203 nm; 进样量5 μL。
3 结果
3.1 主客体分子包合过程模拟 首先,采用B3LYP/6-31G (d) 算法对5 种主体分子结构进行优化,使其无虚频,获得主体分析最优构象。再采用PM3 算法计算环糊精、人参皂苷Re 结合能,获得两者结合的热力学参数,结果见表1。
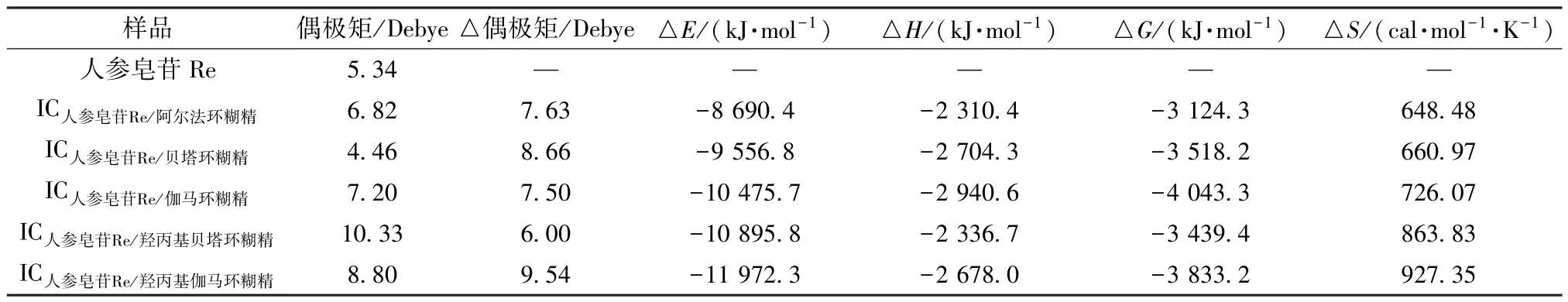
表1 人参皂苷Re 与包合物的热力学参数Tab.1 Thermodynamic parameters for ginsenoside Re and inclusion compounds
由此可知,各环糊精形成包合物后偶极矩均发生变化,具有不同于主-客体的新型结构形式,越稳定的包合物具有越大的负结合能(△E),而包合物的焓变值(△H) 均为负值,表明主客体形成包合物的过程均为吸热过程; 熵值(△S) 为正值,表明在包合过程中体系的混乱程度增加; 各包合物吉布斯自由能(△G) 也均为负值,表明人参皂苷Re 与环糊精的包合过程均为自发反应,即包合物形成的驱动力来源于焓熵协同驱动力。另外,人参皂苷Re 与伽马环糊精结合的△G、△H绝对值最大,表明反应最容易,即人参皂苷Re 与5 种主体分子反应的难易程度依次为IC人参皂苷Re/伽马环糊精>IC人参皂苷Re/贝塔环糊精>IC人参皂苷Re/羟丙基伽马环糊精>IC人参皂苷Re/羟丙基贝塔环糊精>IC人参皂苷Re/阿尔法环糊精。
人参皂苷Re 与5 种环糊精结合的最优构象见图1。由此可知,人参皂苷Re 与阿尔法环糊精结合的最稳定构象是将前者悬于后者大口端上方,只有部分存在于前者C6 位葡萄糖残基上的羟基能插入后者孔径中(图1A); 人参皂苷Re 与受体分子贝塔环糊精结合时,前者贯穿于后者中,并且也是前者C6 位的葡萄糖残基插入后者空腔中 (图1B); 伽马环糊精孔径比贝塔环糊精更大(0.75 ~0.83 nm),使得人参皂苷Re 可贯穿于空腔内,导致进一步紧密的结合(图1C); 羟丙基贝塔环糊精、羟丙基伽马环糊精由于羟基被取代成羟丙基,客体分子进入空间内的位阻增加,导致人参皂苷Re 与其结合不紧密,仅是浮于环糊精上方,而且两者中的羟丙基衍生基团虽然提高了溶解度,但也增加了配体分子的空间位阻,使其入环的阻力增加(图1D、1E)。综上所述,在与不同环糊精分子的结合过程中,人参皂苷Re 均从其大口端向小口端进入,其中贝塔环糊精和伽马环糊精能将该成分包裹于空腔中,而其他3 种环糊精只能与其形成部分包合物; 伽马环糊精能将该成分包裹于空腔中,表明疏水作用力也是两者包合的主要作用力,可能也是其相溶解度较大的主要原因。

图1 人参皂苷Re 与环糊精结合的最稳定构象Fig.1 The most stable conformations of ginsenoside Re combined with cyclodextrins
3.2 主客体包合驱动力研究 将优化后的配体分子人参皂苷Re 分别与不同受体分子环糊精置于晶胞内,设置晶胞尺寸为3.13 nm,每个晶胞内分别置入7 个受体分子、7 个配体分子。以伽马环糊精与人参皂苷Re 的结合为例,晶胞见图2A,包合过程中能量变化及分布见图2B。

图2 伽马环糊精与人参皂苷Re 建立的晶胞(A) 及恒温恒压模拟的能量分布(B)Fig.2 Unit cell established by gamma-cyclodextrin and ginsenoside Re (A) and energy distribution under constant temperature and constant pressure simulation (B)
由图2B 可知,伽马环糊精与人参皂苷Re 结合时的势能大于非键能曲线,后者包括氢键作用力、疏水作用力、静电作用等,即两者结合时势能大于氢键作用、疏水作用之和。再分别计算配体分子人参皂苷Re 与受体分子在25、37 ℃下势能、非键能、结合的总能量[18-20],发现人参皂苷Re 在环糊精结合时的主要作用力均为势能,属于分子间作用力,即为包合过程的驱动力[21-23]。
3.3 相溶解度图绘制及参数计算 为了验证分子动力学计算结果,测定客体分子人参皂苷Re 在环糊精中的相溶解度,在203 nm 波长处测定吸光度。以人参皂苷Re 质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,得方程为Y=8 090.4X-1 190.1 (r=0.999 5),在0.10~20 mg/mL 范围内线性关系良好。取不同质量浓度人参皂苷Re 溶液适量,进样分析,测得日内、日间峰面积RSD 均小于1%,表明该方法精密度良好。同一溶液在室温下于0、6、12、24、48 取样测定,测得峰面积RSD<1%,表明溶液在48 h 内稳定性良好。再以环糊精浓度为横坐标,人参皂苷Re 浓度为纵坐标绘制相溶解度曲线,见图3。

图3 人参皂苷Re 与环糊精的相溶解度曲线Fig.3 Phase solubility curves for ginsenoside Re and cyclodextrins
由此可知,随着环糊精浓度增加,人参皂苷Re 浓度升高,主体分子与人参皂苷Re 之间的包合比例为1 ∶1,均属于AL型[12-15]。根据公式Ks=Slope/S0(1-Slope) 计算环糊精与人参皂苷Re 的包合常数,其中S0表示水中不含环糊精时的人参皂苷Re 溶解度(在25、37 ℃下分别为0.426、0.517 mmol/L),再根据Ks计算吉布斯自由能ΔG,公式为ΔG=-RTlnKs(R=8.314 J/mol,T=t+273,t分别为25、37 ℃),见表2。
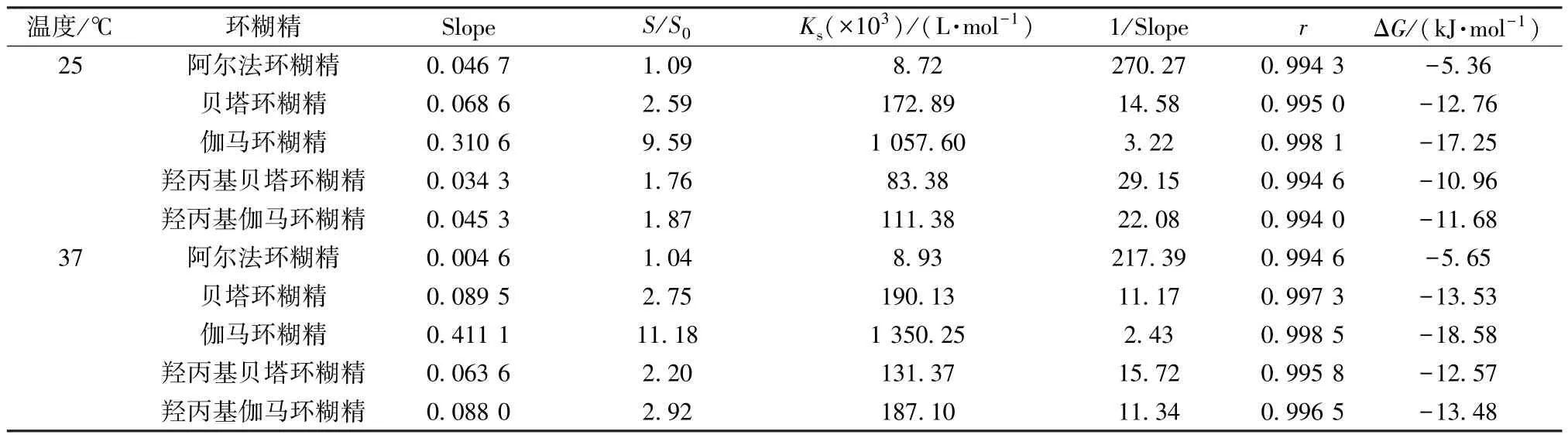
表2 人参皂苷Re 相溶解度参数Tab.2 Phase solubility parameters for ginsenoside Re
结果显示,在不同温度下各环糊精对人参皂苷Re 的相溶解度趋势一致,均依次为伽马环糊精>贝塔环糊精>羟丙基伽马环糊精>羟丙基贝塔环糊精>阿尔法环糊精,即伽马环糊精对该成分的包合效果最好; 贝塔环糊精对人参皂苷Re 的相溶解度低于伽马环糊精,但高于羟丙基贝塔环糊精; 虽然羟丙基贝塔环糊精和羟丙基伽马环糊精在结构上均有亲水的结构羟丙基,但对该成分的包合作用并没有增加。对比图1 可知,由于受到羟丙基空间位阻的影响,阻止了人参皂苷Re 在空腔内的嵌合,故羟丙基贝塔环糊精对该成分的包合能力变差,进一步印证了理论计算结果与实验测定结果的一致性。
另外,阿尔法环糊精、贝塔环糊精在37 ℃下相溶解度分别是在25 ℃下的1.02、1.09 倍,而羟丙基贝塔环糊精、羟丙基伽马环糊精分别增加至1.57、1.68 倍,表明升高包合反应温度有利于包合过程,与理论计算结果一致。
4 讨论与结论
5 种主体分子环糊精均可与人参皂苷Re 自发形成包合过程,并且温度升高有利于包合反应形成,其中伽马环糊精、贝塔环糊精的包合能力更强,是理想的包合材料,而溶解度更好的羟丙基伽马环糊精、羟丙基贝塔环糊精由于空间位阻的影响导致包合能力降低。本实验采用ONIOM 分层算法优化主客体分子的包合过程,既保持了量子力学中从头计算方法在性质预测和反应计算中的可靠性,又具备了分子力学在大分子体系中计算快速的特性,所得结果与实际检测情况一致,表明可通过Gaussian 计算方法来对包合过程反应趋势和包合能力进行预测。
综上所述,本实验采用理论计算结合实验研究来对人参皂苷Re 与5 种常见环糊精的包合过程进行考察,获得清晰的主-客体包合模式,并分别在理论和实验层面阐述伽马环糊精改善人参皂苷Re水溶性、稳定性的优势,可为超分子药物定量构效关系的探讨提供理论依据和实验参考。
