紫纹兜兰的花形态和双雄蕊花药发育及分类学意义
2024-03-10朱永黄家林陶凯锋王乐骋张锦李璐
朱永 黄家林 陶凯锋 王乐骋 张锦 李璐

摘 要: 兜蘭属的分类系统学争议较大,亟待更多资料澄清。该文利用体式解剖镜和石蜡切片技术观察了紫纹兜兰的花结构和双雄蕊花药发育特征。结果表明:(1)花形态特征支持将紫纹兜兰放置于兜兰亚属的单花斑叶组,包括萼片具脉纹、花瓣长圆形带黑褐斑,唇瓣具直立的耳状结构,退化雄蕊新月形等。(2)花药原基分化出一对侧生并列的药室,花药室中央分化出一条不完全贯穿的不育隔膜组织,将其分化为两个小孢子囊。在花药成熟时,不育隔膜组织被降解吸收,两个花粉囊通过次生融合形成一枚马鞍形的黏性花粉团。(3)发育完整的花药壁有4层,由外到内分别为表皮、药室内壁、中层和绒毡层,符合单子叶型花药壁。花药壁具绒毡层和内绒毡层,均为2核。在2-细胞花粉时期,中层和绒毡层发生降解,药室内壁发生纤维状加厚。(4)小孢子母细胞经同时型胞质分裂形成不同排列方式的小孢子四分体,包括正四面体、左右对称和十字交叉型,并且同一药室的小孢子母细胞减数分裂不同步现象明显。(5)在雄配子体发育阶段,小孢子或保持在四分体内或从四分体中游离出来,经有丝分裂发育为2-细胞型花粉,形成具有黏性的四合花粉或花粉粒。基于现有资料,该文比较分析了紫纹兜兰不完全贯穿的不育隔膜组织、单子叶型花药壁、具2核的绒毡层和内绒毡层、同时型胞质分裂和黏性花药等特征的分类学意义,为理解兜兰属及杓兰亚科的分类学和保护生物学提供新资料。
关键词: 兜兰属, 杓兰亚科, 花药壁发育, 小孢子发生, 雄配子体发育, 花粉散粉单元, 分类学
中图分类号: Q949.58
文献标识码: A
文章编号: 1000-3142(2024)01-0102-11
Floral morphology and anther development in diandrous
orchid Paphiopedilum purpuratum with
their taxonomic implications
ZHU Yong1, HUANG Jialin2, TAO Kaifeng1, WANG Yuecheng1, ZHANG Jin1, LI Lu1*
( 1. College of Biodiversity Conservation, Southwest Forestry University, Kunming 650224,
China; 2. Yuxi Normal University, Yuxi 653100, Yunnan, China )
Abstract: The taxonomy of Paphiopedilum Pfitz. has been disputed and needs more data for clarification. Floral morphology and anther development in P. purpuratum were observed using microscope and paraffin section. The results were as follows: (1) It was supported that P. purpuratum should be placed in Paphiopedilum subgenus Paphiopedilum sect. Barbata by some floral features, including a single flower, sepal white with veins, petal spotted with blackish-maroon, pouch of a lip auriculate on both sides, and a staminode lunate. (2) At the early stage, anther primordium developed into a pair of laterally juxtaposed thecae. An incomplete sterile septa was differentiated in the center of each theca, giving rise to two arc-shaped microsporangia. When anther split, the sterile septum was discomposed and degenerated resulting in a mass of sticky pollens from two pollen sacs were fused into a unit. (3) The developed anther wall consisted of an epidermis, an endothecium, a middle layer, and a tapetum, conforming to the monocotyledonous type. Both tapetum and the inner tapetum cells contained 2 nuclei. At the stage of 2-celled grains, degeneration occurred in the epidermis and tapetum layers, while the endothecium became thickened fibrously. (4) Microspore mother cells underwent a simultaneous cytokinesis resulting in microspore tetrads with varied arrangements of tetrahedral, isobilateral, and decussate types, and the meiotic activity of microspore mother cells in the same theca was obviously asynchronous and different meiosis phases could be observed. (5) Microspores produced 2-celled pollens via a mitosis, which could be retained in pollen tetrads or released as monad. Based on the data available, some key features are selected for taxonomy and conservation biology of Paphiopedilum in Cypripedioideae, including the differentiation of incomplete sterile septum, the monocotyledonous type of anther wall, the binucleated tapetum, differentiation of the inner tapetum, simultaneous cytokinesis, the sticky pollens, and so on. This study provides new information for taxonomy and conservation biology of Paphiopedilum, as well as of Cypripedioideae.
Key words: Paphiopedilum, Cypripedioideae, anther wall development, microsporogenesis, male gametogenesis, pollen dispersal unit, taxonomy
杓兰亚科(Cypripedioideae Lindl.)的花形态特征在兰科里较为独特,主要因其具有两枚可育雄蕊和花药开裂时散粉单元为黏性花粉,明显区别于其余4个亚科(Dressler, 1986; Kocyan & Endress, 2001; Singer et al., 2008)。作为兰科的基部类群,具有两枚可育雄蕊的杓兰亚科与具有三枚可育雄蕊的拟兰亚科(Apostasioideae Rchb.)的亲缘关系较近,包括5个属约180种,每个属都有独立而特定的地理分布(Dressler, 1986; Cox et al., 1997; Pridgeon et al., 1999)。除了南美洲特有的3个小属以外,其余2个属在我国均有分布,即杓兰属(Cypripedium L.)和兜兰属(Paphiopedilum Pfitz.)(Cribb, 1998; 郎楷永,1999; 刘仲健等,2009)。杓兰亚科具较高观赏价值(Cribb, 1998; 郎楷永,1999),其野生资源备受关注,国产兜兰属和杓兰属均被列入国家重点保护植物名录(国家林业和草原局 农业农村部,2021)。
长期以来,兜兰属的分类系统争议较大,问题主要集中在属下的亚属及其分组的处理。早期的分类系统根据唇瓣形态(Atwood, 1984; Cribb, 1987)和细胞学(Karasawa, 1980, 1982)将兜兰属分为2个亚属或6个亚屬。后来的研究认为该属应该划分为3个亚属(Cribb, 1998; Pridgeon et al., 1999),得到了分子系统学证据的支持(Cox et al., 1997; Chochai et al., 2012; Tsai et al., 2020),但现有中国兜兰属的分类系统仍旧采纳两个亚属的概念(郎楷永,1999; 刘仲健等,2009)亟待澄清。在重建兜兰属分类系统的资料中,叶面斑块的有无和唇瓣形态常被用作该属的物种鉴定依据(Cribb, 1998; Pridgeon et al., 1999; 郎楷永,1999;刘仲健等,2009),其余花结构的分类学价值极少受到关注。Cribb(1998)认为兜兰亚属(Paphiopedilum subgenus Paphiopedilum)的单花斑叶组(sect. Barbata)因普遍具有单花、唇瓣基部直立的耳状结构、叶片具明暗镶嵌的斑块等可用于该组的分类依据。它明显区别于多花无耳组(sect. Coryopedilum),后者普遍具数朵花组成的花序,唇瓣基部无耳状结构,叶片光滑净色无斑块。紫纹兜兰 [P. purpuratum (Lindl.) Stein]是中国兜兰属最早被引种栽培和命名发表的物种,模式标本产于我国的香港,在福建、广东、广西和云南以及境外的越南也有分布(刘仲健等,2009)。根据唇瓣小于中萼片的形态特征,紫纹兜兰被放置于兜兰亚属(Cribb, 1998; Pridgeon et al., 1999; 郎楷永,1999)。近年来的分子系统学进一步把它列入单花斑叶组(Cox et al., 1997; Chochai et al., 2012; Tsai et al., 2020),但是,关于它的形态学和花药发育特征的研究资料较少。
花形态和花药发育胚胎学特征在兰科分类系统学中发挥着重要作用,包括唇瓣与合蕊柱的形态、可育雄蕊和花药室的数目、花药壁发育类型、绒毡层特征、小孢子母细胞减数分裂类型、花药成熟时的散粉单元等(Burns & Bernhardt, 1985; Dressler, 1986, 1993; Johri et al., 1992; Johnson & Edwards, 2000; Harder & Johnson, 2008; 李璐,2023),但资料较少(Sood, 1989; 谭庆琴等,2020)。最新的兰科分类系统为理解5个亚科的花形态和胚胎学特征的分类系统学意义提供了基础框架(Chase et al., 2015)。现有兰科花药发育资料集中在具有3枚可育雄蕊的拟兰亚科(Apostasioiedeae)(Kocyan & Endress, 2001)、具有单雄蕊的兰亚科(Orchidoideae)(Swamy, 1946; Maheshwari & Narayanaswami, 1952; Kant & Bhanwra, 2010)和树兰亚科(Epidendroideae)(Bhanwra & Vij, 2003; Kant, 2019, 2023; 谭庆琴等,2020)。在具有双雄蕊的杓兰亚科中,杓兰属的花药发育过程研究资料较多(Swamy, 1949; Brown & Lemmon, 1996; Sood & Rao, 1988; Kant, 2011),但兜兰属的花药发育资料相对少见(Swamy, 1949; 任玲和王伏雄,1987),其余3个属的资料也较为匮乏(Johri et al., 1992; Cribb, 1998)。本研究利用体式解剖镜和石蜡切片技术,观察了紫纹兜兰的花结构和花药发育过程中的不育隔膜组织的分布和分化、花药壁类型、胞质分裂方式、花药形态等特征,结合现有资料,比较分析其分类学意义,为理解兜兰属及杓兰亚科的分类学和保护生物学提供新资料。
1 材料与方法
紫纹兜兰栽培于西南林业大学科研教学实习基地(云南丰春坊生物科技有限公司兰花资源圃),生长多年,正常开花。2017—2020年,连续4年采集不同发育时期的花蕾和开放花,取15朵左右新鲜开放花,在徕卡体式解剖镜(Leica M165 FC)下观察唇瓣、合蕊柱、花粉团等花结构的形态特征并拍照,其余材料固定在50%的酒精,24 h后转入70%的酒精常温保存。取固定后的材料,按发育形态分为3个阶段(幼嫩花蕾期、花蕾期、开花期),每个阶段取5~10朵。材料经酒精梯度脱水、二甲苯透明、浸蜡包埋,常规石蜡切片(Leica RM 2235,切片厚度为8 μm)。切片经烘干、脱蜡、复水、爱氏苏木精染色、中性树脂胶封片后,制成永久切片。切片在尼康显微镜(Nikon E100)下观察并拍照,利用图像编辑软件(Adobe Photoshop CS6)制作图版。兰科植物结构术语参考《中国兰科植物鉴别手册》(陈心启等,2009)。
2 结果与分析
2.1 花形态及解剖特征
紫纹兜兰具有以下典型的花结构特征(图版Ⅰ :1):单花,花葶长达30 cm以上;花大,深紫色,带明显条纹;中萼片白色、阔卵形,边缘外卷,顶部急剧变狭呈尖角;合萼片狭披针形,与子房并列向下生长;侧花瓣长圆形,具紫红色脉纹,边缘浅波状外卷;唇瓣深盔状,囊口方阔,前端无缺刻,两侧具一个直立的耳;基部的侧裂片向内卷,具疣状突起。解剖镜下,可观察到雄蕊和雌蕊仅在基部愈合为半生合蕊柱,呈扁平半圆柱形,分背腹面,密被紫色短柔毛;两侧各有1枚可育雄蕊,花丝肉质短粗;上部有独立生长的柱头和退化雄蕊,肉质扁平呈盾状,朝近轴面呈90°弯曲生长(图版Ⅰ :2-4)。退化雄蕊倒心形半月状(图版Ⅰ :2,3);柱头圆饼状,表面光滑,带3浅裂(图版Ⅰ :3-5)。花药发育早期,两枚可育雄蕊与柱头近等高(图版Ⅰ :5),可见花药由一对侧生花药室组成(图版Ⅰ :6),每个花药室顶部沿纵轴有一条浅槽(图版Ⅰ :5,6)。发育后期,花药室沿浅槽开裂(图版Ⅰ :7),露出表面光滑、呈弯曲棒状、粘成一团的花粉(图版Ⅰ :8)。
2.2 花药壁发育
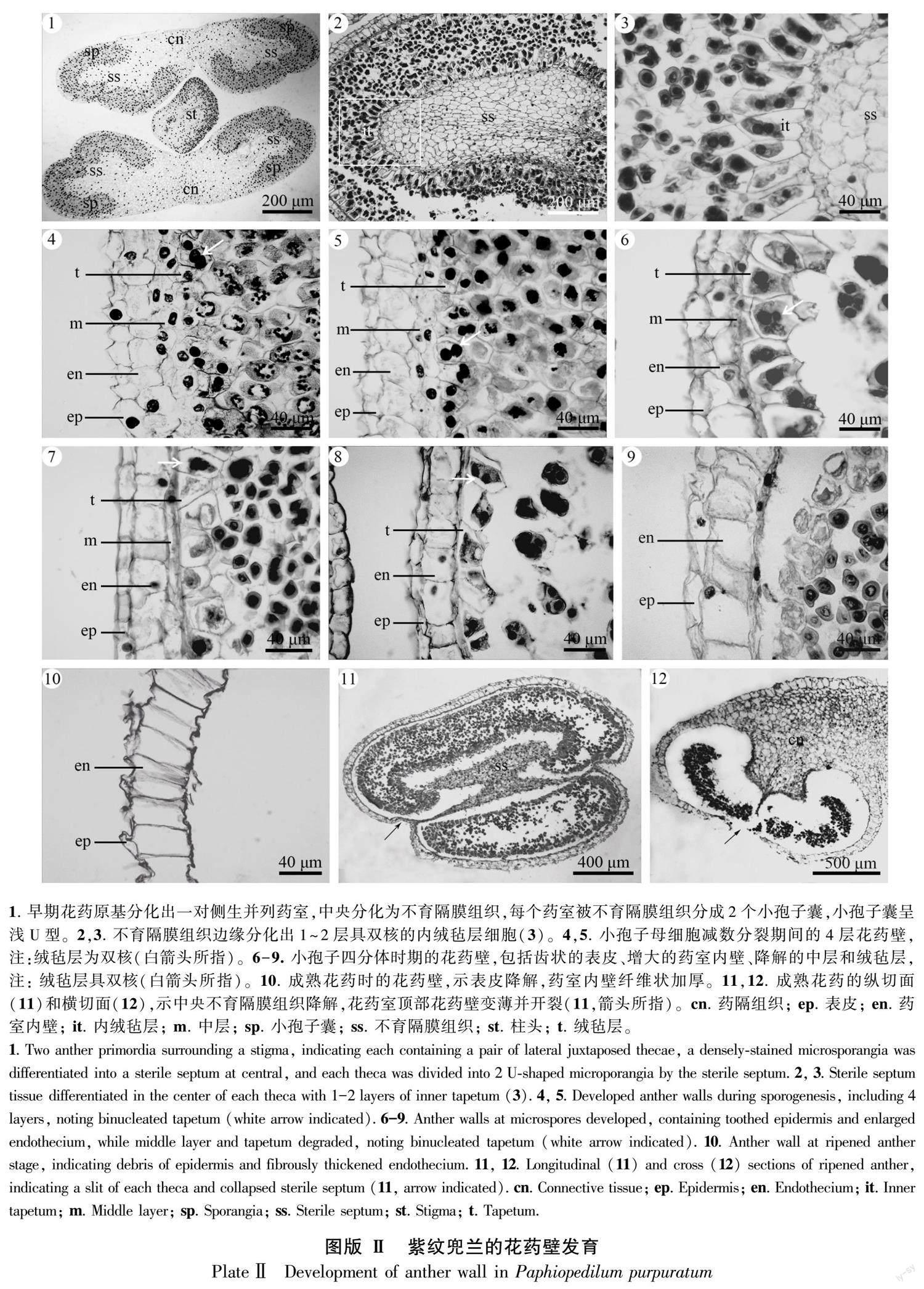
在早期花药的横切面上,可观察到合蕊柱基部两侧各有1枚可育雄蕊,其花药均由一对侧生花药室组成,朝近轴面弯曲生长,有围抱合蕊柱之势(图版Ⅱ :1)。每对花药室连接处的薄壁细胞染色较浅,具有明显的主维管束,构成一条较宽的药隔组织 (图版Ⅱ :1)。花药室中央有一团孢原细胞分化为染色较浅的薄壁细胞且未参与不育隔膜组织的形成,其中最外1~2层细胞径向伸长,发育为具有2核的内绒毡层(图版Ⅱ :2,3)。小孢子母细胞时期,花药室表皮下的一个孢原细胞经2次平周分裂形成了具有4层细胞的成熟花药壁,由外至内分别为表皮、药室内壁、中层和绒毡层(图版Ⅱ :4,5)。因此,花药壁发育模式为单子叶型。小孢子母细胞减数分裂期间,表皮细胞多为整齐的长方形(图版Ⅱ :1,7),有的呈波浪状或齿状(图版Ⅱ :4-6);药室内壁细胞增大呈方廓形至长方形(图版Ⅱ :4-10);中层细胞细小,单核;绒毡层细胞增大具有明显的双核(图版Ⅱ :4-8)。在小孢子四分体或小孢子单体时期(图版Ⅱ :6-9),中层和绒毡层降解明显,药室内壁细胞继续增大,表皮细胞变窄。花药成熟时,花药壁仅剩下表皮残迹和带状纤维加厚的药室内壁层(图版Ⅱ :10)。从成熟花药的纵切面和横切面上可以观察到不育隔膜组织降解明显,花药顶部凹陷处的花药壁较薄(图版Ⅱ :11),发生断裂,准备散粉(图版Ⅱ :12)。
2.3 小孢子发生和雄配子体发育
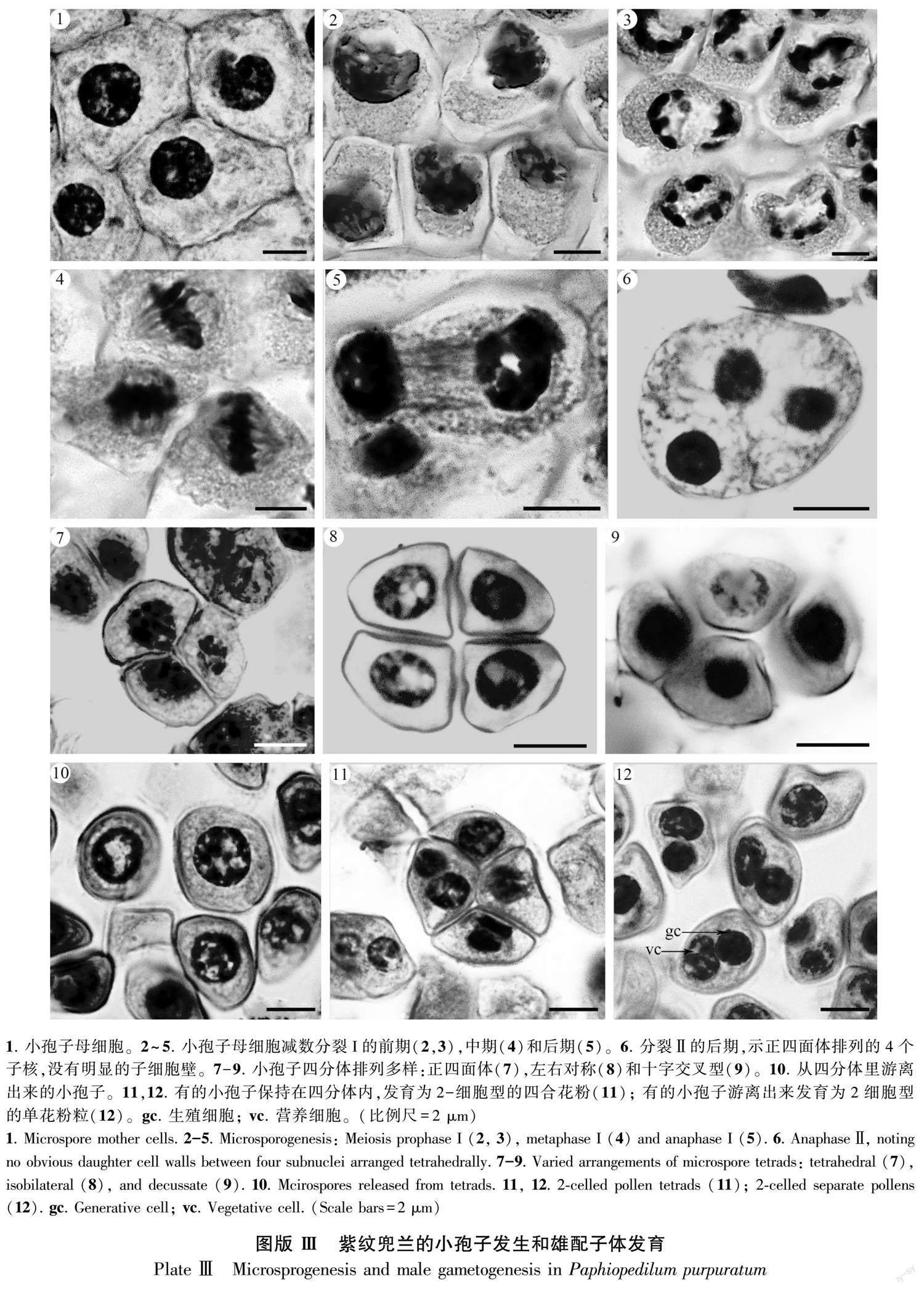
发育早期,花药室表皮下的分生组织经有丝分裂形成孢原细胞,药室中央的孢原细胞分化为染色较浅的不育隔膜组织,靠外侧的孢原细胞分化为染色较深、核质比大的造孢细胞(图版Ⅱ :1,2),紧接着分裂形成了核质比大、排列紧密的小孢子母细胞(图版Ⅲ :1)。小孢子母细胞经减数分裂I的前期(图版Ⅲ :2,3)、中期(图版Ⅲ :4)、后期(图版Ⅲ :5)和减数分裂Ⅱ形成了处于同一个细胞内的正四面体排列的4个子核(图版Ⅲ :6)。之后,4个子核间出现了明显的子细胞壁,产生了3种排列方式的小孢子四分体,包括正四面体(图版Ⅲ :7)、左右对称型(图版Ⅲ :8)和十字交叉型(图版Ⅲ :9)。接着,小孢子有的从四分体内释放出来(图版Ⅲ :10),有的仍然保持在四分体内(图版Ⅲ :11),继续通过有丝分裂形成了具有2-核的花粉粒或四合花粉(图版Ⅲ :12)。因此,紫纹兜兰的小孢子母细胞减数分裂的胞质分裂方式为同时型(Johri et al., 1992)。
3 讨论与结论
雄蕊数目和花药发育胚胎学特征,包括花药室数目、花药壁发育类型、小孢子发生的胞质分裂方式、小孢子四分体排列形式以及散粉单元方式等,在被子植物中,尤其是兰科分类学中具有重要作用(Johri et al., 1992; Dressler, 1993; 胡适宜,2005; Singer et al., 2008; 李璐,2023)。现有研究表明,关于兰科的花药发育的研究资料,集中在具三雄蕊的拟兰亚科和具单雄蕊的兰亚科和树兰亚科,较少见于具双雄蕊的杓兰亚科,且具单雄蕊的香荚兰亚科(Vanilloideae)的花药发育研究几乎为空白(李璐,2023)。据此,本研究观察了紫纹兜兰的花形态和花药发育胚胎学特征,结合现有资料,比较分析了它们的分类学意义,具体如下。
3.1 新月形退化雄蕊和具条纹脉萼片的分类学意义
紫纹兜兰具有紫色条纹脉的中萼片和新月形的退化雄蕊的花形态特征,明显区别于大多数兜兰属物種,具有较高的物种识别度。值得注意的是,这两个特征还见于紫纹兜兰所在的单花斑叶组的其余5种以及同一亚属的多花无耳组的3个种。前者包括紫纹兜兰的3个近缘种 [胼胝兜兰(P. callosum)、髯毛兜兰(P. barbartum)、劳氏兜兰(P. lawrenceanum)](Cox et al., 1997; Chochai et al., 2012; Tsai et al., 2020)和国产的2个种 [秀丽兜兰(P. venustum)、彩云兜兰(P. wardii)](刘仲健等,2009)。后者包括国王兜兰(P. rothschildianum)、皇后兜兰(P. sanderianum)和菲律宾兜兰(P. philippinense),它们都具有这两个重要分类学意义的形态特征(Cribb, 1998)。这似乎意味着单花斑叶组和多花无耳组之间也许存在着一定亲缘关系,值得进一步研究。同时,考虑到退化雄蕊的形态结构在兜兰属种间差异明显(Cribb, 1998),其分类学意义值得重视。
3.2 紫纹兜兰可育雄蕊花药成熟时的花粉类型
紫纹兜兰的花药成熟开裂后,露出一团表面光滑但有黏性的散粉单元(pollen dispersal unit),即花粉粒被黏性物质粘连为一团,形似树兰亚科的花粉团(pollinium)。有研究认为花粉单粒散生是兜兰属的分类学特征之一(Swamy, 1949; Poddubnaya-Arnoldi, 1960),杓兰属的花粉也被描述为2-细胞型单粒花粉(Sood & Rao, 1988)。不过,后来的研究进一步证实了兜兰属(任玲和王伏雄,1987)和杓兰属(Kant, 2011)成熟的散粉单元均为黏性花粉粒,这些黏性物质来自于绒毡层细胞降解后的脂类物质,含有黄色的类胡萝卜素,被称为花粉鞘类物质, 具有将整个花药内的花粉粘成一体,提高传粉效率的特征(任玲和王伏雄,1987),这与其他4个亚科的散粉单元类型截然不同(Singer et al., 2008)。本研究观察到紫纹兜兰成熟花药内的花粉细胞较为稀疏,既有单粒花粉也有四合花粉,并非如万代兰属(Vanda Jones ex R. Br.)(张锦等,2019)和巾唇兰属(Pennilabium J. J. Sm.)(李璐等,2020)的花粉团那样排列紧密。这样的“黏性花粉”在长瓣兜兰(Paphiopedilum dianthum)(史军等,2007)和绿花杓兰(Cypripedium henryi)(Li et al., 2008)的传粉者身上清晰可辨,支持了前人的观点(任玲和王伏雄,1987),为进一步理解杓兰亚科的传粉生物学提供了形态学和胚胎学方面的数据。
3.3 兰科花药室数目和不育隔膜组织分化的重要性
现有资料表明,在兰科花药发育过程中,不育隔膜组织的分化和降解对于理解5个亚科不同散粉单元类型的形成非常重要(李璐,2023)。在具有单雄蕊的兰亚科和树兰亚科的花药发育过程中,早期花药原基分化出的不育隔膜组织的数目、朝向和位置对于花粉小块(massulae)和花粉团(pollinium)的类型和数目至关重要(Freudenstein & Rasmussen, 1996, 1997; Freudenstein et al., 2002; Kant & Goel, 2013)。这是因为不育隔膜组织在后期会发生降解,把成熟花粉囊分割为大小不同(等大或不等大)、数目不等(2、4、8)和形态多样(全缘、孔裂、浅裂、深裂)的散粉单元(Freudenstein & Rasmussen, 1996; Singer et al., 2008; Kant & Hossain, 2010; Kant et al., 2013; 张锦等,2019;李璐等,2020; 谭庆琴等,2020)。本研究观察到紫纹兜兰早期的花药分化为一对侧生药室,每个药室中央的孢原细胞分化出一条不育隔膜组织,形成一对靠边的具浅凹的弧形小孢子囊。这一点在前人的研究中均未得到重视,忽略了花药室数目和不育隔膜组织分化的关系,例如白唇杓兰(C. cordigerum)和扇脉杓兰(C. japonicum)被分别描述为4室花药和4个小孢子囊(Sood & Rao, 1988; Ghimire et al., 2020),为理解杓兰亚科的花药发育的分类学意义带来了困惑。因此,花药室的数目和不育隔膜组织分化之间的关系值得深入探讨(Kant & Goel, 2013)。
3.4 紫纹兜兰单子叶型花药壁发育的分类学意义
紫纹兜兰的花药壁有4层,属于单子叶型。这与杓兰亚科现有的研究结果均不同,具有分类学价值。例如,同属植物的南印兜兰(Paphiopedilum druryi)(Swamy, 1949)和古德兜兰(P. godefroyae)(任玲和王伏雄,1987)的花药壁有5层,属于基本型,而杓兰属的白唇杓兰(Sood & Rao, 1988; Kant, 2011)和扇脉杓兰(Ghimire et al., 2020)有6~8层,为多层型花药壁。在兰科里,单子叶型花药壁多见于兰亚科,如斑叶兰属(Goodyera R. Br.)(Sood, 1988)、蜂兰属(Ophrys L.)(Aybeke, 2012)、玉凤花属(Habenaria Willd.)(Vij & Sharma, 1987; Sood, 1986)、角盘兰属(Herminium L.)(Sood & Rao, 1986)和鸟足兰属(Satyrium Sw.)(Rao & Sood, 1979)以及树兰亚科的巾唇兰属(李璐等,2020)等,而多层型花药壁普遍出现在树兰亚科,包括万代兰属(张锦等,2019)和竹叶兰属(Arundina Blume)(谭庆琴等,2020)等。此外,拟兰亚科的成熟花药壁也普遍具有4~5层,有的地方具有2层加厚的药室内壁,但关于其花药壁类型的特征和分类学意义并未被提及(Kocyan & Endress, 2001; Singer et al., 2008)。因此,本研究认为花药壁的层数和类型在兰科植物的花药发育中非常多样,这在其他被子植物里不常见,值得重视。
被子植物的绒毡层细胞核通常为单核,但部分物种也有双核且在属内较为稳定,具有一定的分类学意义(Johri et al., 1992)。紫纹兜兰花药壁绒毡层和不育隔膜组织的内绒毡层均具双核现象,这与南印兜兰(Swamy, 1949)和古德兜兰(任玲和王伏雄,1987)的观察结果一致,但与杓兰属白唇杓兰(Sood & Rao, 1988; Kant, 2011)和扇脉杓兰(Ghimire et al., 2020)具单核绒毡层的结果不同。这说明绒毡层细胞核的数目或许可以作为兜兰属和杓兰属界限划分的依据之一。有意思的是,Swamy(1949)曾经系统地观察了兰科16属28种植物配子体发育的胚胎学特征,其中,南印兜兰具有双核绒毡层,明显区别于其他单雄蕊类的兰科植物,因此双核绒毡层被认為是杓兰亚科的鉴别特征之一。不过,后来Sood(1988)也发现了兰亚科的斑叶兰(Goodye rarepens)也存在双核绒毡层的现象,并提出该特征并非具双雄蕊兰的杓兰亚科所特有。这在后人的研究结果里也得到证实。现有兰科花药发育资料表明,单核绒毡层较为普遍,见于拟兰亚科、兰亚科和树兰亚科等大部分类群(Vij & Sharma, 1987; Singer et al., 2008; 张锦等,2019),而双核绒毡层相对少见,出现在杓兰亚科的兜兰属以及兰亚科和树兰亚科的一些物种,如火烧兰属(Epipactis Zinn)植物(Sood, 1997; Bhanwra et al., 2006a)、纹瓣兰(Cymbidium pendulum)、盖喉兰(Smitinandia micrantha)(Bhanwra et al., 2006b)和紫花苞舌兰(Spathoglottis plicata)(Sriyot et al., 2015)等。此外,在绶草(Spiranthes sinensis)的花药发育过程中,绒毡层细胞在分化早期为单核,成熟时变为双核(Sood, 1989),这在紫纹兜兰的花药发育过程中未曾注意到。因此,还需要观察发育完整的花药壁结构的细胞特征来确定绒毡层细胞核数目(Johri et al., 1992)。
3.5 紫纹兜兰的小孢子发生和雄配子体发育的分类学意义
紫纹兜兰的小孢子母细胞经同时型胞质分裂方式形成小孢子四分体,通过有丝分裂形成了2-细胞型花粉,兼具单粒花粉和四合花粉共存的现象,这与杓兰亚科现有研究资料基本一致(Poddubnaya-Arnoldi, 1960; Sood & Rao, 1988; Brown & Lemmon, 1996; Kant, 2011; Ghimire et al., 2020),可作为该亚科区别于其他亚科的胚胎学特征。虽然最早的研究表明杓兰属为连续型胞质分裂(Guignard, 1882),但并未得到后续研究资料的支持。在兰科花药发育过程中,同时型胞质分裂较为普遍,而连续型胞质分裂相对较少,后者见于万代兰属(张锦等,2019)、蜂兰属(Aybeke, 2012)和苞舌兰属(Spathoglottis Blume)(Sriyot et al., 2015)。因此,小孢子发生的胞质分裂方式在兰科分类系统中的演化趋势也值得重点关注(Furness & Rudall, 1999; Furness et al., 2002)。
紫纹兜兰的小孢子四分体排列方式多样,包括正四面体、左右对称型和十字交叉型,为理解小孢子四分体排列方式的分类学意义提供了新资料。已有研究表明,兰科的小孢子四分体排列方式多样,多达5种,包括正四面体、左右对称型、十字交叉型、“T”型和线型(胡适宜,1982;Johri et al., 1992)。其中,正四面体最常见,左右对称型次之,而其余几种排列方式是现有兰科花药发育中比较少见的。值得注意的是,小孢子四分体的排列方式与散粉单元内部的四合花粉的排列方式基本保持一致。这在兰亚科的花粉小块(Kant et al., 2013)和树兰亚科的坚固花粉团(张锦等,2019; 谭庆琴等,2020; 李璐等,2020)等的花药发育过程中均得到了证实,对于理解兰科的成熟花粉形态具有重要意义。
3.6 结论
综上所述,本研究提出以下观点,仅供参考。(1)紫纹兜兰带纵条纹的背萼片和新月形退化雄蕊特征在兜兰属较为少见,可以作为兜兰亚属单花斑叶组和多花无耳组联系的纽带,其亲缘关系值得继续探究。(2)紫纹兜兰在花蕾期和开放花时的合蕊柱结构差异说明花器官发生过程中,可育雄蕊和退化雄蕊以及雌蕊柱头的形态建成发生在花发育后期,即花蕾期,并且三者之间的生长速度存在明显分化,可育雄蕊的花药发育早于退化雄蕊和柱头。(3)紫纹兜兰的花药具有一对侧生花药室和不育隔膜组织的分化,与同属植物记录的各有4室花药和4个小孢子囊的结果均不同,值得关注。(4)绒毡层细胞核数目或许可用于兜兰属和杓兰属间界限划分的依据之一,前者为双核,后者为单核。(5)紫纹兜兰花药发育的胚胎学特征与相关兰科类群存在明显异同,具有一定的分类学意义,包括花药室的数目、花药壁的发育类型、绒毡层的细胞核数目、胞质分裂类型、小孢子四分体的排列形式等。(6)现有资料表明花形态和花药发育胚胎学特征在兰科不同分类群间均有明显差异(Aybeke, 2012; Sriyot et al., 2015; 谭庆琴等,2020),但研究过的类群不足200种(作者初步统计)。因此,有必要选择种以上的分类群(组、亚属、属、亚族、族、亚科)为代表开展研究,逐步积累资料,为解决有争议的分类系统学问题提供花形态和胚胎学证据(Swamy, 1949; Kant, 2010; Kant & Goel, 2013; Valencia-Nieto et al., 2016)。
致谢 云南丰春坊生物科技有限公司王晓云女士和徐志峰先生提供实验材料,西南林业大学云南生物多样性研究院提供实验平台,古旭老师提供实验指导,在此一并谨表谢意。
参考文献:
AT WOOD J, 1984. The relationships of the slipper orchids (Subfamily Cypripedioideae) [J]. Selbyana, 7: 129-247.
AYBEKE M, 2012. Anther wall and pollen development in Ophrys mammosa L. (Orchidaceae) [J]. Plant Syst Evol, 298(6): 1015-1023.
BHANWRA RK, VIJ SP, 2003. The development of anther and male gametophyte in Eulophia hormusjii Duthie (Orchidaceae) [J]. J Orchid Soc Ind, 17(1-2): 87-91.
BHANWRA RK, VIJ SP, KANT R, et al., 2006a. Pollinium development in Epipactis veratrifolia [J]. J Orchid Soc India, 20(1-2): 1-6.
BHANWRA RK, VIJ SP, CHANDEL V, et al., 2006b. Development of polliniumin two epidendroid orchids [J]. Curr Sci, 90: 1384-1387.
BROWN RC, LEMMON BE, 1996. Nuclear cytoplasmic domains, microtubules and organelles in microsporocytes of the slipper orchid Cypripedium californicum A. Gray dividing by simultaneous cytokinesis [J]. Sex Plant Reprod, 9(3): 145-152.
BURNS BALOGH P, BERNHARDT P, 1985. Evolutionary trends in the androecium of the Orchidaceae [J]. Plant Syst Evol, 149(1): 119-134.
CHASE MW, CAMERON KM, FREUDENSTEINET JV, et al., 2015. An updated classification of Orchidaceae [J]. Bot J Linn Soc, 177(2): 151-174.
CHEN XQ(SC), LIU ZJ, LUO YB, 2009. A field guide to the orchids of China [M]. Beijing: China Forestry Publishing House. [陈心启, 刘仲健, 罗毅波, 2009. 中国兰科植物鉴别手冊 [M]. 北京: 中国林业出版社.]
CHOCHAI A, LEITCH IJ, INGROUILLE MJ, et al., 2012. Molecular phylogenetics of Paphiopedilum (Cypripedioideae; Orchidaceae) based on nuclear ribosomal ITS and plastid sequences [J]. Bot J Linn Soc, 170: 176-196.
COX AV, PRIDGEON AM, ALBERT VA, et al., 1997. Phylogenetics of the slipper orchids (Cypripedioideae, Orchidaceae): nuclear rDNA ITS sequences [J]. Plant Syst Evol, 208(3): 197-223.
CRIBB PJ, 1987. The genus Paphiopedilum [M]. London: Collingridge.
CRIBB PJ, 1998. The genus Paphiopedilum [M]. Kota Kinabalu: Natural History Publications (Borneo) in Association with Royal Botanic Gardens Kew.
DRESSLER RL, 1986. Features of pollinaria and orchid classification [J]. Lindleyana, 1(2): 125-130.
DRESSLER RL, 1993. Phylogeny and classification of the orchid family [M]. Cambridge: Cambridge University Press.
FREUDENSTEIN JV, HARRIS EM, RASMUSSEN FN, 2002. The evolution of anther morphology in orchids: incumbent anthers, superposed pollinia, and the vandoid complex [J]. Am J Bot, 89(11): 1747-1755.
FREUDENSTEIN JV, RASMUSSEN FN, 1996. Pollinium development and number in the Orchidaceae [J]. Amer J Bot, 83(7): 813-824.
FREUDENSTEIN JV, RASMUSSEN FN, 1997. Sectile pollinia and relationships in the Orchidaceae [J]. Plant Syst Evol, 205: 125-146.
FURNESS CA, RUDALL PJ, 1999. Microsporogenesis in monocotyledons [J]. Ann Bot, 84(4): 475-499.
FURNESS CA, RUDALL PJ, SAMPSON FB, 2002. Evolution of microsporogenesis in angiosperms [J]. Int J Plant Sci, 163(2): 235-260.
GHIMIRE B, SON SW, KIM JH, et al., 2020. Gametophyte and embryonic ontogeny: understanding the reproductive calendar of Cypripedium japonicum Thunb. (Cypripedoideae, Orchidaceae), a ladys slipper orchid endemic to East Asia [J]. BMC Plant Biol, 20(20): 426.
GUIGNARD L, 1882. Recherches sur le d6veloppement de l'anth6re et du pollen chez les Orchid6es [J]. Ann Sci Natur-Bot Biol Veg, 6. s6r, 14: 26-45.
HARDER LD, JOHNSON SD, 2008. Function and evolution of aggregated pollen in angiosperms [J]. Int J Plant Sci, 169(1): 59-78.
HU SY, 1982. Embryology of angiosperms [M]. Beijing: Higher Education Press. [胡適宜, 1982. 被子植物胚胎学 [M]. 北京: 高等教育出版社.]
HU SY, 2005. Reproductive biology of angiosperms [M]. Beijing: Higher Education Press: 29-92. [胡适宜, 2005. 被子植物生殖生物学 [M]. 北京: 高等教育出版社: 25-92.]
JOHNSON SD, EDWARDS TJ, 2000. The structure and function of orchid pollinaria [J]. Plant Syst Evol, 222: 243-269.
JOHRI BM, AMBEGAOKAR KB, SRIWASTAVA PS, 1992. Comparative embryology of angiosperm [M]. Berlin Heidelberg: Springer.
KANT R, 2011. Development of monads and associated changes in anther in Cypripedium cordigerum D. Don: A rare orchid [J]. Vegetos, 24(1): 103-110.
KANT R, 2019. Development of pollinium and associated changes in anther of Calanthe tricarinata Lindl., an epidendroid orchid [J]. Taiwania, 64(3): 269-279.
KANT R, 2023. Development of anther and sectile pollinium in Herminium lanceum (Thunb. ex Sw.) Vuijk — a massulate orchid [J]. Isr J Plant Sci, 1(aop): 1-8.
KANT R, BHANWRA RK, 2010. Development of anther in relation to sectile pollinium in Zeuxine strateumatica (Lindl.) Schltr [J]. J Biol Life Sci, 1(1): 5-12.
KANT R, GOEL S, 2013. Development of anther in Goodye rarepens (L.) R. Br.: A massulate orchid [J]. Vegetos, 26(1): 9-18.
KANT R, HOSSAIN MM, 2010. Development of pollinium in Malaxis muscifera (Lindl.) Kuntze [J]. Bangladesh J Bot, 39(2): 193-198.
KANT R, HOSSAIN MM, ATTRI LK, 2013. Pollinium development in Spiranthes sinensis (Pers.) Ames. and Cymbidium pendulum SW: A comparative study [J]. Bangladesh J Bot, 42(2): 307-314.
KARASAWA KA, 1980. Karyomorphological studies on two species of Paphiopedilum [J]. Bull Hiroshima Bot Gard, 3: 69-74.
KARASAWA KA, 1982. revision of the genus Paphiopedilum (Orchidaceae) [J]. Bull Hiroshima Bot Gard, 5: 1-69.
KOCYAN A, ENDRESS PK, 2001. Floral structure and development and systematic aspects of some ‘lower Asparagales [J]. Plant Syst Evol, 229(3): 187-216.
LANG KY, 1999. Flora Reipublicae Popularis Sinicae (Orchidaceae Ⅰ): Vol. 17 (in Chinese) [M]. Beijing: Science Press: 54-71. [郎楷永, 1999. 中国植物志(兰科一): 第十七卷 [M]. 北京: 科学出版社: 54-71.]
LI L, 2023. Research progress on diversity of androecium development of Orchidaceae [J]. Guihaia, 43(8): 1537-1552. [李璐, 2023. 兰科雄蕊发育多样性研究进展 [J]. 广西植物, 43(8): 1537-1552.]
LI L, ZHANG J, LI CR, et al., 2020. Pollinia development in a new species of Pennilabium yunnanense (Orchidaceae) [J]. Bull Bot Res, 40(2): 161-171. [李璐, 張锦, 李楚然, 等, 2020. 兰科新种巾唇兰的花粉团发育及分类学意义 [J]. 植物研究, 40(2): 161-171.]
LI P, LUO YB, DENG YX, et al., 2008. Pollination of the ladys slipper Cypripedium henryi Rolfe (Orchidaceae) [J]. Bot J Linn Soc, 156: 491-499.
LIU ZJ, CHEN XQ(SC), CHEN LJ, et al., 2009. The genus Paphiopedilum in China [M]. Beijing: Science Press. [刘仲健, 陈心启, 陈利君, 等, 2009. 中国兜兰属植物 [M]. 北京: 科学出版社.]
MAHESHWARI P, NARAYANASWAMI S, 1952. Embryological studies on Spiranthes australis Lindl [J]. Bot J Linn Soc, 53(355): 474-486.
Ministry of Agriculture and Rural Affairs, State Forestry and grassland administration, 2021. List of national key protected wild plants in China [R]. Beijing: Ministry of Agriculture and Rural Affairs, State Forestry and Grassland Administration. [国家林业和草原局 农业农村部, 2021. 国家重点保护野生植物名录 [R]. 北京: 国家林业和草原局 农业农村部.]
PODDUBNAYA-ARNOLDI VA, 1960. Study of fertilization in the living material of some angiosperms [J]. Phytomorphology, 10(1): 185-198.
PRIDGEON AM, CRIBB PJ, CHASE MW, et al., 1999. Genera Orchidacearum: Vol. 1: Apostasioideae and Cypripedioideae [M]. Demand: Oxford University Press.
RAO PRM, SOOD SK, 1979. Life history of Satyrium nepalense (Orchidaceae) [J]. Norw J Bot, 26(4): 285-294.
REN L, WANG FX, 1987. Embryology of Paphiopedilum [J]. J Intedr Plant Biol, 29(1): 14-22. [任玲, 王伏雄, 1987. 兜蘭胚胎学的研究 [J]. 植物学报, 29(1): 14-22.]
SHI J, CHENG J, LUO D, et al., 2007. Pollination syndromes predict brood-site deceptive pollination by female hoverflies in Paphiopedilum dianthum (Orchidaceae) [J]. Acta Phytotaxon Sin, 45(4): 551-560. [史军, 程瑾, 罗敦, 等, 2007. 利用传粉综合征预测: 长瓣兜兰模拟繁殖地欺骗雌性食蚜蝇传粉 [J]. 植物分类学报, 45(4): 551-560.]
SINGER RB, BARBARA G, CROSS H, et al., 2008. The use of Orchid pollinia or pollinaria for taxonomic identification [J]. Selbyana, 29(1): 6-19.
SOOD SK, 1986. Gametogenesis, integuments initiation and embryogeny in three species of Habenaria (Orchidaceae, Orchideae) [J]. Proc Natl Acad Sci USA, 96(6): 487-494.
SOOD SK, 1988. Development of gametophytes, embryogeny and pericarp in Goodye rarepens (Orchidaceae, Neottieae) [J]. Proc Natl Acad Sci USA, 98(2): 149-156.
SOOD SK, 1989. Embryology and systematic position of Liparis (Orchidaceae) [J]. Plant Syst Evol, (166): 1-9.
SOOD SK, 1997. Gametogenesis, seed development and pericarp in Epipactis latifolia L. [J]. J Indian Bot Soc, 76: 11-15.
SOOD SK, RAO PRM, 1986. Development of male and female gametophytes in Herminium angustifolium (Orchidaceae) [J]. Phytomorphology, 36: 11-15.
SOOD SK, RAO PRM, 1988. Studies in the embryology of the diandrous orchid Cypripedium cordigerum (Cypripedieae, Orchidaceae) [J]. Plant Syst Evol, 160(3-4): 159-168.
SRIYOT N, THAMMATHAWORN A, THEERAKULPISUT P, 2015. Embryology of Spathoglot tisplicata Blume: A reinvestigation and additional data [J]. Trop Nat Hist, 15(2): 97-115.
SWAMY BGL, 1946. The embryology of Zeuxine sulcata Lindl [J]. New Phytol, 45(1): 132-136.
SWAMY BGL, 1949. Embryological studies in Orchidaceae, I: Gametophytes [J]. Amer Midland Natur, 41: 184-201.
TAN QQ, LI L, ZHANG J, et al., 2020. Pollinia development in Arundina graminifolia (Orchidaceae) with taxonomic implications [J]. Guihaia, 40(1): 83-94. [谭庆琴, 李璐, 张锦, 等, 2020. 传统傣药竹叶兰的花粉团发育及分类学意义 [J]. 广西植物, 40(1): 83-94.]
TSAI CC, LIAO PC, KO YZ, et al., 2020. Phylogeny and historical biogeography of Paphiopedilum Pfitzer (Orchidaceae) based on nuclear and plastid DNA [J]. Front Plant Sci, 11: 126.
VALENCIA-NIETO B, SOSA V, MARQUEZ-GUZMAN J, 2016. Late stages of anther development and anther attributes in Microepidendrum differs from other genera of Epidendrum alliance (Orchidaceae) [J]. Flora Morphol Distrib Funct Ecol Plants, 218: 35-43.
VIJ SP, SHARMA M, 1987. Embryological studies in Orchidaceae. V. Epipactis Adams [J]. Phytomorphology, 37(1): 81-86.
ZHANG J, ZHANG H, LI L, et al., 2019. Pollinia development in rare orchid of Vanda coerulea with its taxonomic implications [J]. Acta Bot Boreal-Occident Sin, 39(7) : 1143-1153. [張锦, 张辉, 李璐, 等, 2019. 珍稀濒危植物大花万代兰的花粉团发育及其分类学意义 [J]. 西北植物学报, 39(7): 1143-1153.]
( 责任编辑 周翠鸣 )
收稿日期: 2023-09-01
基金项目: 国家自然科学基金(32060049); 云南省人社厅基层专家工作站。
第一作者: 朱永(1997-),硕士研究生,主要从事资源利用与植物保护研究,(E-mail)822512121@[KG-0.5mm]qq.com。
* 通信作者: 李璐,博士,副研究员,研究方向为植物系统与进化、植物形态解剖学,(E-mail)lilusaraca@foxmail.com, lilu@swfu.edu.cn。
