高产酸性糖化酶根霉与乙偶姻芽孢杆菌复合麸曲的研究
2024-03-09袁英豪严唯玮黄静李建龙李琴胡凯弟刘爱平刘书亮
袁英豪,严唯玮,黄静,李建龙,李琴,胡凯弟,刘爱平,刘书亮
(四川农业大学食品学院,四川 雅安 625014)
大曲是我国白酒、食醋乃至整个酿造行业的重要原料之一[1-4]。大曲作为食醋固态酿造过程中的发酵剂和糖化剂(亦称醋曲),包含了多种微生物及酶系,在合成醇、醛、酸、酮、酯等骨架化合物中发挥关键作用[5],大曲发酵期间微生物代谢产物、风味前体物质及风味物质的积累与形成对食醋品质有显著的影响[6-8]。
“曲是醋中骨”,醋曲中的霉菌主要源于自然环境富集,包括曲霉(Aspergillus)、根霉(Rhizopus)、毛霉(Mucor)和犁头霉(Absidia)等[5,9],能产生液化酶、糖化酶、蛋白酶、纤维素酶等多种酶系,对原料中淀粉、蛋白质、纤维素等大分子进行分解,使体系中糖类及氨基酸含量增加,分解产物可为食醋酿造微生物的代谢提供前体物质,亦为后续食醋风味形成奠定基础[10-11]。王佳丽等[12]自山西老陈醋大曲中筛选得到一株高产糖化酶的黑曲霉,在麸皮培养基中酶活可达4 279.11 U/g,同时蛋白酶和纤维素酶活达到368.80、4 476.60 U/g,经在液体培养基中培养条件优化后糖化酶提高了0.77倍。Liu A.P.等[13]为提高四川麸醋发酵过程中淀粉的利用率,采用黑曲霉AS 3.758制得的醋曲强化麸醋发酵,表明黑曲霉的添加显著提高淀粉利用率,同时,有机酸及游离氨基酸含量均得到显著提高。Liu A.P.等[9]再以黑曲霉AS 3.758作为强化菌种,探究多轮生物强化对四川麸醋提高淀粉利用率的稳定性,结果显示,在多轮发酵中淀粉利用率平均提高9.8%。
芽孢杆菌(Bacillus)作为低丰度微生物在整个酿醋过程中始终存在,是发酵过程中重要功能菌[14-16],不仅可产生多种水解酶,同时能够合成吡嗪类风味前体物质[17],如乙偶姻(3-羟基-2-丁酮,acetoin,ACT),本身具有愉悦的奶油香气,目前对于高产乙偶姻菌株的筛选多集中于地衣芽孢杆菌(B.licheniformis)与枯草芽孢杆菌(B.subtilis)[18]。为提高和稳定发酵产品中四甲基吡嗪(TTMP)含量,张颍等[19]自酱香型白酒大曲中筛选得到一株地衣芽孢杆菌GTBL-168,该菌株产乙偶姻含量为17.51 g/L。张玲玲等[20]从浓香型白酒大曲中筛选得到一株贝莱斯芽孢杆菌(B.velezensis),其乙偶姻产量达到18.37 g/L。Xu B.Y.等[21]以接种地衣芽孢杆菌和贝莱斯芽孢杆菌制成强化大曲,研究发现,强化大曲风味物质总含量高于传统大曲,且大曲糖化力和酯化力增加,这与芽孢杆菌丰度的增加有关。
醋曲富含功能微生物菌群,是食醋酿造的重要菌种资源库,其中的功能菌筛选于“曲”应用于“醋”,一直是食醋酿造的重要课题。保宁麸醋是四川麸醋的典型代表,又是中国的四大名醋之一,从其自然发酵的“中药醋曲”中获得功能菌种并强化应用是提升保宁麸醋产量与品质的有效途径之一。因此,本研究从“中药醋曲”中筛选获得优良的产酸性糖化酶霉菌和产乙偶姻芽孢杆菌,优化复合菌麸曲制备工艺,旨在为麸曲应用提供菌种资源和数据依据。
1 材料和方法
1.1 试验材料与试剂
中药醋曲样品,采自四川保宁醋有限公司,分离获得218株霉菌和128株芽孢杆菌,保存于四川农业大学食品微生物实验室;麸皮,市售;可溶性淀粉、肌酸、α-萘酚、无水乙醇等试剂均为国产分析纯;乙偶姻标准品为色谱纯。
1.2 主要仪器与设备
C1000 Thermal Cycler PCR仪,美国Bio-Rad公司;Gel Doc XR+凝胶成像系统,美国Bio-Rad公司;UV1800PC紫外-可见分光光度计,上海美谱达仪器有限公司;1300 Series A2生物安全柜,美国Thermo Fisher Scientific公司;LDZX-40AI型立式自动电热压力蒸汽灭菌锅,上海三申医疗核子仪器厂;NLCD-307B光学显微镜,宁波永新光学股份有限公司。
1.3 培养基
LB培养基(固/液)、马铃薯葡萄糖琼脂(PDA)培养基购于海博生物公司。
麸皮培养基:市售普通粗麸皮与蒸馏水按1∶1比例混合均匀,于121 ℃高压蒸料灭菌20 min,趁热摇散后冷却备用。
酸性糖化酶筛选培养基:蛋白胨1%,牛肉膏0.5%,NaCl 0.5%,可溶性淀粉1%,琼脂2%,溶解于蒸馏水,pH 4.5±0.1,115 ℃灭菌15 min。
V-P培养基:葡萄糖1%,蛋白胨0.5%,NaCl 0.05%,KH2PO40.5%,溶解于蒸馏水,121 ℃灭菌20 min。
发酵培养基:葡萄糖12%,酵母浸粉0.5%,新鲜玉米浆1%,尿素0.2%,溶解于蒸馏水,115 ℃灭菌15 min。
孢子洗脱液:吐温-80 0.2%,琼脂粉0.1%,溶解于蒸馏水,121 ℃灭菌20 min。
改良O′Meara试剂:蛋白胨0.5%,肌酸0.3%,NaOH 40%,溶解于蒸馏水。
1.4 试验方法
1.4.1 产酸性糖化酶霉菌的筛选及鉴定
1.4.1.1 产酸性糖化酶霉菌的初筛
参照王佳丽[12]和倪海斌[22]方法。将醋曲中分离纯化得到的霉菌点种于糖化酶筛选培养基(pH=4.5),经28 ℃培养2~3 d,使用卢戈氏碘液对培养基进行染色,观察菌落周围有无透明圈,记录透明圈直径与菌落直径并计算其比值。
1.4.1.2 产酸性糖化酶霉菌的复筛
(1)麸曲制备将复筛霉菌于斜面培养基上进行活化,使用5 mL孢子洗脱液将孢子洗脱制得孢子悬液,取500 μL孢子悬液均匀接种于20 g麸皮培养基,28 ℃培养2 d。每株霉菌做3次重复。
(2)麸曲糖化力的测定参照QB/T 4257-2011《酿酒大曲通用分析方法》[23]对糖化力进行测定,单位为“U/g 干醅”。
1.4.1.3 产酸性生淀粉糖化酶霉菌的筛选
测定方法同1.4.1.2,以小麦淀粉替代麸曲中可溶性淀粉[24]。综合考虑糖化力与生淀粉糖化力,选择糖化力相对较高的霉菌作为后续试验用菌株。
1.4.1.4 产酸性糖化酶霉菌的鉴定
(1)形态学鉴定参照文献[25]和《真菌鉴定手册》进行鉴定。
(2)分子生物学鉴定参照李泽洋等[26]方法,对PCR扩增及测序。将测序结果与NCBI数据库进行BLAST比对,构建系统进化树[27]。
1.4.2 产乙偶姻芽孢杆菌的筛选及鉴定
1.4.2.1 产乙偶姻芽孢杆菌的初筛
参照霍明月等[28]方法,挑取芽孢杆菌纯菌接种至LB液体培养基中,37 ℃过夜培养制得种子液,按1%(v/v)的接种量接种于V-P培养基中,摇床培养48 h,取菌悬液进行离心,吸取1.0 mL上清液与1.0 mL改良O′Meara试剂混合均匀,37 ℃反应1 h,观察颜色变化,使用分光光度计测定520 nm处的光密度值,初步判断各菌株产生乙偶姻的能力。
1.4.2.2 产乙偶姻芽孢杆菌的复筛
参照郭艳霞[29]和张玲玲等[20]的方法,按1%(v/v)的接种量接种芽孢杆菌种子液于发酵培养基中,摇床培养48 h,离心取上清液100 μL,依次加入700 μL肌酸溶液(0.5%,w/v),1 mL α-萘酚(5%,w/v),1 mL KOH溶液(40%,w/v),振荡均匀,60 ℃反应10 min,测定样品在OD520nm值。试验做3次重复。乙偶姻标准曲线的绘制,乙偶姻溶液不同浓度与吸光度值的标准曲线:y=0.023 56x-0.011 24,R2=0.991 9。
1.4.2.3 产乙偶姻芽孢杆菌的鉴定
(1)形态学鉴定参考《常见细菌系统鉴定手册》进行。
(2)分子生物学鉴定参照Si J.等[30]方法,进行16S rDNA的PCR扩增,琼脂糖凝胶电泳检测与系统发育树构建步骤同1.4.1.4。
1.4.3 霉菌与芽孢杆菌复配菌株的平板对峙试验
于LB固体培养基中央放置无菌牛津杯,并向其加入100 μL目标芽孢杆菌菌悬液,同时将目标霉菌孢子悬液对称点接于牛津杯两端,30 ℃正置培养2~3 d,观察抑菌圈大小。
1.4.4 复合菌麸曲制备工艺优化
1.4.4.1 单因素实验
(1)种子液的制备同1.4.1.2、1.4.2.1方法制备种子液。
(2)霉菌与芽孢杆菌接种比例的确定以仅接种500 μL霉菌孢子悬液和仅接种500 μL芽孢杆菌菌悬液的麸曲处理组作为对照组;按比例1∶9、1∶1、3∶1、9∶1和99∶1接种霉菌孢子悬液和芽孢杆菌菌悬液的麸曲处理组为实验组,总接种量为1 mL;30 ℃培养72 h后进行麸曲的霉菌孢子数、芽孢杆菌数和糖化力测定。
(3)复合菌麸曲培养温度的确定按照霉菌、芽孢杆菌种子液最佳接种比例,总接种量为1 mL,在此水平下设置不同培养温度梯度,分别于28、30、32、34和37 ℃,恒温培养72 h后测定复合菌麸曲的霉菌孢子数、芽孢杆菌数和糖化力。
(4)复合菌麸曲培养时间的确定按照霉菌、芽孢杆菌种子液最佳接种比例,总接种量为1 mL,在此水平下设置不同时间培养梯度,分别于30 ℃恒温培养40、48、60、72和96 h后对复合菌麸曲的霉菌孢子数、芽孢杆菌数、糖化力测定。
(5)霉菌和芽孢杆菌接种时间差的确定按照霉菌、芽孢杆菌种子液最佳接种比例,总接种量为1 mL,在此水平下设置不同接种方式,接种方式为先将霉菌孢子悬液接入到麸皮中,产乙偶姻芽孢杆菌菌悬液与霉菌接种时间间隔为0、12、24、36、48和60 h,30 ℃恒温培养72 h后进行复合菌麸曲的霉菌孢子数、芽孢杆菌数和糖化力测定。以上试验重复3次。
1.4.4.2 Box-Behnken响应面分析
根据单因素试验结果,选择因素和水平,以霉菌孢子数、芽孢杆菌活菌数和糖化力为响应值,采用Box-Behnken法优化制备复合菌麸曲的条件。
1.4.5 数据处理
使用Microsoft Excel 2019进行计算,软件SPSS 19.0进行显著性分析,P<0.05为显著差异。
2 结果与分析
2.1 产酸性糖化酶霉菌的筛选与鉴定
2.1.1 产酸性糖化酶霉菌的初筛情况
自醋曲源218株霉菌中筛选得到的水解淀粉能力相对较强的18株霉菌,其透明圈与菌落直径比值均大于0.8(介于0.83~1.05)。
2.1.2 产酸性糖化酶霉菌的复筛情况
18株产酸性淀粉酶霉菌糖化力如图1所示,SFM-1霉菌麸曲糖化力水平可达(2 524.15±120.00) U/g干醅,在初筛菌株中的糖化力水平突出,而SQM-18与SQM-14的麸曲糖化力水平次之,分别为(2 046.71±33.75)、(1 973.34±50.69) U/g干醅。选取其中糖化力水平较高的12株霉菌测定麸曲的生淀粉糖化力水平。
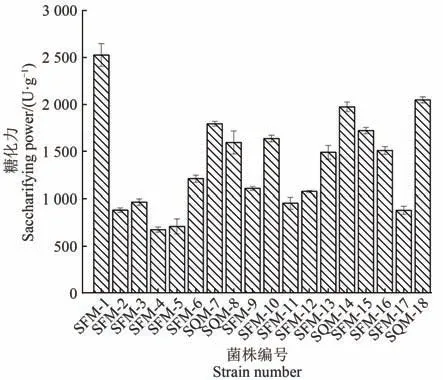
图1 霉菌麸曲的酸性淀粉糖化酶活力Figure 1 Activity of acid glucoamylase in mouldy bran
2.1.3 产酸性生淀粉糖化酶霉菌的筛选情况
对12株霉菌麸曲的生淀粉糖化酶活力测定,测得SQM-14霉菌麸曲为12株霉菌麸曲中的生淀粉糖化酶活力最强,达到(333.53±14.15) U/g干醅,而SFM-1霉菌麸曲生淀粉糖化酶活力适中,为205.38±3.30 U/g干醅。考虑到SFM-1产酸性糖化酶属于较高水平[25,31],且综合霉菌麸曲的糖化力与生淀粉糖化力结果,选择作为试验菌株进行鉴定与复配试验。
2.1.4 霉菌SFM-1的鉴定
霉菌SFM-1菌落形态特征如图2(a~d)所示。培养初期,菌丝在培养基上匍匐生长,呈白色;培养中期,菌丝遍布整个平板,呈棉絮状;培养末期,菌落大而疏松并且菌丝顶端颜色逐渐加深,出现黑色孢子。霉菌SFM-1在光学显微镜(10 × 10)下的形态特征如图2(e~f)所示。霉菌的匍匐菌丝清晰可见,有发达假根,孢囊梗无分支,孢子囊为球形黑色。由图3知,霉菌SFM-1与米根霉(HQ897687.1、DQ119031.1、EU862186.1、DQ641279.1)同源性达到99%。结合菌株形态学判断,确定SFM-1为米根霉。米根霉被认为是安全的菌种(GRAS),具有较强的淀粉酶活力,能参与代谢酒精与蛋白质[32]。

图2 霉菌SFM-1不同时期的菌落形态及显微形态(100×)Figure 2 The colonial morphology and magnification morphology of SFM-1 at different times (100×)

图3 SFM-1菌株基于ITS基因序列的系统发育树Figure 3 The phylogeny tree based on ITS sequence of strain SFM-1
2.2 产乙偶姻芽孢杆菌的筛选与鉴定
2.2.1 产乙偶姻芽孢杆菌的初筛情况
以V-P显色反应(Voges Proskauer反应,V-P)为基准,从醋曲源128株芽孢杆菌中筛选出了8株反应明显的菌株作为产乙偶姻芽孢杆菌复筛菌株:SAU-1、SAU-2、SAU-3、SAU-4、SAU-5、SAU-6、SAU-7、SAU-8,其OD520nm值在0.410~0.474。
2.2.2 产乙偶姻芽孢杆菌的复筛情况
对8株芽孢杆菌发酵产物中乙偶姻含量进行测定。其中,SAU-1、SAU-4菌株产乙偶姻能力在初筛菌株中相对突出,乙偶姻产量分别为(15.296±0.334)、(14.018±0.312) g/L,在醋源菌株中少见报道[28]。因此选择SAU-1、SAU-4进行菌株鉴定并作为复配试验备用菌。
2.2.3 产乙偶姻芽孢杆菌SAU-1、SAU-4的鉴定结果
(1) 菌株SAU-1、SAU-4的形态特征
图4是芽孢杆菌SAU-1、SAU-4在LB固体培养基上的菌落形态特征及显微镜下细胞形态。二者菌落形态相似,菌落形状均为圆形、微凸,表面存在褶皱,质地呈膜状,菌落颜色呈淡黄色(图4A)。SAU-1、SAU-4菌株通过革兰氏染色后在显微镜下细胞形态均呈短杆状且为紫色,说明为革兰氏阳性菌;对2株菌进行芽孢染色,观察到呈红色的菌体以及呈绿色的芽孢(图4B)。

图4A 芽孢杆菌SAU-1(a)、SAU-4(b)菌落形态Figure 4A Colonial morphology of SAU-1(a) and SAU-4(b)
(2) 菌株SAU-1、SAU-4的分子生物学鉴定结果
由图5知,芽孢杆菌SAU-1、SAU-4与贝莱斯芽孢杆菌(MK203035.1、MT626060.1)同源性达到100%。结合形态学鉴定结果,确定SAU-1、SAU-4为贝莱斯芽孢杆菌。贝莱斯芽孢杆菌是2005年确定的芽孢杆菌新种[33],能产生抗菌肽等抑菌物质,具有良好的生物防治功能,同时可产生蛋白酶、淀粉酶等多种水解酶类,且安全性好,近年来常被应用于食品、医药和农业等领域[34]。
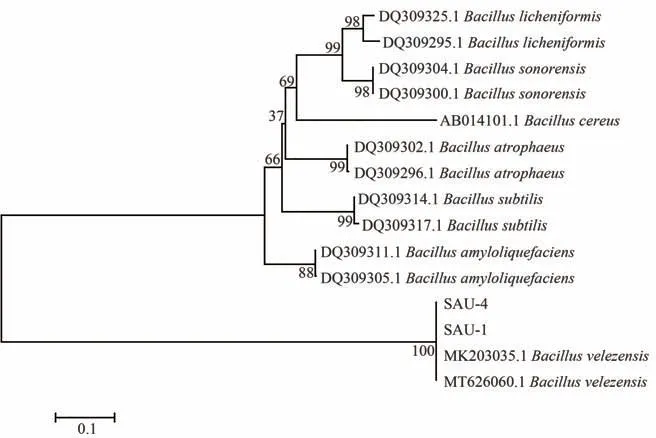
图5 芽孢杆菌SAU-1、SAU-4菌株基于16S rDNA基因序列的系统发育树Figure 5 The phylogeny tree based on 16S rDNA sequence of bacillus SAU-1 and SAU-4
2.3 平板对峙试验
芽孢杆菌SAU-1、SAU-4与霉菌SFM-1在平板中生长情况分别如图6所示。由图6(b)显示,芽孢杆菌SAU-4与霉菌SFM-1存在明显抑菌圈,图6(a)显示芽孢杆菌SAU-1与SFM-1几乎不形成生长抑制,判断SAU-1与SFM-1间无拮抗作用。故初步选择SAU-1与SFM-1为复配菌株。

图6 芽孢杆菌SAU-1、SAU-4与霉菌SFM-1平板共生长结果Figure 6 Co-cultivation results of SAU-1, SAU-4 and SFM-1 on PCA medium
2.4 优化的复合菌麸曲制备工艺条件
2.4.1 单因素实验
2.4.1.1 接种比例对复合菌麸曲的影响霉菌SFM-1与芽孢杆菌SAU-1接种比例对复合菌麸曲的影响如图7(A)所示。结果显示,芽孢杆菌活菌数随SFM-1与SAU-1接种比例增大而出现减少趋势;霉菌孢子数随接种比例增大而出现先增多后减少的趋势;在接种比例为9∶1时,麸曲中糖化力(3 090.89±130.02) U/g干醅,高于其他复配比例处理组(包括霉菌纯种麸曲),说明SFM-1与SAU-1在适宜的复配比例情况下有利于增强麸曲糖化活力。

图7 不同培养条件对霉菌SFM-1与芽孢杆菌SAU-1制备复合菌麸曲效果的影响Figure 7 Effects of different culture conditions on bran Qu of compound bacteria prepared by SFM-1 and SAU-1
2.4.1.2 培养温度对复合菌麸曲的影响
SFM-1与SAU-1以9∶1的复配比例接种于麸皮培养基中,不同培养温度对复合菌麸曲的影响如图7(B)所示。结果显示,随着温度提升,麸曲中SFM-1霉菌孢子数和SAU-1活菌数均呈现先增大后减少的趋势,SFM-1在以32 ℃条件培养时为最佳产孢温度,SAU-1的活菌数在培养条件为34 ℃时达到最大值;当培养温度为28 ℃时,麸曲中糖化力最高,为(3 049.71±273.85) U/g干醅。
2.4.1.3 培养时间对复合菌麸曲的影响
SFM-1与SAU-1以9∶1的复配比例接种于麸皮培养基中,不同培养时间对复合麸曲的影响如图7(C)所示。结果显示,随培养时间延长,麸曲中SFM-1霉菌孢子数与SAU-1活菌数均呈现先增长后减少的趋势;培养时间60 h,麸曲中SFM-1霉菌孢子数达到最大值,培养时间72 h,麸曲中SAU-1活菌数最大,并且,在该培养时间下,麸曲糖化力可达到(2 988.52±132.24) U/g干醅。
2.4.1.4 接种方式对复合菌麸曲的影响
SFM-1与SAU-1以9∶1的复配比例按不同接种时间接种于麸皮培养基中,得到霉菌SFM-1与芽孢杆菌SAU-1接种时间差对复合菌麸曲的影响结果。结果如图7(D)所示,随SFM-1与SAU-1接种间隔时间延长,SFM-1霉菌孢子数和SAU-1活菌数整体均呈现下降的趋势,也一定程度上说明SFM-1与SAU-1之间有促生长作用。当SFM-1与SAU-1接种时间相差48 h时,得到的麸曲中糖化力最高,为(3 416.81±83.01) U/g干醅。
2.4.2 Box-Behnken响应面分析
2.4.2.1 响应面分析的因素与水平
基于单因素实验结果,利用Design-Expert软件进行4因素3水平的响应面分析。合适的生物量是复合菌麸曲在醋醅发酵中发挥强化作用的基础,而麸曲作为固态食醋酿造过程中的发酵剂和糖化剂,糖化力是衡量麸曲品质重要指标,因此以麸曲糖化力作为响应面分析因素水平选择主要依据。实验设计因素与水平见表1。
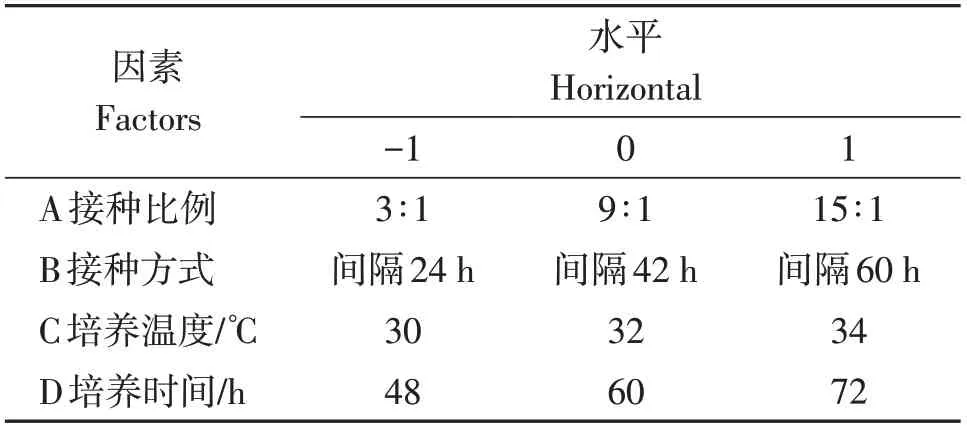
表1 复合菌麸曲优化的响应面分析因素水平表Table 1 Response surface analysis factor level table of compound bran koji
2.4.2.2 响应模型的构建与检验
麸曲优化试验结果见表2。利用表2中得到的数据进行多元回归拟合,确定霉菌孢子数与(A)、(B)、(C)、(D)的二元多项式回归方程模型为:Y=-8.332×109+2.310A×108+2.241B×108+7.543C×108-3.822D×108-7.980AB×105-6.234AC×106-2.188AD×105-4.727BC×106-1.155BD×106+4.740CD×106+2.495A2×108-7.692B2×104-1.093C2×107+2.663D2×108;芽孢杆菌活菌数与(A)、(B)、(C)、(D)的二元多项式回归方程模型为:Y=-1.888×1 011-4.827A×108+1.450B×109+1.656C×1010-4.111D×109+7.117AB×106-2.453AC×106+2.758AD×106-2.757BC×107-5.793BD×106+6.576CD×107+2.900A2×106-4.264B2×106-2.921C2×108+2.232D2×107;糖化力水平与(A)、(B)、(C)、(D)的二元多项式回归方程模型为:Y=48 137.523+254.376A-2.362B-2295.966C-242.675D-2.132AB-3.263AC-2.466AD-0.380BC+0.484BD+2.550CD+5.619A2+9.709B2×10-3+32.165C2+1.355D2。根据回归方程线性项系数可知,各因素对麸曲产孢能力、芽孢杆菌活菌数、糖化力的影响由大到小依次分别为:C>D>A>B、C>D>B>A、C>A>D>B。

表2 响应面试验结果Table 2 The results of response surface test
方差分析结果(表略)表明,各响应值试验模型均具有显著性(P<0.01或P<0.05),具体是:①霉菌孢子的响应面试验方差分析结果为因素B、C、D、BC、BD、D2有显著性;②芽孢杆菌数量的响应面试验方差分析结果为因素B、C、D、B2、D2有显著性;③糖化力的响应面试验方差分析结果为因素C、AB、A2、D2有显著性。各失拟项均不显著(P>0.05),表明回归方程与试验数据相配合,该回归方程拟合得到的最优条件是可靠的。
2.4.2.3 复合菌麸曲优化条件的确定及验证
实验通过Box-Behnken响应面分析结果,综合考虑麸曲中SFM-1孢子数、SAU-1活菌数以及麸曲糖化力三水平,得到复合菌麸曲的最优制备方式:SFM-1与SAU-1接种比例为15∶1、接种间隔24 h、培养温度为31 ℃、培养时间为72 h。优化条件后的复合菌麸曲中霉菌孢子数lg值为(8.94±0.05) 个/g、芽孢杆菌活菌数lg值为(9.78±0.17) CFU/g、糖化力为(3 388.56±82.62) U/g干醅,与模拟值中的霉菌孢子数lg值(9.27 个/g)、芽孢杆菌活菌数(10.17 CFU/g)、糖化力(3 512.61 U/g干醅)之间的相对偏差分别为3.56%、3.83%和3.52%,证明该模型可靠,同时验证了数学回归模型的合理性[35-36]。
3 结论
本研究从醋曲218株霉菌和128株细菌中初筛得到18株分解淀粉能力较强的霉菌及8株产乙偶姻能力较强的芽孢杆菌,在后续进一步复筛中,并利用形态学与分子生物学结合的鉴定方法,同时与已有文献比较,从醋曲中得到一株高产酸性糖化酶米根霉SFM-1和一株高产乙偶姻贝莱斯芽孢杆菌SAU-1,二者无拮抗作用。
利用单因素和响应面设计优化复合菌麸曲制备工艺,确定菌株SFM-1与SAU-1接种比例为15∶1、间隔接种时间为24 h、培养温度为31 ℃、培养时间为72 h时,复合菌麸曲的生物量与糖化力可同时达到最佳水平,该培养条件下霉菌孢子数lg值、芽孢杆菌活菌数lg值、糖化力水平分别为:8.94 个/g、9.81 CFU/g、3 388.56 U/g干醅。本研究筛选得到一株高产酸性糖化酶米根霉和一株高产乙偶姻贝莱斯芽孢杆菌,并优化出复合麸曲最佳制备工艺,可为大曲功能菌的开发与复合菌麸曲制备提供了数据参考。
