不同菠萝叶渣添加量对赤灵芝发酵基质营养成分及体外抗氧化活性研究
2024-03-09刘义军李盖林丽静刘佳梦陈嘉恩黎智韵陈港
刘义军,李盖,林丽静,刘佳梦,陈嘉恩,黎智韵,陈港*
(1.华南理工大学轻工科学与工程学院,广州 510641;2.中国热带农业科学院农产品加工研究所海南省果蔬贮藏与加工重点实验室,广东 湛江 524001;3.广东收货罐头食品有限公司,广东 湛江 524100)
菠萝是我国重要的热带水果,主要分布在广东、海南、广西和云南省等,全国种植面积突破6.7万hm2[1]。菠萝果实采收后,其副产品(如菠萝根、茎和叶)大多被粉碎并返回农田,利用程度较少[2-3]。菠萝叶渣是指菠萝叶通过机械刮麻获得纤维后的剩余物。由于菠萝叶渣含丰富的碳水化合物、菠萝蛋白酶等成分,菠萝叶渣具有良好的适口性和消化性能,有助于提高猪和羊等畜禽的生长性能、营养物质消化率[4-5]。此外,产沼气微生物可以将菠萝叶渣中碳水化合物转化为丁醇、甲烷等[6],因此其具有广阔的应用前景。然而,如何提高菠萝叶渣的附加值,如何提高菠萝叶渣的利用率是迫切需要研究的问题。
灵芝是中国著名的药用和食用真菌,其生长需要碳、氮、无机盐和维生素等营养成分[7]。碳是至关重要的成分,为菌丝生长提供能量,但也参与菌丝体中维生素、蛋白质和氨基酸的形成[8]。氮对灵芝菌丝体的生长也是必需的,灵芝菌丝体主要吸收还原态的含氮化合物,如氨基酸、蛋白质、尿素、氨、铵盐和硝酸盐[9]。相关研究结果表明,热处理、超声波处理、NO浓度、氮源浓度等因素都会影响灵芝生长过程中相关功能基因的表达,导致代谢产物的显著差异。pH值调节三萜类化合物、细胞内和细胞外多糖、菌丝体蛋白质和其他发酵代谢产物的分泌及其抗氧化活性[10]。NO可以调节甲羟戊酸途径基因的表达,促进灵芝中三萜类化合物含量的增加[11]。锰离子可以提高灵芝子实体中锰过氧化物酶的活性,如儿茶酚和棕榈酰乙醇酰胺[12]。超声波处理导致菌丝体代谢和转录水平的显著变化[13]。高温胁迫导致与蛋白质组装、运输和降解、能量代谢等相关的基因上调和下调。热胁迫后,灵芝子实体激活蛋白质组装等过程,促进多糖产量显著增加[14]。氮源的浓度可以影响灵芝中AreA转录因子的表达,AreA转录因子在灵芝的生长、次生代谢和抗细胞壁胁迫中起重要作用[15]。
菠萝叶渣富含蔗糖等快速碳源,以及钙、镁等氨基酸、维生素和微量金属元素[16-17],可作为营养添加剂促进G.lucidum菌丝体生长,增加菌丝体蛋白含量[18]。中国菠萝叶渣年产量巨大,例如,中国广东省每年超过20万t。如果菠萝叶渣经上述方法利用后,其附加值可提高15美元/t,当地菠萝产业将获得300万美元的收益,同时还可以缓解大量皮渣释放到道路、田间等造成环境问题。氮源和碳源的种类和含量对灵芝的生长有影响。菠萝叶渣含有灵芝快速生长所需的快速碳源(包括葡萄糖)和快速氮源(包括氨基酸)。与传统栽培基质相比,灵芝的代谢途径会发生变化。因此,刺激营养物质的含量也会随着菠萝叶渣添加量的不同而发生变化,从而导致灵芝代谢物质的种类和含量发生变化,由于不同菠萝叶渣添加量对赤灵芝发酵基质营养成分及体外抗氧化活性效果尚不清楚,因此本研究采用灵芝进行固态发酵,使灵芝菌丝体在培养基质中生长,以获得大量的灵芝菌丝体。通过分析不同比例菠萝叶发酵灵芝后其基质中主要营养成分分析、氨基酸分析以及基质中差异性氨基酸挖掘,探讨固态发酵对赤灵芝发酵基质营养成分以及体外抗氧化的影响,为菠萝叶渣的进一步开发利用提供参考。
1 材料和方法
1.1 材料与仪器
1.1.1 试验材料与菌株
菠萝叶渣(菠萝品种为‘巴里’)来源于海南省果蔬贮藏与加工重点实验室机械刮纤维后剩余的副产物,菠萝叶渣C/N比为185,含水量85%;赤灵芝原种从江苏高邮食用菌研究所购买;玉米粒从粮油批发市场购得。
总抗氧化能力(T-AOC)/铁还原能力试剂盒(FRAP法)、DPPH自由基清除能力、羟自由基清除能力试剂盒,苏州格锐思生物科技有限公司。牛磺酸、蛋氨酸砜、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、胱氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、组氨酸、赖氨酸、精氨酸和脯氨酸等氨基酸标准品浓度为100 nmol/mL,德国曼默博尔公司。
1.1.2 试验仪器与设备
YXQ-LS-50S 立式压力蒸汽灭菌锅(上海博讯实业有限公司);Millrock ST85B3冷冻干燥机(美国Millrock公司);A300全自动氨基酸分析仪(德国曼默博尔公司);DHG-9140A电热恒温鼓风干燥箱(上海林频仪器股份有限公司)。
1.2 试验方法
1.2.1 样品制备
将菠萝叶渣、玉米粒等按照一定比例(菠萝叶渣比例为0%、10%、12.5%、25%、50%)混合均匀,调节物料的水分含量至55%(干基),然后装入17×33×0.05的聚丙烯袋中,盖上海绵菌盖套环,得到菌棒。菌棒置于121 ℃灭菌锅中灭菌30 min,待温度降低至80 ℃取出,冷却至室温。已完全冷却好的菌棒,在接种箱中采用烟雾消毒剂(有效成分为二氯异氰尿酸钠,有效率330~400 g/kg)消毒30 min,接入已培养好的2%赤灵芝固态菌种,接种后的灵芝菌棒在24~28 ℃暗光培养,待发酵菌丝体长满菌袋后,取出,置于-40 ℃下冻干,即得赤灵芝发酵基质,粉碎后置于4 ℃保存待用。
1.2.2 总萜含量的测定
赤灵芝发酵基质中总萜含量的测定参考刘等[19]所述方法,略有修改。精密吸取浓度为0.2 mg/mL的齐墩果酸对照品溶液0.1、0.2、0.3、0.4和0.5 mL置于15 mL具塞试管中,依次加入0.2 mL 0.05 g/mL的香草醛冰醋酸溶液、0.8 mL高氯酸,充分混匀,在70 ℃水浴中加热15 min,立即取出,冰浴中冷却5 min,取出,加入4 mL乙酸乙酯,充分摇匀。以相应试剂作为空白,546 nm处测量吸光度,以吸光度(A)为纵坐标,质量浓度(c, μg/mL)为横坐标,得到标准曲线回归方程A=0.049 5c-0.045 4,R2=0.991 2。称取2 g赤灵芝发酵基质粉末置于具塞锥形瓶中,加乙醇50 mL,超声处理(功率140 W,频率42 kHz)45 min,过滤,滤液置100 mL量瓶中,用适量乙醇,分次洗涤滤器和滤渣,洗液并入同一量瓶中,加乙醇置刻度,摇匀,取0.2 mL提取液参考上述标准曲线制备方法,测量溶液中齐墩果酸含量。
1.2.3 多糖含量的测定
赤灵芝发酵基质中多糖含量的测定参考刘均发等[20-22]所述方法,略有修改。分别吸取0.1、0.2、0.4、0.6、0.8和1.0 mL葡萄糖标准溶液(0.1 mg/mL)于10 mL比色管中,补水至1.0 mL,加入0.5 mL 5%苯酚和2.5 mL浓硫酸,旋涡振荡20 s,然后100 ℃水浴15 min,冷却至室温,于490 nm处测定吸光值,以1.0 mL纯水按同样显色操作为空白,以葡萄糖含量(C, μg/mL)为横坐标,吸光值(A)为纵坐标,葡萄糖标准曲线为A=0.009 8C+ 0.036 3,R²=0.993。称取发酵基质粉末样品1 g放入具塞试管中,按料液比1∶40加入水,90 ℃水浴3 h,5 000 r/min离心15 min,取上清液,加入5倍量无水乙醇,于4 ℃冰箱中静置过夜,沉淀物加水溶解,定容于100 mL容量瓶中,即得样品多糖溶液。取0.05 mL样品多糖溶液于25 mL具塞试管中,加入0.5 mL 5%苯酚溶液和2.5 mL浓硫酸溶液,旋涡振荡20 s,100 ℃水浴15 min,冷却至室温,于490 nm处测定吸光值,平行测定3次。根据标准曲线,计算样品多糖含量。
1.2.4 粗纤维含量的测定
参考GB/T 8310—2013《茶粗纤维测定》方法。
1.2.5 水解氨基酸的测定
称取发酵基质0.150 00 g(精确至0.02 g)于水解管中加入15 mL HCl溶液(水∶HCl=1∶1),置于110 ℃烘箱中水解24 h,待冷却后过滤,滤液定容于25 mL容量瓶中,取1 mL于10 mL离心管中氮吹干,加入2 mL样品稀释液,漩涡震荡使其充分溶解,后用注射器吸取,过0.22 μm有机相滤头加至进样瓶中,置于-20 ℃保存待用。
水解氨基酸测定采用T749-7N型钠盐分离柱(4.0 m×125 mm),V603N型除氨柱。仪器测定过程中柱温箱温度范围30~70 ℃,分析流速250 μL/min,进样体积20 μL,反应器温度115 ℃,检测波长为570 nm和440 nm。
1.2.6 游离氨基酸的测定
称取发酵基质5 g(精确至0.01 g)于50 mL锥形瓶中,加入40 mL 0.01 mol/L盐酸,旋涡混匀5 min,超声提取5 min,定容于50 mL容量瓶中,混匀,避光静置2 h,取5 mL提取液4 000 r/min离心10 min,取1 mL上清液,加入1 mL 4%磺基水杨酸,涡旋1 min,避光静置1 h,12 000 r/min离心20 min,取上清液,0.22 μm有机相滤头过滤,加至2 mL进样瓶中,置于-20 ℃保存待用。
游离氨基酸测定采用T735-7型锂盐分离柱(4.0 m×125 mm),V602型除氨柱。仪器测定过程中柱温箱温度范围30~70 ℃,分析流速250 μL/min,进样体积20 μL,反应器温度115 ℃,检测波长为570 nm和440 nm。
1.2.7 体外抗氧化活性的测定
总抗氧化能力(T-AOC)的测定、DPPH自由基清除能力的测定和羟自由基清除能力的测定采用刘等[20]所述方法。
1.3 数据分析
采用德国曼默博尔公司的Aminopeak谱图软件对游离氨基酸和水解氨基酸数据进行分析。采用SPSS 20.0对表中数据进行统计分析及显著性分析。采用OriginPro 2021、SIMCA 14.1和Photoshop进行OPLS-DA模型验证、S-plot图绘制、柱形图以及Venn diagram的绘图等。
2 结果与分析
2.1 不同菠萝叶渣添加量下赤灵芝发酵基质中主要营养成分分析
由图1可知,不同菠萝叶渣添加量所得赤灵芝发酵基质中粗纤维含量为55%~61%,与未添加菠萝叶渣相比,发酵基质粗纤维含量是降低的,可能源于赤灵芝生长过程中将栽培基质中粗纤维转化为自身代谢所需的糖类等其他物质[17-18]。菠萝叶渣添加量为25%时,粗纤维含量有最大值,为57.84%。显著性分析结果表明,不同菠萝叶渣添加量对粗纤维含量的差异性不显著。发酵基质中总糖含量为19%~37%,其中10%~25%所得发酵基质中总糖与空白对照相比存在显著性差异,且菠萝叶渣添加量为12.5%时,多糖含量有最大值,为37.36%。总萜含量呈现出先增加后减少的趋势,12.5%~50%与所得发酵基质中总萜与空白对照相比存在显著性差异。蛋白质含量呈现出先减少后增加的趋势,10%~50%与所得发酵基质中蛋白质含量与空白对照相比存在显著性差异。
2.2 不同菠萝叶渣添加量下赤灵芝发酵基质中氨基酸分析
由表1可知,发酵基质中水解氨基酸主要由牛磺酸和苏氨酸等19种氨基酸组成,其中必需氨基酸17种、非必需氨基酸1种,甲硫氨酸氧化产物1种。随着菠萝叶渣添加量的增加,氨基酸含量整体呈现先降低后增加的趋势。水解氨基酸主要以亮氨酸、丝氨酸、谷氨酸、脯氨酸、甘氨酸等组成,异亮氨酸含量最高。显著性分析结果表明,与未添加菠萝叶渣相比,发酵基质中赖氨酸和甘氨酸含量存在显著性差异。脯氨酸差异不显著,说明菠萝叶渣添加量对赖氨酸和甘氨酸代谢路径具有显著的调节作用。对脯氨酸代谢路径不具备显著的调节作用。

表1 不同菠萝叶渣添加量下赤灵芝发酵基质中氨基酸种类Table 1 The amino acids in fermentation substrate of Ganoderma lucidum with different addition of pineapple leaf residue
由表1可知,发酵基质中游离氨基酸主要由天冬酰胺、鹅肌肽、谷氨酸、丙氨酸和精氨酸等29种游离氨基酸组成。随着菠萝叶渣添加量的增加,肌氨酸、a-氨基己二酸呈现出增加的趋势,其他氨基酸整体上呈现出下降的趋势。显著性分析结果表明,与未添加菠萝叶渣相比,发酵基质中天冬氨酸、苏氨酸、丝氨酸、γ-氨基正丁酸、组氨酸、3-甲基-L-组氨酸、鸟氨酸和精氨酸等8种游离氨基酸含量存在显著性差异,说明在菠萝叶渣作用下,上述8种游离氨基酸作为合成蛋白质的中间体异常活跃。
2.3 不同菠萝叶渣添加量下赤灵芝发酵基质中差异性氨基酸挖掘
采用OPLS-DA结合S-plot图进一步挖掘不同菠萝叶渣添加量下赤灵芝发酵基质中的差异性氨基酸。不同菠萝叶渣添加量下赤灵芝发酵基质中差异氨基酸OPLS-DA的分数散点情况如图2(A)所示,置换检验结果如图2(B)所示。由图2A可知,OPLS-DA模型中R2X=0.838,R2Y=0.807,Q2=0.557,其中R2X=0.838表示该模型对X矩阵数据的解释度为83.8%的数据变化,R2Y=0.807表示该模型对Y矩阵数据的解释度为80.7%,Q2大于0.5,说明该模型可接受[23]。由图2B可知,模型经过200次交叉验证后,模型过程中,R2和Q2均低于1.0,且Q2回归线与横坐标交叉,且与纵坐标交叉的截距小于0,说明该模型没有出现过拟合[23]。同时交叉验证分析结果中显著性概率小于0.05,说明该模型稳定可靠,具有统计学意义。由图2A可知,菠萝叶渣添加量为0%、10%、12.5%、25%和50%彼此之间,且与其他样本之间都具有较好的分散度。当菠萝叶渣添加量大于12.5%时,发酵基质所产生的氨基酸差异性越来越小。
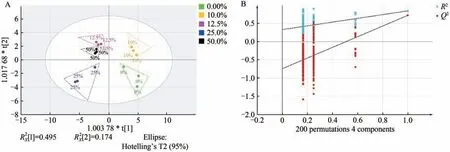
图2 不同菠萝叶渣添加量下赤灵芝发酵基质中氨基酸得分Figure 2 The scores of amino acids under different pineapple leaf residue addition
S-plot图用于挖掘两组发酵基质中差异性氨基酸,差异显著的变量分布在“S”两端,差异较小的变量聚集在原点附近[24]。菠萝叶渣添加量0与10%、0与12.5%、0与25%、0与50%、10%与12.5%以及12.5%与25%的S-plot图分别如图3A、3B、3C、3D、3E和3F所示,且图中红点表示VIP>1的氨基酸,又称之为差异显著的氨基酸。由图3A可知,10%菠萝叶添加量与0%相比,存在谷氨酸(25,游离氨基酸)、脯氨酸(19,水解氨基酸)、天冬氨酰(24,游离氨基酸)、异亮氨酸(12,水解氨基酸)和精氨酸(18,水解氨基酸)等19种VIP大于1的差异性氨基酸成分,其中谷氨酸(25,游离氨基酸)的差异最为显著(VIP>2)。由图3B可知,12.5%菠萝叶添加量与0%相比,存在3-甲基-L-组氨酸(43,游离氨基酸)、苯丙氨酸(38,游离氨基酸)、亮氨酸(36,游离氨基酸)、丝氨酸(5,水解氨基酸)和苯丙氨酸(15,水解氨基酸)等35种VIP大于1的差异性氨基酸成分。由图3C可知,25%菠萝叶添加量与0%相比,存在苯丙氨酸(38,游离氨基酸)、天冬氨酸(21,游离氨基酸)、苏氨酸(22,游离氨基酸)、牛磺酸(20,游离氨基酸)和3-甲基-L-组氨酸(43,游离氨基酸)等25种VIP大于1的差异性氨基酸成分。由图3D可知,50%菠萝叶添加量与0%相比,存在鹅肌肽(45,游离氨基酸)、亮氨酸(36,游离氨基酸)、丙氨酸(30,游离氨基酸)、缬氨酸(10,水解氨基酸)和异亮氨酸(12,水解氨基酸)等20种VIP大于1的差异性氨基酸成分。由图3E可知,10%菠萝叶添加量与12.5%相比,存在苏氨酸(22,游离氨基酸)、酪氨酸(37,游离氨基酸)、丝氨酸(23,游离氨基酸)、天冬氨酸(21,游离氨基酸)和3-甲基-L-组氨酸(43,游离氨基酸)等30种VIP大于1的差异性氨基酸成分。由图3F可知,12.5%菠萝叶添加量与25%相比,存在牛磺酸(20,游离氨基酸)、鸟氨酸(46,游离氨基酸)、赖氨酸(17,水解氨基酸)、苏氨酸(22,游离氨基酸)和甲硫氨酸(11,游离氨基酸)等25种VIP大于1的差异性氨基酸成分。
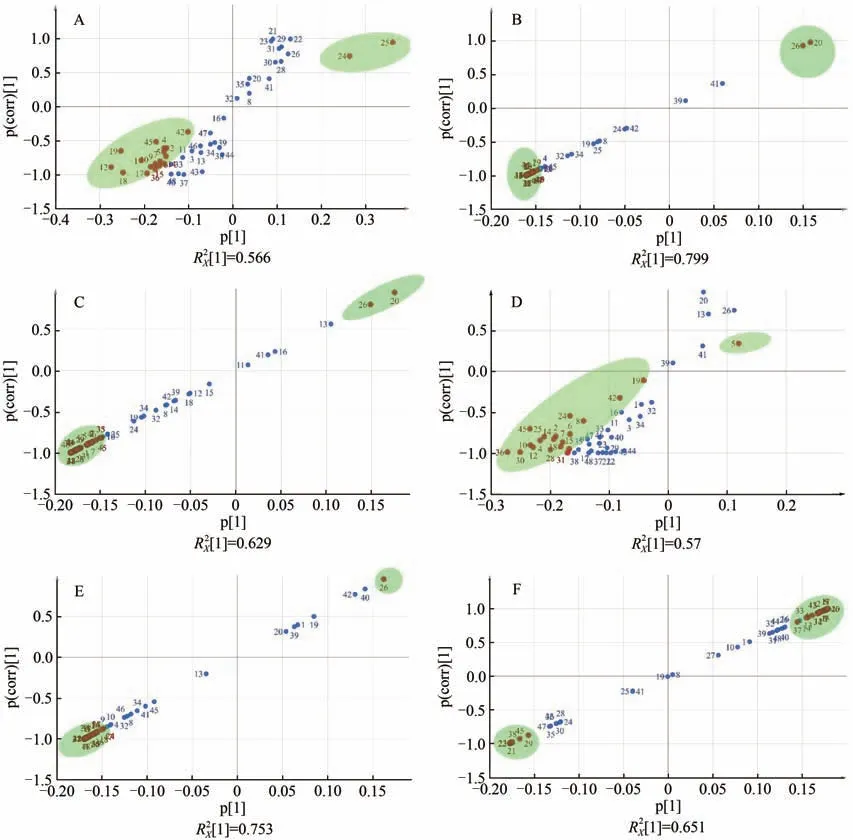
图3 不同菠萝叶渣添加量下赤灵芝发酵基质中氨基酸的S-plot图Figure 3 The S-plot of amino acids in Ganoderma lucidum fermentation substrate
由图4A可知,随着菠萝叶渣添加量的增加,发酵基质中差异性氨基酸个数呈现出先增加后降低的趋势。Venn图被用于挖掘不同样本之间是否存在交叉性,不同菠萝叶渣发酵基质中差异性氨基酸所得Venn图如图4B所示。由图4B可知,12.5%存在6种特有差异性氨基酸成分,25%存在1种特有差异性氨基酸成分,50%存在1种特有差异性氨基酸成分。4组样本共有差异性成分7种(1111)。10%与12.5%、25%、50%分别存在共有且特有差异性氨基酸成分2种、0种、5种。12.5%与25%、50%分别存在13种(0110)和1种(1010)共有且特有差异性氨基酸成分。25%与50%不存在共有且特有差异性氨基酸成分。说明,随着菠萝叶添加量的增加,差异性氨基酸数量差异越来越小。
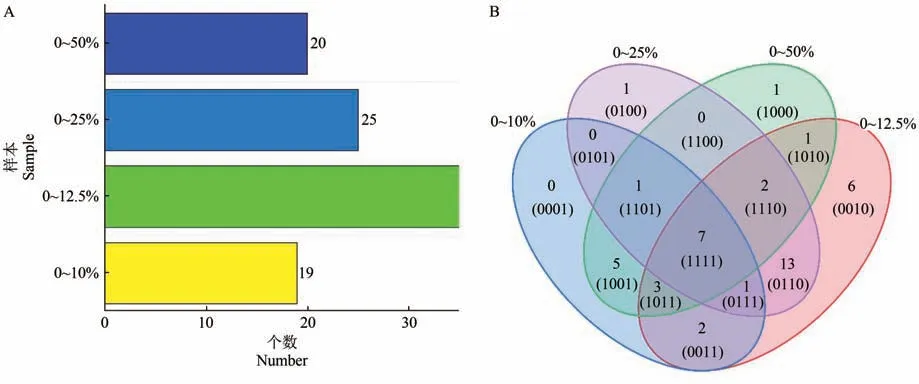
图4 不同菠萝叶渣添加量下赤灵芝发酵基质中差异氨基酸种类图(A)和Venn图(B)Figure 4 The number of different aminos (A) and Venn diagram (B) in the fermentation substrate of G.lucidum with different pineapple leaf residues
0010表示化合物11、37、27、3、40和13。0011表示化合物1和9。0100表示化合物33。0110表示化合物43、38、21、48、22、23、20、47、44、35、46、26和29。0111表示化合物17。1000表示化合物8。1001表示化合物25、19、24、4和42。1010表示化合物31。1011表示化合物2、6和14。1101表示化合物45。1110表示化合物30和28。1111表示化合物12、18、10、5、7、36和15。
0010表示11、37、27、3、40和13。0011表示1和9。0100表示33。0110表示43、38、21、48、22、23、20、47、44、35、46、26和29。0111表示17。1000表示8。1001表示25、19、24、4和42。1010表示31。1011表示2、6和14。1101表示45。1110表示30和28。1111表示12、18、10、5、7、36和15。
2.4 不同菠萝叶渣添加量下赤灵芝发酵基质水提物体外抗氧化活性分析
由表2可知,当菠萝叶渣添加量为12.5%时,羟基自由清除能力有最大值(58.51%),且与10%、25%所得赤灵芝发酵基质水提物的羟基自由基清除能力差异不显著,与50%和0%所得赤灵芝发酵基质水提物的羟基自由基清除能力差异显著。当菠萝叶渣添加量为50%时,总抗氧化能力有最大值(0.27 μg Trolox/mL),与0%和10%所得赤灵芝发酵基质水提物的总抗氧化能力差异显著,与12.5%和25%所得发酵基质水提物的总抗氧化能力差异不显著。添加菠萝叶渣有助于提高赤灵芝发酵基质水提物的羟基自由基清除能力和总抗氧化能力,降低DPPH自由基清除能力。
3 讨论
氮源、碳源和无机盐等营养成分是灵芝生长所必须的营养成分,其种类和含量对灵芝的生长有影响[7]。菠萝叶渣含葡萄糖、蔗糖、钙、镁等氨基酸、维生素和微量金属元素[17]等促进灵芝快速生长的营养,本研究中菠萝叶渣添加量不同,发酵基质中粗纤维、总糖、总萜、总蛋白等营养成分发生不同程度的变化规律。由于在原有发酵基质中添加不同含量的菠萝叶渣,改变原有栽培基质中碳源、氮源等营养成分的组成和含量,干扰了灵芝菌丝生长过程中的相关代谢路径,导致粗纤维等营养成分呈现出不同的变化规律。与未添加菠萝叶渣相比,发酵基质粗纤维含量是降低的,总萜含量呈现出先增加后减少的趋势,在菠萝叶渣添加量为25%下,总萜含量有最大值,为1.36%。菠萝叶渣添加量为12.5%时,多糖含量有最大值,为37.36%。蛋白质含量呈现出先减少后增加的趋势,但含量均低于未添加菠萝叶渣下蛋白质的含量。
氨基酸可以满足动物需要促进动物生长,提高饲料利用率等[25]。本研究结果表明,发酵基质水解氨基酸和游离氨基酸的差异性因菠萝叶渣的添加量不同而发生变化,整体上菠萝叶渣添加量对赖氨酸和甘氨酸代谢路径具有显著的调节作用,与Liu Y.等[18]研究结果一致。对脯氨酸代谢路径不具备显著的调节作用。赖氨酸被称为生长性氨基酸,是参与合成机体蛋白,包括骨骼肌、多肽激素、血浆蛋白以及酶等多种关键蛋白质,在鱼类饲料、畜禽类等饲料中具有广泛的应用,且也是比较缺乏的氨基酸[26]。菠萝叶渣胁迫下,发酵基质不仅对氨基酸有所保留,同时促进粗纤维等成分转化为功能性三萜等功能性成分,而灵芝总萜在大鼠的高胆固醇饲料中加入灵芝的菌丝体,可显著降低血清和肝脏中胆固醇和甘油三酯的含量[27-28]。同时菠萝叶渣胁迫下,发酵基质不仅营养成分有所改善,抗氧化能力也羟基自由基清除能力和总抗氧化能力显著提高。灵芝发酵菠萝叶渣,可作为抗氧化类功能性食品的生产原料,以提高猪、羊等畜禽的生长性能及营养物质消化率,提高菠萝叶渣的附加值和利用率。上述研究结果可为菠萝叶渣合理利用和开发提供基础数据支撑。
4 结论
菠萝叶渣干扰了赤灵芝菌丝体生长过程中代谢产物氨基酸的释放,且菠萝叶渣添加量不同,基质营养成分及体外抗氧化活性存在差异。菠萝叶渣胁迫下促进赤灵芝发酵基质中粗纤维降解、释放多糖含量;有助于提高赤灵芝发酵基质水提物的羟基自由基清除能力和总抗氧化能力,降低DPPH自由基清除能力对氨基酸组成及氨基酸组成以及相关代谢路径具有不同的调节作用。
