生长激素协同高孕激素促排卵方案对低预后女性体外受精结局的影响
2024-03-08张加能张焕焕王冲
张加能 张焕焕 王冲
[摘要] 目的 旨在探讨生长激素(growth hormone,GH)协同高孕激素促排卵(progesterone-primed ovarian stimulation,PPOS)方案对低预后妇女体外受精(in vitro fertilization,IVF)結局的影响。方法 本研究使用倾向评分匹配(propensity score matching,PSM)分析的回顾性队列研究。对2017年1月至2021年12月期间IVF治疗的女性进行回顾分析。结果 在PSM后,76对IVF结果低预期女性纳入分析。结果显示,与对照组相比,GH协同治疗组的可移植胚胎率升高(P<0.001),获卵数、metaphase Ⅱ(MⅡ)卵率、D1- two-pronuclear(2PN)受精率、优质胚胎比率、临床妊娠率、促性腺激素(gonadotropin,Gn)用量和天数、雌二醇(estradiol,E2)峰值差异无统计学意义。亚组分析显示卵巢储备功能减退女性应用GH可移植胚胎率升高(P=0.010),40岁以下女性MⅡ卵率(P=0.010)和可移植胚胎率(P<0.001)升高。结论 体外受精中,GH对卵母细胞质量和PPOS方案的可移植胚胎率可能存在提高作用,其辅助给药可作为低预后妇女的可选治疗策略。
[关键词] 生长激素;体外受精;高孕激素促排卵;低预后;倾向得分匹配
[中图分类号] R711 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.05.002
Effects of growth hormone co-treatment with progesterone-primed ovarian stimulation protocol on IVF outcomes in women with low prognosis
ZHANG Jianeng, ZHANG Huanhuan, WANG Chong
Reproductive Endocrinology Center, Hangzhou Womens Hospital, Hangzhou 310000, Zhejiang, China
[Abstract] Objective To study the effect of growth hormone (GH) with progesterone-primed ovarian stimulation (PPOS) protocol on in vitro fertilization (IVF) outcomes among women with low prognosis. Methods This is a retrospective cohort study using propensity score matching (PSM) analysis. Women commencing their IVF between January2017 to December2021, with and without GH co-treatment, were reviewed. Results After PSM, 76 pairs of women with low prognosis were included into analysis. Paired testing showed there is a statistical increase in transferable embryo (P<0.001) in the GH co-treatment group comparing with control group.No significant difference showed in retrieved oocyte number and metaphaseⅡ(MⅡ) oocyte rate, two-pronuclear (2PN) zygote rate on day1, high-quality embryo rate, or clinical pregnancy rate, neither in gonadotropin (Gn) requirement , duration or peak estradiol. Subgroup analysis results showed transferrable embryo rate on day3 rising among decreased ovarian reserve women (P=0.010). For women aged below 40, MⅡoocyte rate (P=0.010) and transferrable embryo rate on day3 (P<0.001) increased in GH co-treatment group. Conclusions GH is suggested a beneficial impact on oocyte quality and transferrable embryos with PPOS protocol in IVF. Its adjuvant administration can be proposed as an optional therapeutic strategy in women with low prognosis.
[Key words] Growth hormone; In vitro fertilization; Progesterone-primed ovarian stimulation; Low prognosis; Propensity score matching
超过10%的夫妇在生育期受到不孕不育的影响[1]。体外受精(in vitro fertilization,IVF)是治疗不孕症的一种选择,尽管技术不断更新,单个移植周期中,仍有近一半夫妇无法成功妊娠[2]。在IVF过程中,促性腺激素被用于增强卵巢功能和增加卵泡生长,这有助于形成更多的卵母细胞,提高怀孕机会。根据新的波塞冬概念,被归类为低预后的女性包括卵巢储备较差的女性和卵巢储备常规参数良好但卵巢反应意外较差或不理想的女性[3]。在这些女性中,治疗周期取消率高、获卵率不理想、可用胚胎数量少,导致最终临床妊娠率低[4]。目前尚无有效的治疗方法,其病因和病理学尚不清楚。
临床上提出应用了各种刺激方案来改善IVF结果。其中,高孕激素促排卵(progesterone-primed ovarian stimulation,PPOS)方案作为促性腺激素释放激素(gonadotropin releasing hormone,GnRH)类似物的替代物,被用于抑制卵泡期早期黄体生成激素的激增[5]。它具有Gn用量少、刺激持续时间短,和常规促排卵方案胚胎数量相当的优势。除了卵巢刺激方案的优化,为了改善IVF结果,辅助剂也引起了广泛关注。自2008年首次发现人类卵巢中生长激素(growth hormone,GH)受体的表达以来,GH被广泛研究[6-7]。有研究探索了GH应用的策略和方法,GH联合长方案、短方案、微刺激方案、拮抗剂方案等都被认为GH可能通过多种途径促进卵泡发育、雌激素产生和卵母细胞成熟[8-9]。
然而,由于在患者类型选择、GH治疗时机或GH应用的最佳剂量方面缺乏共识,GH在改善IVF结局方面的有效性仍存在争议。本研究旨在通过PSM后分析探讨GH在低预后妇女PPOS方案IVF结局的影响。
1 资料与方法
1.1 研究对象
本研究为回顾性队列研究,研究纳入了2017年1月至2021年12月在杭州市婦产科医院生殖内分泌中心行IVF辅助治疗的女性。该研究获得了医院伦理审查委员会批准。
根据国际波塞冬低预后女性概念[3]的界定,所有入选女性既往卵巢反应预期外不佳或预后不良。须满足以下标准之一:(1)具有足够的预刺激卵巢储备参数:窦卵泡计数(antral follicle count,AFC)≥5;抗苗勒氏管激素(anti-Müllerian hormone,AMH)≥1.2 ng/ml),但具有预期外不良或次优卵巢反应(少于9个卵母细胞);(2)卵巢储备参数较差(AFC<5,AMH<1.2ng/ml)。如果女性处于以下情况,则排除在研究之外:(1)患有内分泌或代谢紊乱;(2)不完整的数据。
1.2 治疗方案
参与本研究的女性行PPOS方案。卵巢刺激开始于月经周期第2~5天肌肉注射150~225mg促性腺激素(human menopausal gonadotropin,HMG),同时口服20mg的黄体酮胶囊(安琪坦,法国Besins公司)。在GH协同治疗组,前次月经结束后,每天皮下注射GH(重组人生长激素,金赛药业)2IU,直到促排卵开始前1d,从促排卵第1天起提高到3IU,而在对照组中,使用相同的PPOS方案,但不使用GH治疗。监测卵泡发育和激素水平以评估卵巢反应。根据卵巢反应调整药物剂量。当2个或多个卵泡直径达到18mm时,注射人绒毛膜促性腺激素(human chorionic gonadotropin,hCG,丽珠医药集团)5000~ 10 000IU作为扳机。注射hCG当天终止GH治疗。
注射hCG后35~36h经阴道穿刺卵巢取出卵子。术后给予黄体酮胶囊作为黄体支持。根据不孕原因,选择常规受精方式或单精子卵胞质注射。在取卵后将胚胎培养3~5d,进行胚胎评级[10]。由于子宫内膜容受性不佳,所有可移植胚胎冷冻。取卵后第2次月经来潮第2~3天开始人工激素替代方案做胚胎移植内膜准备,排除卵巢囊肿后开始口服戊酸雌二醇(补佳乐,德国拜耳公司)3mg,每日2次。用药7d后超声检查子宫内膜生长情况,根据内膜厚度调整补佳乐剂量。于用药12~14d,监测子宫内膜厚约8mm,均匀且无宫腔积液,血清孕酮<3nmol/L使用黄体酮(黄体酮注射剂,浙江仙琚制药)40mg,每天2次,地屈孕酮片(荷兰Abbott Biologicals公司)40mg,每天2次进行内膜转化,转化第4天行冻融胚胎移植,移植胚胎1~2枚。移植后12d测血hCG明确是否妊娠,30d行B超检查孕囊数,有胎心管搏动判定为临床妊娠。
1.3 观察指标
主要评价指标是获得的卵母细胞数、MⅡ卵率、取卵后第1天(D1)的2PN受精率、第3天(D3)的可移植胚胎率、优质胚胎比率。次要评价指标是Gn用量和Gn天数和雌二醇(E2)峰值。
1.4 统计学方法
采用IBM SPSS统计学软件(26.0版)进行统计分析。连续变量表示为中位数(四分位间距)。基于年龄、体质量指数(body mass index,BMI)、AFC和AMH,使用多变量Logistic 回归模型进行PSM分析,设置卡钳值为0.05进行1∶1匹配,得出GH协同PPOS方案治疗或仅接受PPOS方案治疗的 76对成对患者,后比较GH协同PPOS方案治疗组和对照组的IVF结局,并对40岁以下的女性以及卵巢储备功能减退(AMH<1.2ng/ml)女性进行了亚组分析。所有入选女性的组间比较和亚组分析均采用Wilcoxon U或者c2检验。P<0.05为差异有统计学意义。
2 结果
2.1 GH协同治疗组和对照组之间的IVF结果比较
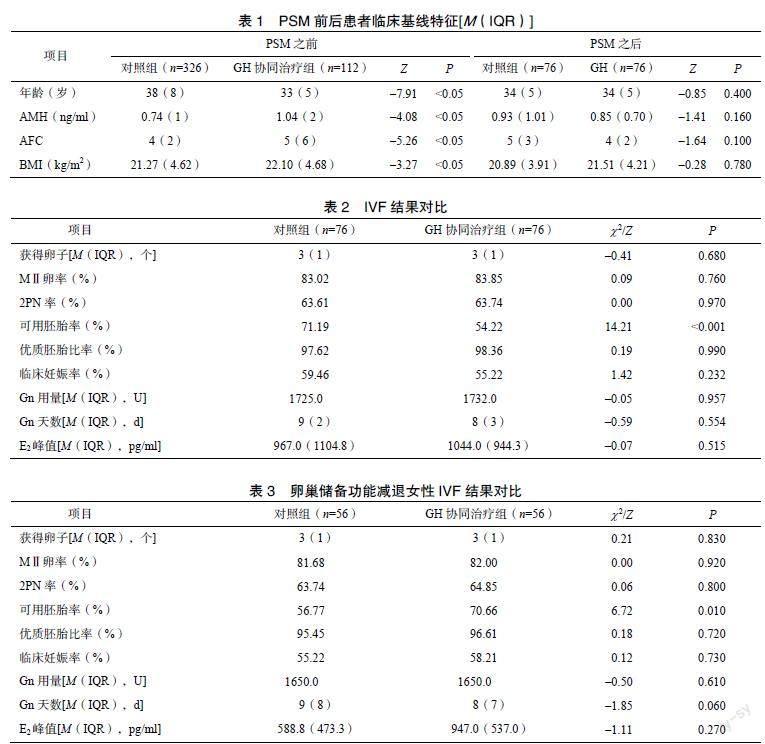
根据选择标准,112名接受GH协同PPOS方案治疗的女性和326名未接受GH治疗仅应用PPOS方案促排卵的女性被纳入分析。PSM后,共有76对女性(共152名女性)成功配对。PSM后,GH协同治疗组和对照组女性的年龄、BMI、AFC和AMH差异无统计学意义。PSM前后女性的临床基线特征见表1。GH协同治疗组和对照组之间的IVF周期结果比较显示,两组获卵数、MⅡ卵率、D1~2 PN受精率相当,但D3可移植胚胎率上升(P<0.001),有统计学意义(表2)。然而,两组优质胚胎比率和临床妊娠率比较,差异有统计学意义(P<0.05)。两组的E2峰值、Gn用量和Gn天数差异无统计学意义(P>0.05)。
2.2 卵巢储备功能减退女性GH协同治疗组和对照组IVF结果比较
卵巢储备功能减退女性(AMH<1.2ng/ml)的IVF结果显示GH协同治疗组和对照组组间D3可移植胚胎率差异有统计学意义(P=0.01,表3),获卵数、MⅡ卵率、D1-2PN受精率、优质胚胎比率和临床妊娠率差异无统计学意义(P>0.05)。两组的E2峰值、Gn用量和Gn天数差异无统计学意义(P>0.05)。
2.3 40岁以下女性GH协同治疗组和对照组IVF结果比较
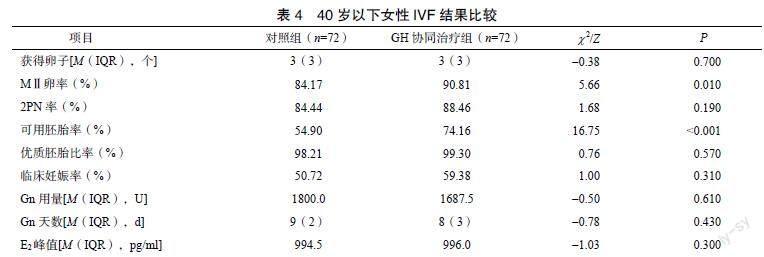
MⅡ卵率(P=0.01)、D3可移植胚胎率差异有统计学意义(P<0.001),同时,GH协同治疗组和对照组的获卵数、D1-2PN受精率、优质胚胎比率和临床妊娠率没有显著上升。两组的E2峰值、Gn用量和Gn天数比较,差异无统计学意义。研究中未出现使用GH相关的不良反应的情况(P>0.05)。
3 讨论
胚胎质量是试管婴儿成功的关键因素之一,受年龄、AMH和获卵情况的影响[11]。许多关于GH在IVF中应用的报道表明,通过调节卵母细胞功能,GH在改善卵泡募集中的作用对卵巢低反应(poor ovarian response,POR)患者有益[12-13]。但目前GH的最佳应用方案尚不明确。本研究报告了GH协同PPOS方案对低预后妇女IVF结果的影响。本研究使用PSM并使用配对比较进行分析,结果显示無论是低预后还是卵巢储备减退女性获取的卵母细胞数量未出现明显增长,而D3可移植胚胎率增加。这表明使用GH对提高卵子质量有影响,这与早期研究一致[14]。更多可胚胎意味着增加的移植机会,最终怀孕的可能性也更高。GH治疗的时机和持续时间可能是影响结果的关键因素。本研究中,Gn开始于促排卵周期前一次月经期结束,此时是窦卵泡阶段,颗粒细胞发育和线粒体增殖开始,低剂量应用GH可能有助于原始卵泡的募集和激活,并可以通过提高卵母细胞的发育能力来提高胚胎的质量。
GH在生殖过程中被认为通过多种途径产生影响[8-9],但具体机制尚不清楚。人类卵母细胞表达GH受体(growth hormone receptor,GHR)。GH治疗改善了三磷酸腺苷的合成、衰老相关的卵母细胞线粒体活性以及GHR的表达[15]。也就是说,GH能够直接影响细胞核和细胞质,促进卵母细胞成熟。通过促进胰岛素样生长因子-1的产生。证据表明,胰岛素样生长因子-1可以抑制卵泡凋亡,这是获得卵泡刺激素反应性和卵母细胞成熟所必需的[16-17]。此外,GH通过激活GnRH的脉冲发射,提高卵巢中促性腺激素受体的表达,最终促进卵母细胞的生长,从而影响下丘脑-垂体-卵巢轴。通过增加卵泡刺激受体和黄体生成受体的密度,补充GH也被证明能有效提高卵母细胞的反应性[18]。同时,GH可以提高卵母细胞中具有关键作用的其他分子的表达,如胰岛素样生长因子结合蛋白和整合素[19]。所有这些效应都可以通过促进窦前卵泡和窦卵泡的募集来增加单个周期中获得的成熟卵母细胞,从而对IVF的结局产生积极影响。
对于40岁以下的女性,GH协同治疗组MⅡ卵率升高,可移植胚胎增加提示在卵巢刺激中补充GH可能会提高卵母细胞的质量,同时也提示了生殖年龄对生育力的重要影响,表明一旦女性被卵巢功能被评估为低预后,应尽早应用GH。40岁以上女性血糖异常或有潜在肿瘤风险较40岁以下女性高,故生殖中心IVF女性使用GH者40岁以下更常见,而这一人群也是生育期女性的主要组成部分。另有研究表明,40岁以上的女性也受益于IVF中使用GH,尽管其效果显示出显著的年龄分层[20]。
早期关于辅助使用GH的大多数研究集中于POR女性,而鲜有关于低预后女性使用GH的临床效果的研究。本研究为低预后女性提供了一种治疗策略。同时,尽管本研究应用PSM来提高比较结果的准确性,但回顾性研究固有的偏倚是不可避免的。其次,研究样本量有限,需要进一步的大样本随机试验来验证。采用PPOS方案协同GH治疗可能对卵母细胞质量和胚胎质量产生积极影响,尤其是对40岁以下女性。在获得充分知情同意的情况下,GH辅助用药可作为低预后女性的一种提高辅助生殖结局的选择。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 周猷, 庞成, 何电, 等. 我国不孕症研究进展[J]. 中国计划生育学杂志, 2011, 19(7): 445–446.
[2] ACHACHE H, REVEL A. Endometrial receptivity markers, the journey to successful embryo implantation[J]. Hum Reprod Update, 2006, 12(6): 731–746.
[3] Poseidon Group, ALVIGGI C, ANDERSEN C Y, et al. A new more detailed stratification of low responders to ovarian stimulation: from a poor ovarian response to a low prognosis concept[J]. Fertil Steril, 2016, 105(6): 1452–1453.
[4] 葛小花, 王建業, 张雅梦, 等. GH预处理在卵巢低反应患者体外受精治疗中的应用[J]. 安徽医科大学学报, 2019, 8: 5.
[5] EFTEKHAR M, HOSEINI M, SAEED L. Progesterone- primed ovarian stimulation in polycystic ovarian syndrome: An RCT[J]. Int J Reprod Biomed, 2019, 17: 671–676.
[6] FERRARETTI A P, GIANAROLI L, MAGLI M C, et al. Mild ovarian stimulation with clomiphene citrate launch is a realistic option for in vitro fertilization[J]. Fertil Steril, 2015, 104(2): 333–338.
[7] CHOE S A, KIM M J, LEE H J, et a1. Increased proportion of mature oocytes with sustained-release growth hormone treatment in poor responders: a prospective randomized controlled study[J]. Arch Gynecol Obstet, 2018, 297(3): 791–796.
[8] LIU F T, HU K L, LI R, et al. Effects of growth hormone supplementation on poor ovarian responders in assisted reproductive technology: a systematic review and Meta-analysis[J]. Reprod Sci, 2020, 4: 1–13.
[9] CHU K, PANG W, SUN N, et al. Outcomes of poor responders following growth hormone co-treatment with IVF/ICSI mild stimulation protocol: a retrospective cohort study[J]. Arch Gynecol Obstet, 2018, 297(5): 1317–1321.
[10] 單旭, 东梁鑫, 漆著, 等. IVF-ET中观察胚胎早期卵裂预测胚胎发育潜力的研究[J]. 中国计划生育学杂志, 2011, 19: 360–363.
[11] MARCA A L, MINASI M G, SIGHINOLFI G, et al. Female age, serum anti-müllerian hormone level, and number of oocytes affect the rate and number of euploid blastocysts in in vitro fertilization/intracytoplasmic sperm injection cycles[J]. Fertil Steril, 2017, 108(5): 777–783.
[12] LIU F T, WU Z, YAN J, et al. The potential role of growth hormone on the endometrium in assisted reproductive technology[J]. Front Endocrinol, 2020, 11: 49.
[13] DEVESA J, CAICEDO D. The role of growth hormone on ovarian functioning and ovarian angiogenesis[J]. Front Endocrinol, 2019, 10: 450.
[14] DUFFY J M, AHMAD G, MOHIYIDDEEN L, et al. Growth hormone for in vitro fertilization[J]. Cochrane Database Sys Rev, 2010, 11: CD000099.
[15] HOU H, WANG X, YU Q, et al. Evidence that growth hormone can improve mitochondrial function in oocytes from aged mice[J]. Reproduction (Cambridge, England), 2019, 157(4): 345–358.
[16] CHUN S Y, BILLIG H , TILLY J L, et al. Gonadotropin suppression of apoptosis in cultured preovulatory follicles: mediatory role of endogenous insulin-like growth factor I[J]. Endocrinology, 1994, 5: 1845.
[17] ZHOU J, RAJENDRA K T, MATZUK M M, et al. Insulin-like growth factor I regulates gonadotropin responsiveness in the murine ovary[J]. Mol Endocrinol, 1997, 13: 1924.
[18] SHEENA L P, REGAN, PHIL G, et al. Growth hormone during in vitro fertilization in older women modulates the density of receptors in granulosa cells, with improved pregnancy outcomes[J]. Fertil Steril, 2018, 110(7): 1298–1310.
[19] XU Y M, HAO G M, GAO B. Application of growth hormone in in vitro fertilization[J]. Front Endocrinol, 2019, 10: 502.
[20] KEANE K N, YOVICH J L, HAMIDI A, et al. Single-centre retrospective analysis of growth hormone supplementation in IVF patients classified as poor-prognosis[J]. BMJ Open, 2017, 7(10): e018107.
(收稿日期:2023–03–25)
(修回日期:2023–11–16)
