基于生物信息学探究NR1H4在慢性萎缩性胃炎及药物预测中的作用
2024-03-08彭晓婷王文素何典城詹亚梅游绍伟
彭晓婷 王文素 何典城 詹亚梅 游绍伟
[摘要] 目的 通過生物信息学方法获得慢性萎缩性胃炎(chronic atrophic gastritis, CAG)的差异基因,预测治疗CAG的小分子药物。方法 通过基因表达综合(Gene Expression Omnibus,GEO)数据库获取2份CAG芯片(GSE27411、GSE116312)基因表达样本,利用R语言筛选出CAG差异表达基因,获得CAG免疫相关基因进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析。利用STRING数据库构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,筛选出核心基因,进一步研究核心基因的免疫浸润,预测其小分子化合物,通过MOE2022进行分子对接,通过GEPIA2网站进行生存分析。结果 基于GEO数据库筛选出差异基因517个。GO富集分析发现主要涉及粒细胞趋化性、白细胞趋化性、中性粒细胞趋化性等生物过程。KEGG富集分析显示主要富集于细胞因子-细胞因子受体相互作用通路、核因子κB信号通路、白细胞介素-17信号通路。PPI网络筛选前6个核心基因即NR1H4、CCK、CCL20、CXCL1、LCN2、SAA1,通过相关验证,NR1H4作为核心基因。免疫细胞浸润分析结果显示中央记忆CD8 T细胞、效应记忆CD4 T细胞、γδT细胞、自然杀伤细胞、中性粒细胞等免疫细胞可能参与CAG的发生发展,而中性粒细胞与NR1H4呈正相关。分子对接显示柯里拉京、豆甾醇、栀子苷、桔皮素、鹅去氧胆酸、表没食子儿茶素-3-没食子酸酯6种小分子药物与NR1H4有较好的结合力。结论 本研究初步探讨CAG的潜在机制,NR1H4作为关键基因与中性粒细胞可能在CAG“炎-癌转化”进程中具有重要意义,可为CAG的“炎–癌转化”机制研究提供一定的参考依据。
[关键词] 慢性萎缩性胃炎;生物信息学;NR1H4;差异基因;免疫浸润
[中图分类号] R573.32 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.04.002
Study on the role of NR1H4 in chronic atrophic gastritis and drug prediction based on bioinformatics
PENG Xiaoting1, WANG Wensu2, HE Diancheng3, ZHAN Yamei4, YOU Shaowei3
1.The Second Clinical Medical College, Guizhou University of Traditional Chinese Medicine, Guiyang 550002, Guizhou, China; 2.Department of Cadre Healthcare, the Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang 550003, Guizhou, China; 3.Department of Gastroenterology, the Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang 550003, Guizhou, China; 4.Department of Pharmacy, Guizhou Provincial Peoples Hospital, Guiyang 550002, Guizhou, China
[Abstract] Objective To explore the differential gene expression profile and small molecule drugs for chronic atrophic gastritis (CAG) by bioinformatics technology. Methods Two gene expression samples of CAG chips (GSE27411, GSE116312) were obtained through the Gene Expression Synthesis (GEO) database, screen the differentially expressed genes (DEGs) of CAG by R language, and CAG immune-related genes were obtained for gene ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) analysis. Protein-protein interaction (PPI) network was constructed using STRING database to screen out core genes, further study on immune invasion of core genes based on GSE27411 dataset, small molecular compounds interacting with core genes were predicted, molecular docking was carried out by MOE2022, and survival analysis was carried out by GEPIA2 website. Results A total of 517 DEGs were screened out based on GEO database. GO function enrichment analysis found that it mainly involved in granulocyte chemotaxis、leukocyte chemotaxis and neutrophil chemotaxis biological processes. KEGG pathway enrichment analysis showed that it mainly involved in cytokine-cytokine receptor interaction、nuclear factor kappa B signaling pathway、interleukin-17 signaling pathway. Six key genes of NR1H4、CCK、CCL20、CXCL1、LCN2、SAA1 were obtained by PPI network, through relevant verification, NR1H4 was regarded as the core gene. Immune cell infiltration analysis showed that central memory CD8 T cell、effector memeory CD4 T cell、gamma delta T cell、natural killer T cell、neutrophil and other immune cells may be involved in the development of CAG, and the neutrophil was positively correlated with NR1H4. It was predicted that six small molecular drugs, corilagin, stigmasterol, geniposide, tangeretin, chenodeoxycholic acid and epigallocatechin 3-gallate, have good binding force with NR1H4. Conclusion The potential mechanism of CAG is preliminarily explored in this study, the key gene of NR1H4 and neutrophil may play an important role in the “inflammatory cancer transformation” process of CAG, which can provide a certain reference for the study of the “inflammatory cancer transformation” mechanism of CAG.
[Key words] Chronic atrophic gastritis; Bioinformatics; NR1H4; Differentially expressed genes; Immune infiltration
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是指胃腺丢失,伴或不伴化生或假幽门腺化生的一种慢性炎症性胃肠疾病,在胃“炎-癌转化”进展中发挥重要作用,属胃癌前状态[1]。CAG无特异性临床表现,部分患者可无任何症状,部分患者表现为持续或反复发作性上腹痛、腹胀和饱胀感,可伴焦虑、睡眠障碍等心身疾病,严重影响日常生活,目前治疗CAG主要以根除幽门螺杆菌(helicobacter pylori,Hp)、抑酸、补充叶酸及中医药等治疗为主,总体疗效欠理想[2]。长期CAG有较大风险进展为胃癌,因此,探索CAG发病机制,寻找新的治疗靶点,预测相关分子标志物及新的治疗手段对防控“炎-癌转化”具有重要意义。生物信息分析可预测基因与分子机制的联系,初步筛选与疾病发生发展相关的关键基因,为疾病的机制研究提供新的靶标和思路。本研究基于生物信息学获得CAG的差异基因,并探索新的治疗手段。
1 资料与方法
1.1 数据获取
从美国生物技术信息中心基因表达综合(Gene Expression Omnibus,GEO)数据库(https://www.ncbi. nlm.nih.gov/geo/)收集CAG相关数据,获得训练集GSE27411中6例CAG患者和6例健康对照(healthy control,HC)的基因表达样本及验证集GSE116312中3例CAG患者和7例HC的基因表达样本。从Immport数据库(https://www.immport.org/)中下载免疫相关基因,共获得1793个。
1.2 差异基因表达分析
使用R软件(版本4.2.20)中limma程序包分析GSE27411数据集的差异基因,其中以P<0.05且|LogFC|>1为条件进行筛选,并将排序靠前的结果进行可视化分析。同时使用Pheatmap程序包制作差异基因热图及使用ggplot2程序包制作火山图。
1.3 免疫相关基因获取及基因集富集分析
将差异基因与免疫相关基因取交集,即为CAG中的免疫相关基因,制作韦恩图,通过R软件用clusterProfiler包进行基因本体论(gene ontology,GO)功能富集和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,設置P值Cutoff=0.05,Q值Cutoff=0.05,并将排序靠前的结果进行可视化分析。
1.4 蛋白质-蛋白质相互作用网络制作及核心基因的获取验证
将共同基因导入STRING11.5分析平台(https:// cn.string-db.org/),物种设置为“Homo sapiens”(人类),构建蛋白质-蛋白质相互作用(protein- protein interaction,PPI)网络并进行可视化。将结果以TSV格式导入Cytoscape3.8.2软件,构建PPI网络图,采用Cytoscape的cytoHubba插件,依据Betweenness计算方法进行拓扑结构分析、筛选核心基因。同时基于验证集GSE116312采用Wilcoxon检验进行表达差异验证,验证通过即为核心基因。
1.5 免疫浸润分析
基于GSE27411数据集进一步研究核心基因免疫浸润,使用GSVA程序包中ssGSEA算法可量化样本中免疫细胞比例。通过ssGSEA算法对GSE27411数据集进行免疫浸润分析,采用Wilcoxon检验CAG与HC之间免疫浸润表达的差异,采用Ccrrplot程序包Spearman检验免疫相关基因与28个浸润免疫细胞的相关性。
1.6 药物预测、分子对接验证、生存分析
通过HERB数据库预测核心基因相互作用的小分子化合物,将预测小分子化合物进行分子对接。NR1H4的核心靶蛋白晶体结构从RCSB数据库(https://www.rcsb.org/pdb)下载,而小分子化合物2D结构从PubChem数据库(https://pubchem. nc-bi.nlm.nih.gov/)下载。MOE2022软件进行分子对接并计算靶蛋白和小分子之间的相互作用能量。对接前,用MOE2022软件自带QuickPrep设置处理受体蛋白,包括加氢、质子化等。使用MOE2022自带Energy Minimize设置对活性成分进行能量最小化。分子对接以MOE2022软件General模型分析配体和受体的结合特性,得分越低,配体与靶蛋白的结合越稳定。使用GEPIA2网站预测NR1H4在胃癌中的无病生存期以评价治疗后疗效。
2 结果
2.1 数据处理
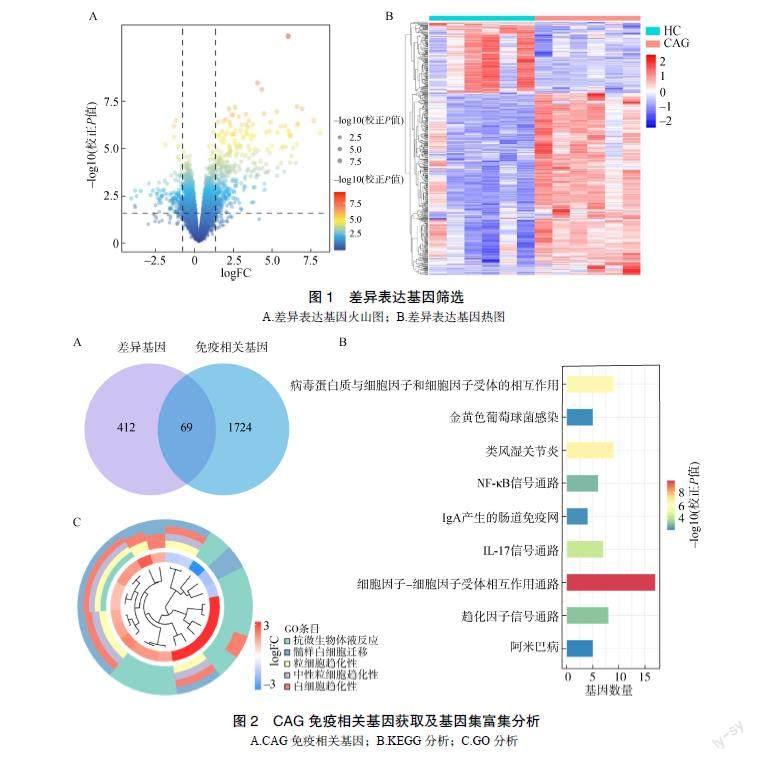
GSE27411数据集中6例CAG患者和6例HC绘制差异基因火山图和热图,筛选出上调基因384个,下调基因133个,见图1。
2.2 免疫相关基因获取及基因集富集分析
差异基因与免疫相关基因取交集得到69个CAG中的免疫相关基因,并进行KEGG和GO分析,见图2。GO富集分析主要涉及粒细胞趋化性、白细胞趋化性、中性粒细胞趋化性等生物过程。KEGG中存在细胞因子-细胞因子受体相互作用通路、核因子κB(nuclear factor-κB,NF-κB)、白细胞介素-17(interleukin-17,IL-17)等信号通路。
2.3 PPI网络及核心基因
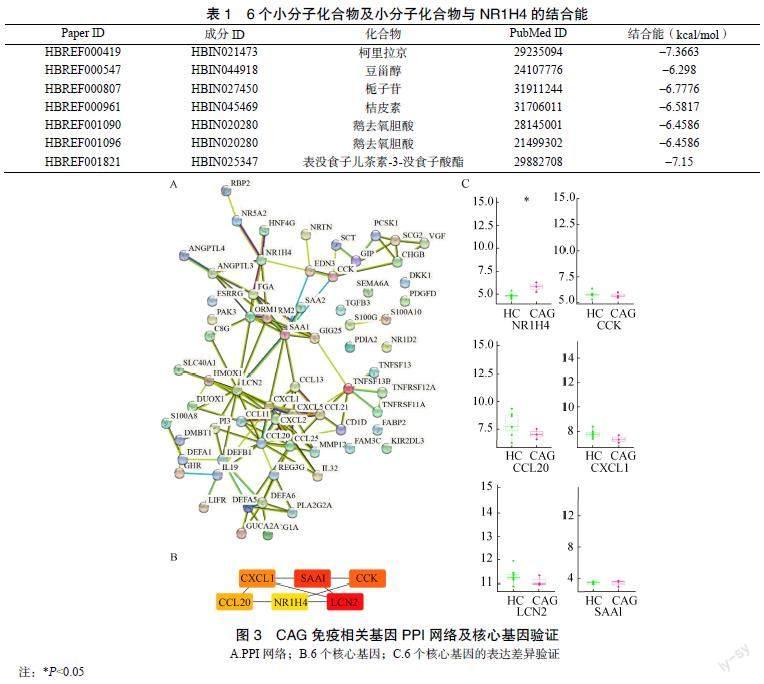
CAG免疫相关基因PPI网络节点68个,边128条,平均度值3.76,图中节点的大小及其颜色的深浅与其度值成正比,见图3A。采用Cytoscape的cytoHubba插件,基于Betweenness计算取前6个核心基因即NR1H4、CCK、CCL20、CXCL1、LCN2、SAA1,见图3B。基于验证集GSE116312验证,其中只有NR1H4提示具有统计学意义(P<0.05),即以NR1H4为本研究的核心基因,见图3C。
2.4 免疫浸润分析
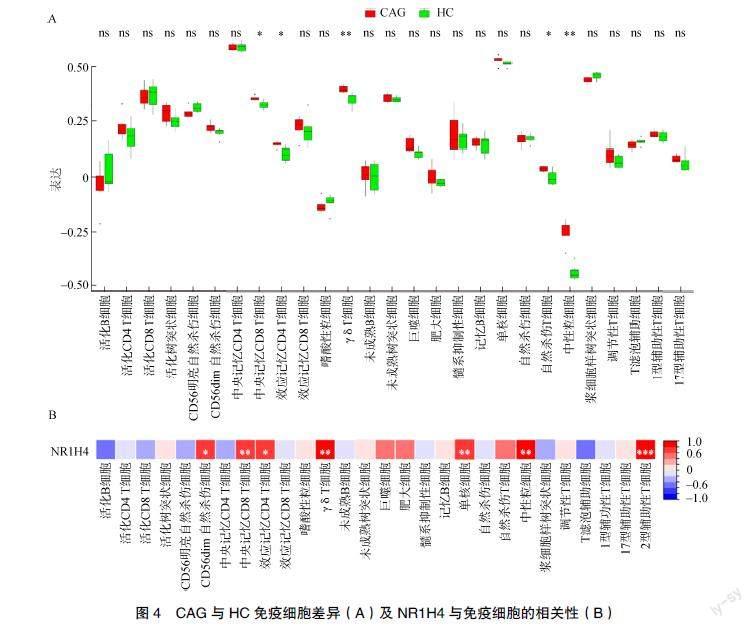
使用ssGSEA算法估计GSE27411数据集中CAG患者和HC中28个免疫细胞的比例。研究发现GSE27411数据集中CAG患者和HC的中央记忆CD8 T细胞、效应记忆CD4 T细胞、γδT细胞、自然杀伤T细胞及中性粒细胞比较差异均有统计学意义(P<0.05),见图4A;上述免疫细胞可能参与CAG的发生发展,其中中性粒细胞与NR1H4呈正相关(r>0.6,P<0.05),见图4B。
2.5 药物预测、分子对接及无病生存期
通过HERB数据库预测特征基因NR1H4潜在小分子化合物,获得柯里拉京、豆甾醇、栀子苷、桔皮素、鹅去氧胆酸、表没食子儿茶素-3-没食子酸酯6个小分子化合物。分子对接能量低的配对是NR1H4-柯里拉京(–7.3663kcal/mol),能量最高的配对是NR1H4-豆甾醇(–6.298kcal/mol),全部对接能量值均<–5kcal/mol,提示有良好的对接活性,见表1。从GEPIA2网站获得NR1H4在胃癌患者中的無病生存期结果,NR1H4低表达组胃癌患者的无病生存期显著长于NR1H4高表达组(P<0.05),见图5。
3 讨论
胃癌是全球第六大常见癌症,第四大癌症死亡原因,长期慢性炎症被认为是肿瘤发展的标志[3]。CAG作为胃“炎-癌转化”中的重要一环受多种因素的影响,但其发生机制目前仍未有确切的定论,多种因素均可能参与其中,基因的调控作用或许是其发生发展的重要环节。
本研究通过GEO数据库筛选出CAG相关数据集,最终筛选出CAG差异表达基因进行GO分析和KEGG分析。GO主要富集于抗微生物体液反应、粒细胞趋化性、白细胞趋化性、髓样白细胞迁移、中性粒细胞趋化性等生物过程;KEGG分析主要涉及
细胞因子-细胞因子受体相互作用、NF-κB信号通路、IL-17信号通路等炎症免疫调节相关通路。细胞因子-细胞因子受体相互作用通路包含15个基因中的7个,其中转化生长因子-β是参与胃癌浸润、转移的重要刺激因子,其功能表现为抑制免疫系统杀伤肿瘤细胞,并在CAG、肠化生、胃癌中表达上调[4]。NF-κB在炎症反应、细胞增殖、分化和凋亡中起重要作用,在正常胃黏膜、慢性萎缩性胃炎、胃癌中均为阳性表达,且逐渐增强[5-6]。通过其上、下游的NF-κB蛋白表达调控胃黏膜上皮细胞的凋亡与增殖,从而逆转胃“炎-癌转化”发生[7]。IL-17信号通路参与炎症反应、自身免疫疾病和肿瘤的发生发展,可增强中性粒细胞的浸润及促进新生血管生成导致肿瘤的产生,还可激活NF-κB信号通路,促进炎症因子分泌,改变肿瘤的炎症微环境,促进胃癌细胞的迁移和侵袭[8-10]。以上提示CAG的发生发展与多种炎症途径和免疫相关。
在PPI网络中,NR1H4作为核心基因可能在CAG病程中,甚至在“炎-癌转化”病程中发挥重要作用。NR1H4又称法尼酯衍生物X受体(Farnesoid X receptor,FXR),相关研究表明FXR激活可通过调节NF-κB通路降低炎症反应[11-12]。Li等[13]研究发现脱氧胆酸通过激活FXR-NF-κB通路,参与正常胃上皮细胞中CDX2和MUC2的异位表达,从而导致胃黏膜肠化生。
免疫细胞浸润分析结果提示,中性粒细胞与NR1H4呈正相关。中性粒细胞是浸润最多的免疫细胞,有研究显示肿瘤微环境中浸润的嗜中性粒细胞可削弱T细胞免疫,促进胃癌的发展,活化的中性粒细胞与胃癌进展相关,且与患者存活率呈负相关[14]。中性粒细胞以CXC趋化因子依赖性方式被吸引到胃癌环境中,中性粒细胞、B7-H2可能是CD4+ T细胞产生IL-17A的主要驱动因素之一,参与胃癌的发生发展[15]。
通过HERB数据库查询获得6种特异性针对NR1H4的小分子化合物。分子对接结果显示其均与核心基因NR1H4有较好的亲和力。柯里拉京具有抗炎、保肝、抗肿瘤活性,对正常细胞毒性较小,能抑制胃癌细胞增殖、凋亡和自噬,发挥较强的抗肿瘤活性[16-17];豆甾醇具有很强的抗炎和抗氧化应激作用,可介导AMP活化蛋白激酶活化,并通过调节NF-κB或核苷酸结合寡聚化结构域样受体蛋白通路发挥抗炎作用[18-19];栀子苷具有抗炎、抗氧化和抗肿瘤等多种生物活性,通过抑制相关炎症信号通路,减少炎症反应及发挥抗肿瘤作用[20-21];桔皮素可通过抑制Notch-1信号转导和miR-410表达上调提高胃癌细胞的辐射敏感性及抑制辐射诱导的上皮–间充质转化和转移[22];表没食子儿茶素-3-没食子酸酯可调节多种关键的细胞信号通路,发挥抗炎、抗增殖和细胞凋亡诱导作用[23-26];鹅去氧胆酸是胆汁酸受体和转录因子FXR最有效的天然激动剂,朱晗等[27]发现鹅去氧胆酸可降低BV2细胞中炎症因子IL-6、肿瘤坏死因子-α和IL-1β的表达,抑制NF-κB信号通路及Akt的激活。基于药理分析,认为以上小分子化合物可能是抑制CAG及其“炎-癌转化”进程中的关键因素。
综上所述,本研究通过生物信息学筛选出与CAG密切相关的基因NR1H4,对其进行深入研究可有助于进一步阐释CAG发生、发展的机制及小分子药物的预测,为药物治疗提供潜在靶点,也为病理筛查提供理论依据。但本研究尚缺少基础研究数据的验证,后续将继续收集临床样本,对筛选出的关键基因进行深入研究。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] BANKS M, GRAHAM D, JANSEN M, et al. British Society of Gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma[J]. Gut, 2019, 68(9): 1545–1575.
[2] 房静远, 杜奕奇, 刘文忠, 等. 中国慢性胃炎诊治指南(2022年, 上海)[J]. 胃肠病学, 2022, 27(4): 193–224.
[3] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209–249.
[4] 邵建富, 李兴海, 马文杰, 等. TGF-β1对胃癌细胞增殖、凋亡及miR-302a和AKT通路的影响[J]. 医学分子生物学杂志, 2020, 17(1): 46–51.
[5] ECHIZEN K, HORIUCHI K, AOKI Y, et al. NF-κB- induced NOX1 activation promotes gastric tumorigenesis through the expansion of SOX2-positive epithelial cells[J]. Oncogene, 2019, 38(22): 4250–4263.
[6] 裴蓓, 刘云, 宋标, 等. 脾胃培源方治疗慢性萎缩性胃炎脾胃虚弱证患者疗效及对胃黏膜三叶因子2、核因子-κB表达的影响[J]. 中国中医药信息杂志, 2023, 30(3): 121–125.
[7] 游紹伟, 易旭, 赵琦, 等. 基于NF-κB信号通路探讨萎胃通调汤对大鼠慢性萎缩性胃炎的作用机制[J]. 中国实验方剂学杂志, 2023, 29(2): 88–97.
[8] YU H Y, WU H W, ZHENG F P, et al. Gene-regulatory network analysis of ankylosing spondylitis with a single-cell chromatin accessible assay[J]. Sci Rep, 2020, 10(1): 19411–19422.
[9] 陈锦霞, 单保恩, 李清靖, 等. IL-17及其相关分子在胃癌组织中的表达和相关性分析[J]. 肿瘤学杂志, 2019, 25(6): 537–540.
[10] 宋靜静, 单保恩, 王浩, 等. 外源性IL-17对胃癌细胞生物学特性的影响及其机制研究[J]. 中国肿瘤, 2018, 27(11): 867–873.
[11] PANG J, FENG J N, Ling W, et al. Commentary: Can FXR serve as a potential target for COVID-19 prevention?[J]. Acta Pharm Sin B, 2023, 13(4): 1786–1788.
[12] ZHAO Y, WEI S, CHEN L, et al. Primary biliary cholangitis: Molecular pathogenesis perspectives and therapeutic potential of natural products[J]. Front Immunol, 2023, 14: 1164202.
[13] LI S, CHEN X, ZHOU L, et al. Farnesoid X receptor signal is involved in deoxycholic acid-induced intestinal metaplasia of normal human gastric epithelial cells[J]. Oncol Rep, 2015, 34(5): 2674–2682.
[14] WANG T T, ZHAO Y L, PENG L S, et al. Tumour- activated neutrophils in gastric cancer foster immune suppression and disease progression through GM-CSF-PD- L1 pathway[J]. Gut, 2017, 66(11): 1900–1911.
[15] SHAN Z G, CHEN J, LIU J S, et al. Activated neutrophils polarize protumorigenic interleukin-17A- producing T helper subsets through TNF-α-B7-H2- dependent pathway in human gastric cancer[J]. Clin Transl Med, 2021, 11(6): e484.
