基于网络药理学和细胞实验探究盐酸药根碱抗酒精性肝炎的作用机制
2024-03-07陈心雨赵冰洁郑浩东贾爱亭张志君
陈心雨,赵冰洁,郑浩东,贾爱亭,张志君
湖北科技学院药学院(湖北咸宁 437100)
酒精性肝炎(alcoholic hepatitis, AH)是酒精性肝病的一种分支,主要表现为黄疸和不断加重的炎症肝损伤[1]。AH 病程长且易复发,可能诱发各种复杂症状,酒精依赖度高的AH 患者生活质量和健康状况将大大下降。长期大量饮酒可导致严重肝损伤,并逐渐发展为AH[2]。我国尚缺乏全国性酒精性肝病的流行病学资料,但地区性流行病学调查结果显示,近年来我国饮酒人群比例和酒精性肝病患病率均呈上升趋势,一般人群酒精性肝病患病率为15%~20%。AH 已成为我国最主要的慢性肝病之一,极大地威胁肝脏健康,若患者未得到及时治疗,可能转变为肝纤维化、肝硬化,甚至肝癌[3]。烟草、病毒感染、遗传因素等也是AH 的主要诱因[4]。AH 的发展进程与氧化应激密切相关,肝细胞内环境的氧化平衡遭到破坏,导致氧化应激信号分子混乱,从而引发肝脏脂肪积累,变异的脂毒素刺激氧化应激,对肝细胞形成二次打击[5]。酒精在肝脏内能被氧化为乙醛,进一步激活肝脏星状细胞,从而对肝细胞产生毒性[6]。酒精摄入也可能破坏肝细胞内钙平衡,诱发内质网应激,加速肝脏氧化应激损伤和炎症反应。
盐酸药根碱(jatrorrhizine hydrochloride,JH),又名药根碱盐酸盐,为复方二妙颗粒中黄柏的主要组成元素之一[7]。研究表明,JH 具有抗炎、抗菌、降血糖、保护神经、抗心律失常及调节脂肪细胞糖脂代谢等作用[8-12]。目前临床实践尚未找到AH 有效的治疗方法,其发病原因复杂且不断变化,很大程度上妨碍了新药研制工作[13]。因此,寻找并研究能有效治疗AH 的药物,以延缓或阻止肝硬化和肝癌等肝病的发展具有重要意义。JH 对AH 的预防效果尚未明确,网络药理学通过研究生物分子网络的结构和功能来理解中药的药效,并将网络生物学的观念和方法应用于中药药理学的研究,这为深入研究JH 是否能对AH产生疗效及其机制原理提供了新视角[14-15]。本研究基于网络药理学和体外细胞实验,探讨JH 对AH 的关键靶点及其可能的作用机制,以期为AH的治疗提供新的研究路径及参考。
1 资料与方法
1.1 网络药理预测及分子对接
1.1.1 JH靶点筛选
以“jatrorrhizine hydrochloride”为关键词,通过PubMed 数据库(https://pubchem.ncbi.nlm.nih.gov/)查找该药物成分,通过SWISS 数据库(http://www.swisstargetprediction.ch/)查找JH 靶点。每个目标蛋白的名字均已通过UniProt 数据库校验并得到了JH 可能的目标名称。
1.1.2 AH靶点筛选
以“Alcoholic Hepatitis”为关键词,在GeneCards 数据库(https://www.genecards.org)和OMIM 数据库(http://www.omim.org)中查找AH相关靶点。根据GeneCards 数据库,靶点与病症间的紧密度与Relevance score 值呈正比,筛选与整合OMIM 数据库的靶点后剔除重复项,获取AH 的作用靶点,接着将这些靶点与JH 关联靶点进行交集,并通过韦恩图加以呈现,从而找出JH治疗AH 的关键靶点。
1.1.3 JH靶点网络及蛋白质互作网络构建与拓扑学分析
借助STRING 数据库设立药物与疾病之间共享靶点蛋白质的交互关系,利用Cytoscape 3.9.0 软件构建蛋白质互作网络(protein-protein interaction network, PPI),线的密集程度代表其影响深远程度,然后对其进行拓扑分析,并计算度数、紧邻中心度和中介中心度作为过滤标准,通过这些标准筛选出关键目标,对其按照数值高低进行排列,数值越高,越能突显该目标的关键性。
1.1.4 GO功能富集与KEGG通路富集分析
利用DAVID 平台(https://david.ncifcrf.gov/)以输入的JH 和AH 的交互作用为靶点,进行基因本体(gene ontology, GO)功能分析以研究JH和AH 相互影响的基因靶点,分析涵盖生物过程(biological process, BP)、分子功能(molecular function, MF) 及细胞组成(cellular component,CC)。利用P<0.05 的判别规则,挑选排名前十的项目绘制柱状图。同时进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)路径富集分析,以P<0.05 作为富集显著性的筛选条件,确定JH 治疗AH 的主导路径。最后,按照P<0.05 的准则,选取前20 个信号路径制作气泡图。
1.1.5 JH与关键作用靶点分子对接
选择PDB 数据库(https://www.rcsb.org)中的关键活性成分及主导的目标分子进行对接。利用AutoDock Vina 1.5.6 软件进行JH 与主要作用对象的分子对接,优化最低的结合能力方式进行下一步分析。利用Autodocking 软件执行分子对接操作,运用PyMOL 软件解读分子对接结果,并进行可视化展示和处理。
1.2 细胞实验材料及验证方法
1.2.1 细胞和试剂
小鼠单核巨噬细胞RAW264.7 由湖北科技学院公共平台赠送,JH(纯度不低于98%)购自上海源叶公司,不低于97%纯度的脂多糖(lipopolysaccharide, LPS)购自美国Sigma-Aldrich公司,小鼠TNF-α 和IL-6 ELISA 试剂盒购自上海酶联公司,DMEM和胎牛血清购自美国Gibco公司。
1.2.2 细胞培养
将RAW264.7 巨噬细胞在37℃、5%的CO2环境下,利用含有10%的胎牛血清和1%双抗的高糖DMEM 培养液进行培育。
1.2.3 JH对RAW264.7细胞活力的影响
将RAW264.7 细胞按每孔8 000 个细胞的密度分布在96 孔板上,并让其在4 h 内附着在孔壁。随后,注入浓度为0、5、25、50、75 和100 μM的JH 于RAW264.7 细胞,并持续处理24 h。然后,在DMEM 培养液中混入MTT 试剂,并将其置于37℃的细胞孵化箱中孵化4 h。接下来,采用MTT检测法检测24 h 处理后JH 对RAW264.7 细胞增殖的影响,并在450 nm 的光波下使用酶标仪测定光密度(optical density, OD)。
1.2.4 体外炎症模型建立
将LPS 粉末用配置好的DMEM 配成1 mM 的LPS 母液,随后加入培养基,浓度稀释为20 μM,将含有LPS 的培养基加入至细胞培养皿中培养24 h,诱导RAW264.7 细胞向M1 型巨噬细胞转化。
1.2.5 细胞分组与处理
选取发育良好的RAW264.7 细胞进行分组,包括基础对照组、实验模型组(LPS 组)和JH 低度、中度、高度浓度组。其中对照组不给药,LPS组按1.2.4 部分的方法处理,JH 组先以LPS(20 μM)刺激24 h 后,再分别给予50 μM(SK50)、75 μM(SK75)、100 μM(SK100)3 种浓度的JH。
1.2.6 利用ELISA技术对RAW264.7细胞上清液中的TNF-α和IL-6的浓度进行测量
将密度为每孔有8 000 个RAW264.7 细胞栽培于96 孔板上,让细胞附壁的过程持续4 h 后,按照1.2.5 部分的步骤对RAW264.7 细胞施加药品处理,每组均有3 个重复的孔。完成处理后,收集每组细胞的上层溶液,并依照ELISA 试剂盒的使用方法测定上层溶液中的TNF-α 和IL-6 浓度。
1.3 统计学方法
采用Image J 和Graphpad Prism 8.0 软件处理和分析数据,实验共执行3 次,并对各组数据进行t检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 JH抗AH作用靶点
如图1 所示,将筛选出的71 个JH 作用靶点和6 410 个AH 靶点通过韦恩图取交集,获得28 个共同交集靶点,共呈现56 条边,30 个节点,见图2。

图1 JH与AH靶点交集韦恩图Figure 1. Venn diagram of intersection of targets between JH and AH
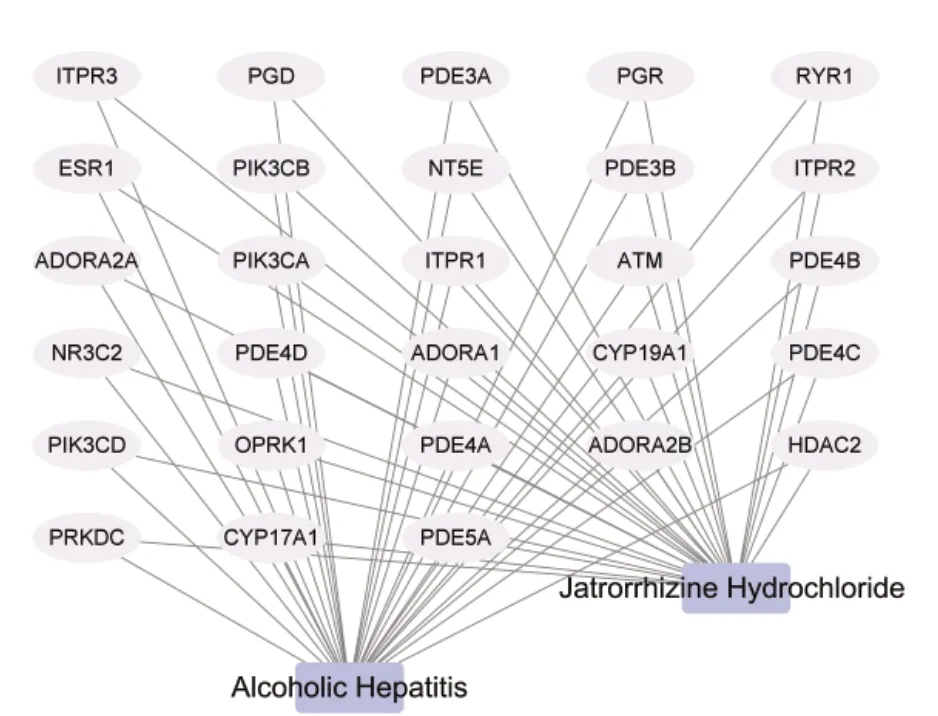
图2 JH抗AH的靶点网络Figure 2. Target network of JH against AH
2.2 共同靶点PPI网络
JH 抗AH 的PPI 网络见图3,包含25 个节点和56 条边,PPI 网络中度值排名前25 位的靶点见图4。在度值>2、紧邻中心度>0.005 和中介中心度>0.003的基础上选取核心目标构建网络,借助网络拓扑进行分析,找出了25 个关键目标,见表1。排名前10 位的基因按MCC 算法评分由高到低的顺序依次为ESR1、NT5E、PGR、PIK3CA、PDE4D、ATM、ITPR1、PDE5A、PRKDC和PDE4A。

表1 JH抗AH核心作用靶点的拓扑学参数Table 1. Topological parameters of the core target of JH against AH

图3 JH抗AH的PPI网络Figure 3. PPI network of JH against AH
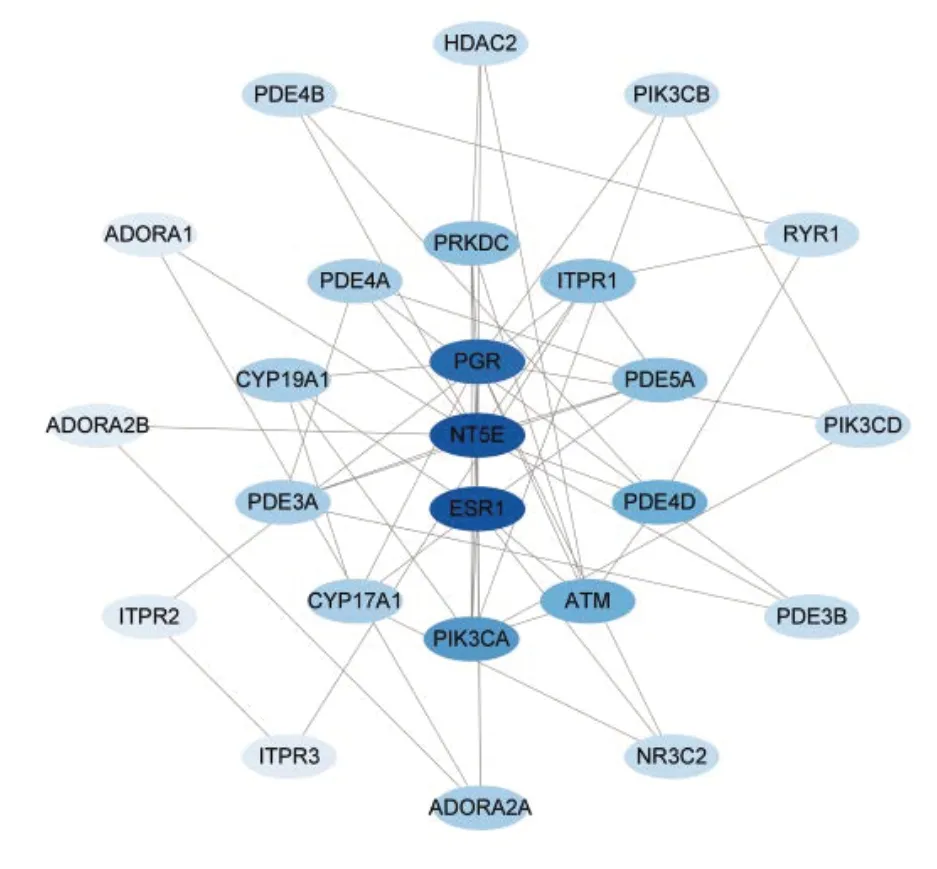
图4 JH抗AH作用核心靶点网络Figure 4 The core target network of JH against AH
2.3 GO功能富集分析
图5 展示了GO 功能富集分析中前10 个富集项目,这些目标点涉及多种BP,包含信号传递、反应缺氧、cAMP 的代谢分解;同时也与细胞膜、质膜、胞质溶质、细胞核周边区域等CC 有关;从MF 角度看,它们包括了3,5,-环核苷酸磷酸二酯酶活性、3,5,-环腺苷酸磷酸二酯酶活性、磷酸腺肌醇-3-激酶等。

图5 JH抗AH的GO功能富集分析Figure 5. GO enrichment analysis of JH against AH
2.4 KEGG通路富集分析
JH 抗AH 的KEGG 路径富集分析结果见图6,根据P值大小排列,展示了最相关的前20 个通路富集结果,cAMP 信号通道(cAMP signaling pathway)、雌激素信号通道(estrogen signaling pathway)以及嘌呤代谢(purine metabolism)等路径富集状况较丰富。

图6 JH抗AH的KEGG通路富集分析Figure 6. KEGG pathway enrichment analysis of JH against AH
2.5 JH与核心靶点的分子对接分析
将JH与ESR1核心靶点的分子进行对接操作,结合能量低表示这个分子对接更稳定。结合能低于-5.0 kcal·mol-1,说明配体与受体的自我结合有较强的亲和性。利用PyMOL 软件可视化展示对接后的结果,见图7。
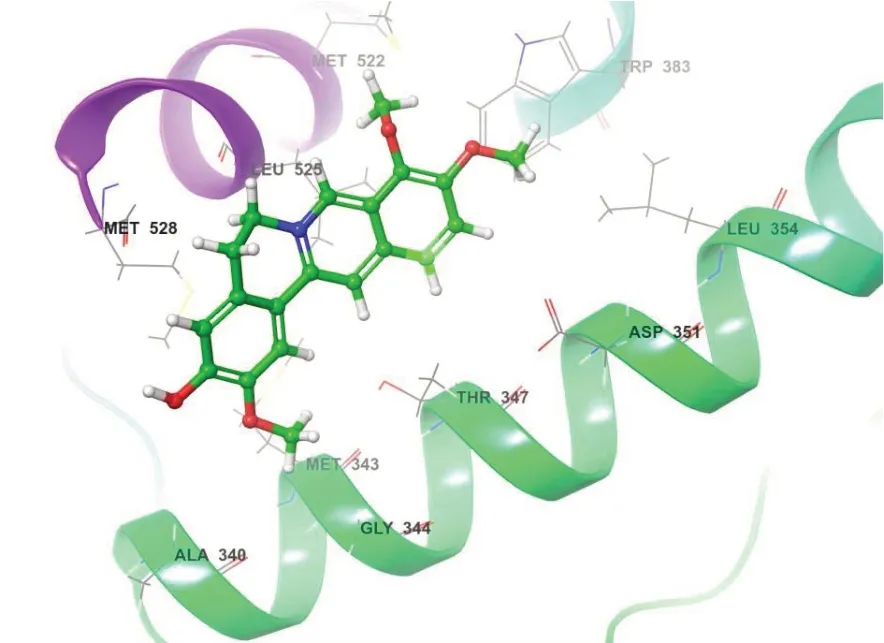
图7 JH与ESR1分子对接复合物成键信息三维图Figure 7. Three-dimensional diagram of bonding information between JH and ESR1 molecular docking complex
2.6 细胞体外实验结果
2.6.1 JH对RAW264.7巨噬细胞活力的影响
在5~100 μM 的浓度区间,JH 对RAW264.7巨噬细胞无任何副作用。当浓度达到100、75 和50 μM 时,JH 能刺激RAW264.7 巨噬细胞生长。因此,本研究选择这三个浓度分别作为JH 的高、中、低浓度参考值,见图8。

图8 JH对RAW264.7巨噬细胞增殖的影响Figure 8. Effect of JH on proliferation of RAW264.7 macrophages
2.6.2 JH对炎症模型细胞中炎症因子TNF-α、IL-6分泌的影响
与对照组相比,LPS 组RAW264.7 M1 型巨噬细胞关联的促炎细胞因子TNF-α 和IL-6 的分泌显著增加(P<0.05),见图9。与LPS 组相比,JH 组细胞上清液中的TNF-α 和IL-6 促炎因子分泌均降低(P<0.05)。随着JH 浓度提高,JH组TNF-α 和IL-6 的分泌也逐渐降低(P<0.05)。

图9 JH处理24 h对细胞上清中各炎症因子表达的影响Figure 9. Effect of JH treatment for 24 h on the expression of various inflammatory factors in the cell supernatant
3 讨论
随着我国经济社会的发展,人们的生活水平和饮食习惯有所改变,尤其是酒精消费量稳步升高,AH 的发病数量也随之逐年增加,已成为肝脏疾病的主要死亡原因。深入探究AH 的病因及防治方法对社会具有深远意义,应得到更为广泛的关注和重视[16]。
本研究首先基于TCMSP 数据库筛选JH 的成分靶点,再通过GO 富集与KEGG 通路分析,得到了25 个JH 治疗AH 的关键靶点,说明JH可通过多个靶点发挥抗炎作用。对JH 抗AH 的核心基因进行了GO 和KEGG 富集分析,结果显示,这些关键基因主要关联了信号传输、缺氧反应、G 蛋白偶联受体信号路径、3,5-环核苷酸磷酸二酯酶功能、3,5-环腺苷酸磷酸二酯酶功能等,主要影响的病理途径包括雌激素信号途径、嘌呤代谢和cAMP 信号途径等。此外,本研究利用STRING 数据库建立PPI 网络中的相互作用目标,发现了与AH 发病最密切相关的10 个基因,分别为ESR1、NT5E、PGR、PIK3CA、PDE4D、ATM、ITPR1、PDE5A、PRKDC和PDE4A。
ESR1是一种关于AH 疾病具有极高几率降低表达的基因,也是一种依赖配体的转录因子。它在肝脏内部结合雌激素及雌激素受体(尤指ESR1),能有效地缓解肝脏纤维化、延缓肝细胞死亡,同时抑制肿瘤细胞增长,这揭示了ESR1表达减少可能导致肝病的发生发展。窦橙云探讨了通过检测ESR1、DNMT3b和CDH1基因起始子的甲基化程度,早期乙型肝炎相关性肝癌中ESR1基因启动子甲基化情况是否能成为评估乙型肝炎肝衰竭患者短期28 天生存现状的生物学指标的可能性[17]。
炎症反应的功能为触发并释放IL-6、TNF-α等炎症因子及细胞因子,LPS 刺激巨噬细胞用于模仿人体在某一元素影响下产生的炎症反应。IL-6、TNF-α 等炎症因子在炎症产生与发展的进程中起了重要作用[18-21]。研究证实,TNF-α 是TNF 家族中起主导作用的一种炎症传递物质,主要在脂肪细胞和(或)周围组织中形成,能激发活性氧产生和各类转录调节途径的相关机制,从而引起特定组织的炎症反应[22]。
体外实验证实,当JH浓度为50、75和100 μM时,可以促进RAW264.7 巨噬细胞增殖。ELISA 实验数据显示,与对照组相比,LPS 组RAW264.7 细胞M1 型巨噬细胞相关炎性细胞因子TNF-α 和IL-6 的产生显著增多。然而,相对于LPS 组,JH组细胞的上清液中炎症因子TNF-α 和IL-6 的产生明显降低,且随着JH 浓度增高,其降低趋势更为明显。该结果初步表明,在炎症模型细胞中,JH可以调控M1极化,可能是治疗AH的潜在药物。
综上所述,本研究利用网络药理学探索JH的靶点,并发掘了治疗AH 的潜在靶点,通过PPI 网络获得了JH 治疗AH 的关键基因,为临床应用JH 治疗AH 提供了一定的参考。ESR1为治疗AH 的潜在靶点,但本研究仅利用分子对接技术验证,后续可进一步通过蛋白印迹法、qPCR、敲低等生物学技术加以验证,并通过动物实验进一步探究JH 治疗AH 的作用机制。
