青年结直肠癌中错配修复蛋白的表达及意义
2024-03-07黄克强黄秋霞文亦磊
黄克强,唐 华,黄秋霞,文亦磊
世界卫生组织国际癌症研究机构的数据显示,2020年全球新发结直肠癌193万例。我国是结直肠癌的高发区,2020年新诊断的结直肠癌人数超过55万[1]。结直肠癌好发于老年人,青年人亦有发病率增高的趋势。目前,错配修复(mismatch repair, MMR)蛋白功能缺失与结直肠癌的关系已有较多报道,但专门针对青年患者MMR蛋白表达的研究极少。本实验重点分析青年结直肠癌中MMR蛋白的表达及其与临床病理特征的关系,并通过随访数据进行生存分析,以进一步明确MMR蛋白表达在青年患者风险评估、诊断和预后判断中的意义。
1 材料与方法
1.1 临床资料收集2018年1月~2021年12月广西中医药大学第一附属医院385例结直肠癌患者的临床资料,其中男性226例(58.7%),女性159例(41.3%);年龄27~92岁,中位年龄64岁,平均(62±13)岁;根据年龄大小将患者分为青年组(≤40岁)和非青年组(>40岁),青年组25例(6.5%),非青年组360例(93.5%)。所有病例均行根治术并经术后病理证实,且均未发现其他器官原发恶性肿瘤。
1.2 试剂与方法鼠抗人MLH1、MSH2、MSH6、PMS2抗体和DAB显色试剂盒,均购自福州迈新公司,免疫组化染色采用EliVision两步法或使用Benchmark XT全自动免疫组化染色仪进行;操作步骤严格按试剂盒说明书进行。
1.3 结果判断肿瘤组织HE和免疫组化染色切片经2名病理科副主任医师共同阅片,在内对照(非肿瘤细胞核)着色良好的情况下,只要出现1个及以上癌细胞核呈棕黄色颗粒即为阳性,反之为阴性;错配修复完整(mismatch repair proficiency, pMMR)定义为4种蛋白均阳性,任意一种蛋白表达缺失则为错配修复缺陷(different mismatch repair, dMMR)[2-3]。
1.4 统计学分析采用SPSS 25.0软件进行统计学分析,组间比较采用χ2检验或Fisher精确概率法,等级资料采用Spearman秩检验,Kaplan-Meier法描绘生存曲线并进行Log-rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1 青年组与非青年组结直肠癌的临床病理特征对比分析385例结直肠癌中,dMMR组39例(10.1%)(图1A~C),pMMR组346例(89.9%)(图2A~C)。青年组中dMMR占36.0%(9/25),非青年组仅占8.3%(30/360),差异有统计学意义(P<0.001);青年组黏液腺癌占20%(5/25),非青年组黏液腺癌占4.4%(16/360),差异有统计学意义(P=0.004);其余的临床病理特征如性别、部位、肿瘤T分期、淋巴结转移和远处转移在青年组和非青年组间差异均无统计学意义(P>0.05,表1)。

表1 青年组与非青年组结直肠癌临床病理特征及MMR蛋白表达的比较[n(%)]

图1 腺癌细胞核中MLH1(A)、PMS2(B)和MSH2(C)蛋白均阴性,EliVision两步法
2.2 青年结直肠癌MMR蛋白表达与临床病理特征的关系青年组中MMR蛋白表达与患者性别和组织学类型有关,与发病部位、肿瘤分化程度、T分期和淋巴结转移无关,男性患者dMMR率高于女性(P=0.041),黏液腺癌中dMMR率高于非黏液腺癌(P=0.040);青年组黏液腺癌中dMMR占80%(4/5),非黏液腺癌dMMR仅占25%(5/20),差异有统计学意义(P=0.040,表2)。
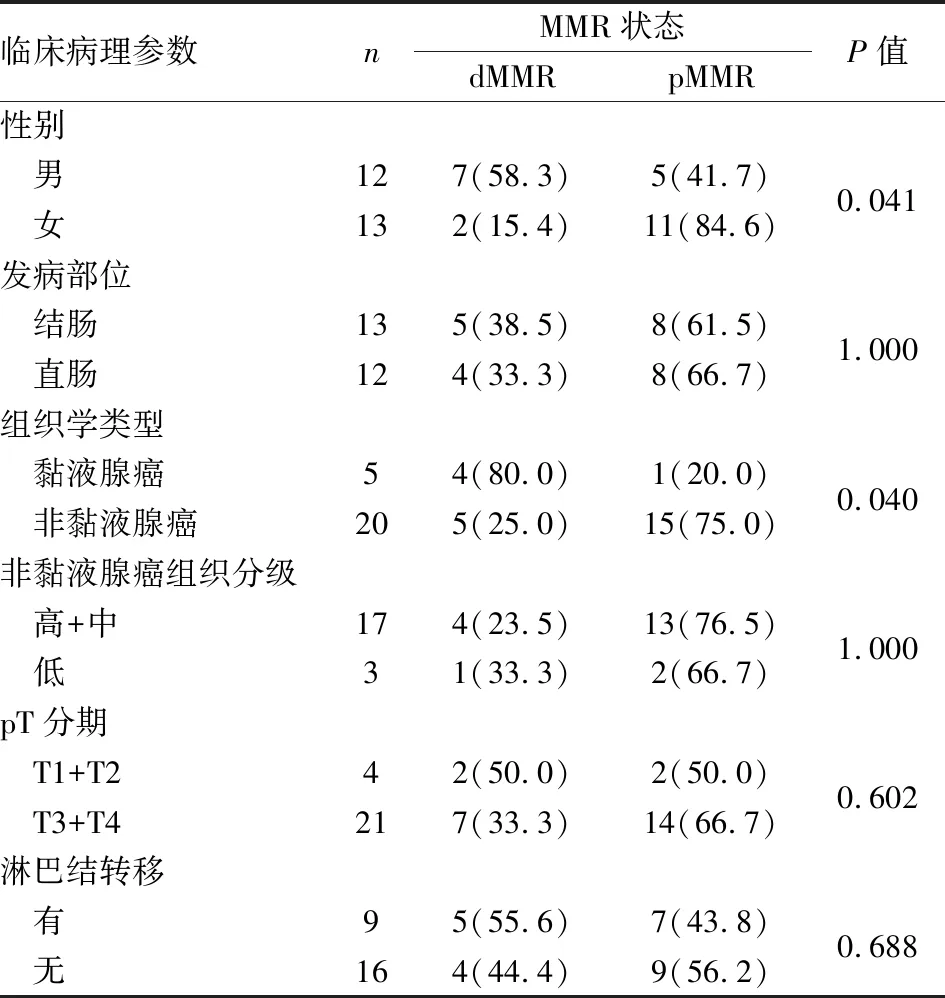
表2 青年组结直肠癌中MMR蛋白表达与临床病理特征的关系[n(%)]
2.3 MMR蛋白表达与青年组结直肠癌患者预后的关系25例青年组患者均有完整的随访资料,由于病例较少,将复发和死亡统一定义为阳性事件,通过Kaplan-Meier法绘制生存曲线并进行Log-rank检验,dMMR结直肠癌患者预后好于pMMR结直肠癌患者(χ2=101.451,P<0.001,图3),在随访期内dMMR组无复发或死亡病例;黏液腺癌组预后好于非黏液腺癌组,差异有统计学意义(χ2=70.267,P<0.001)。
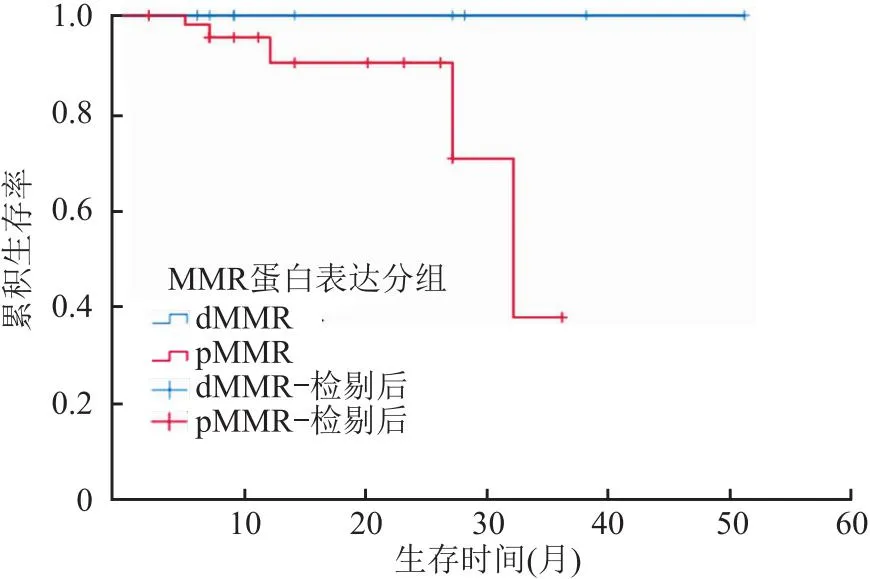
图3 Kaplan-Meier法分析MMR蛋白表达与青年组结直肠癌患者预后的关系
3 讨论
人类DNA错配修复过程中最重要的基因是MSH2、MSH6、MLH1和PMS2,它们转录表达的蛋白主要通过形成异二聚体MutLα(MLH1-PMS2)、MutSα(MSH2-MSH6)和MutSβ(MSH2-MSH3)发挥错配修复功能,其中MLH1和MSH2起主要作用[4-5]。当各种原因导致MMR基因功能缺陷时则无法修复损伤的DNA,即MMR功能缺陷,导致肿瘤的发生、发展[6]。
研究发现MMR蛋白表达缺失与结直肠癌多种临床病理特征,如年龄、肿瘤分级、T分期、淋巴结转移、是否为黏液癌等相关[3]。然而,有关青年结直肠癌患者的MMR蛋白表达研究极少。本研究发现青年组结直肠癌发生dMMR的比例达36%,远超非青年组的8.3%,结果与文献报道相符,而且男性比女性患者发生dMMR的比例更高,差异有统计学意义(P=0.041),但MMR蛋白表达与肿瘤分级、T分期、淋巴结转移无关(P>0.05),可能不同地域和性别人群的基因改变及发病机制不同,尚不能认为MMR蛋白表达缺失与肿瘤持续进展有关。进一步研究发现,青年组黏液腺癌中dMMR占80%(4/5),而非青年组黏液腺癌中dMMR仅占25%(5/20),提示MMR基因的缺陷是青年结直肠腺癌发病的重要原因,尤其是黏液腺癌可能主要从DNA微卫星不稳定途径的发展而来。检测青年人腺瘤中MMR蛋白的表达可能具有重要意义,dMMR患者癌变的概率增高,可以通过随访进行有效预防。
本文通过Kaplan-Meier法绘制生存曲线并进行Log-rank检验分析发现,dMMR组患者的预后好于pMMR组,在随访期内dMMR组无复发或死亡病例,与文献报道的中青年(59岁以下)结直肠dMMR组患者预后较好结果一致[7]。本组青年组黏液腺癌预后好于青年组非黏液腺癌,可能与dMMR主要发生于黏液腺癌有关,进一步提示dMMR患者预后较好,其主要原因可能与肿瘤本身DNA倍体特征和治疗反应有关。谢丹等[8]报道MMR蛋白表达缺失的结直肠癌全部是二倍体或近二倍体的肿瘤,二倍体肿瘤恶性度低,这可能是导致该类型肿瘤预后较好的主要原因。Llosa等[9]研究发现,免疫检查点蛋白程序性死亡因子-配体1(programmed death factor-ligand 1, PD-L1)在微卫星不稳定的肿瘤细胞中表达上调,抑制T细胞活化及其免疫功能,肿瘤细胞得以存活。Le等[10]使用程序性细胞死亡蛋白-1(programmed cell death protein-1, PD-1)抑制剂治疗微卫星不稳定的结直肠癌患者取得较好的效果。Cheng等[11]使用PD-1抑制剂治疗86例MMR缺陷的肿瘤患者,客观缓解率和完全缓解率分别达53%和21%。2017年,美国FDA批准免疫检查点抑制剂应用于任何MMR缺陷的实体肿瘤[12]。dMMR结直肠癌患者可能从免疫治疗中获益。中国结直肠癌诊疗规范(2020)[13]推荐检测结直肠癌患者MMR蛋白表达或微卫星不稳定,用于疾病筛查、预后分层和指导免疫治疗等。
以往有研究[14-15]认为青年结直肠癌患者有更高的组织学分级、分期、淋巴结和远处转移率,预后更差,而本研究发现青年和非青年结直肠癌患者的肿瘤分级、T分期、淋巴结及远处转移差异均无统计学意义(P>0.05),而且青年组发生dMMR比非青年组的比例高,随访数据显示青年dMMR组的患者预后极好,因此并不能认为非青年患者预后更差,并推测dMMR可作为青年结直肠癌预后良好的预测因子。
综上所述,MMR蛋白表达缺失可能在青年结直肠癌的发病中起重要作用,尤其可能是青年黏液腺癌患者的主要致病因素;检测青年人腺瘤中MMR蛋白的表达可能具有重要意义,对于存在MMR蛋白表达缺失的患者可以通过肠镜随访等手段在尚未发生癌变时及时发现;青年组黏液腺癌+dMMR组患者预后较好。由于本组病例数较少,后续需要积累大样本进行深入探究。