放疗对卵巢癌顺铂耐药细胞的影响
2024-03-06姜清芳
姜清芳
(开封市肿瘤医院放疗科,河南 开封 475000)
卵巢癌是常见的女性生殖系统恶性肿瘤,发病率、病死率分别居女性恶性肿瘤的第五位、第一位,且>80%的患者在确诊时已发生远处转移(如腹部转移),预后不良[1]。目前肿瘤细胞减灭术联合铂类药物为主的化疗仍是治疗卵巢癌的主要方式,可在一定程度上改善患者预后,但5年生存率仅为30%~40%[2]。顺铂(cisplatin,CDDP)是临床一线抗肿瘤化疗药,其耐药所致的肿瘤原发部位或腹腔转移部位复发是化疗失败及患者死亡的主要原因。由此可见,探究逆转卵巢癌CDDP耐药的有效方式至关重要。放疗是19世纪以来广泛应用于医学领域的治疗方式,同步放化疗可尽可能彻底杀灭包括远处转移的癌细胞,保留器官功能,推测与其化疗增敏效应有关。再次或多次化疗可能导致多药耐药进而降低肿瘤化疗敏感性已是共识,但目前关于放疗是否会影响化疗耐受的报道并不多[3-4]。本研究通过选取卵巢癌SKOV3细胞株及SKOV3/CDDP耐药细胞株,探究放疗对其耐药性的影响,并探讨相关机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 SKOV3、SKOV3/CDDP细胞株购自广州天元生物科技有限公司,培养于RPMI 1640培养基(pH值 7.2~7.4,含有10%新生牛血清,链霉素100 U·mL-1,青霉素100 U·mL-1),标准条件(饱和湿度,37 ℃,5% CO2)培养箱。培养SKOV3/CDDP细胞株时加入浓度1 mg·L-1的CDDP用于维持其CDDP耐药性,隔日换液,倒置显微镜下观察,细胞贴壁生长,形态良好。SKOV3/CDDP细胞株在用于实验前停用含有CDDP的培养基>2周。
1.1.2 药物、主要试剂和仪器 CDDP(贵州汉方制药有限公司,国药准字H20020273,规格:50 mL:CDDP 50 mg与氯化钠450 mg);二甲基噻唑(dimethylthiazole,MTT)溶液、二甲基亚砜(dimethyl sulfoxide,DMSO)溶液(北京中生瑞泰科技有限公司);FITC-Anexin V染液、碘化丙啶(propidium iodide,PI)染液(上海联迈生物工程有限公司);β-链蛋白(β-catenin)、p-β-catenin、骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene,c-myc)、细胞周期蛋白-D1(cyclin-D1)单克隆抗体(美国Abcam公司);辣根过氧化物酶标记的山羊抗兔IgG二抗(北京中山金桥生物技术有限公司)。SpectraMax M5/M5e酶标仪(美国Molecular Devices公司);FACS Calibur流式细胞仪(美国BD公司);Fluor Chem FC2凝胶成像系统(美国Life Technologies公司)。
1.2 方法
1.2.1 MTT法检测SKOV3、SKOV3/CDDP对CDDP敏感性 取对数期SKOV3、SKOV3/CDDP细胞,0.25%胰蛋白酶消化,稀释为密度8×104mL-1单细胞悬液,接种至96孔板(每孔100 μL),标准条件(37 ℃,5% CO2饱和湿度)培养24 h,将孔中培养液吸出,加入RPMI 1640培养液稀释CDDP为1.00、2.00、4.00、8.00、16.00、32.0、64.00 mg·L-1,每孔100 μL,并设置仅含有RPMI 1640培养液的空白对照组,及仅含有细胞及RPMI 1640培养液的阴性对照组。同条件继续培养48 h,加入新鲜制备MTT溶液(每孔20 μL,5.00 g·L-1),4 h后弃上清,加入DMSO溶液(每孔150 μL),充分振荡10 min至甲瓒颗粒充分溶解,酶标仪检测各组吸光度值(A492 nm),计算增殖抑制率(%)=(1—实验组A492 nm/空白对照组A492 nm)×100%,绘制抑制率曲线,获取CDDP对SKOV3、SKOV3/CDDP细胞的半数抑制剂量(half inhibitory concentration,IC50),并计算耐药指数(resistance index,RI)=SKOV3/CDDP细胞的IC50/SKOV3细胞的IC50。
1.2.2 MTT法检测放疗对SKOV3/CDDP的杀伤作用 取对数期SKOV3/CDDP细胞,采用CDDP处理,浓度及方式同1.2.1。将细胞带至放疗室,采用不同照射模式,低剂量分割:0.5 Gy×4次放疗,分别在连续两日的10:00、16:00进行放疗,低剂量与常规剂量在低剂量组分割最后一次放疗时分别以0.5 Gy、2 Gy剂量进行放疗。继续培养48 h后,加入新鲜制备MTT溶液(每孔20 μL,5.00 g·L-1),4 h后弃上清,加入DMSO溶液(每孔150 μL),充分振荡10 min至甲瓒颗粒充分溶解,酶标仪检测各组吸光度值(A492 nm),计算增殖抑制率,获取耐药逆转倍数(reversal fold,RF)=IC50(CDDP)/IC50(放疗+CDDP)。
1.2.3 平板克隆实验 取对数期SKOV3/CDDP细胞,细胞铺满80%左右时经0.25%胰蛋白酶消化,加入培养基终止,轻吹细胞至成细胞悬液,调整浓度至50个·mL-1。接种至12孔板,加入细胞悬液(每孔2 mL),每组设置5个复孔。于标准条件(37 ℃,5% CO2饱和湿度)继续培养,每3 d更换新鲜培养基,第10天计数各孔中细胞集落数,集落形成标准:细胞数≥50个/克隆。细胞集落形成率=细胞集落数/初始细胞接种数×100%。
1.2.4 流式细胞术检测细胞凋亡率 取对数期SKOV3/CDDP细胞,采用CDDP浓度为8.00 mg·L-1的RPMI 1640培养液培养48 h,同时在该时间段每天的10:00、16:00进行0.5 Gy×4次放疗,设为低剂量分割放疗组,取仅CDDP处理的SKOV3/CDDP细胞设为空白组。收集2组干预至48 h的细胞,PBS洗涤3 min×2次,重悬,2 800 r·min-1离心15 min,加入FITC-Anexin V、PI染液各5 μL,摇匀后避光孵育30 min,binding buffer标记液洗涤3 min×2次,1 h内经流式细胞仪检测凋亡率,CellQuest软件分析。
1.2.5 PI染色检测细胞周期 取空白组、低剂量分割放疗组细胞,细胞铺满80%左右时经0.25%胰蛋白酶消化,加入培养基终止,轻吹细胞至松散,转移至离心管中,4 ℃,2 800 r·min-1离心15 min,弃上清;加入5 mL 70%预冷乙醇,混合均匀,4 ℃固定过夜,2 500 r·min-1离心5 min,5 mL预冷PBS冲洗、重悬细胞;加入PI染液(RNaseA 10 μL,染色缓冲液0.5 mL,PI染液25 μL),遮光冰浴25 min;采用300细胞滤网过滤,流式细胞仪检测488 nm波长位置红光通道荧光信号,经配套软件行周期拟合分析。
1.2.6 Western blot检测cyclin-D1、c-myc、p-β-catenin、β-catenin蛋白表达 取空白组、低剂量分割放疗组细胞,PBS洗涤3 min×2次,RIPA细胞裂解液冰上裂解30 min,BCA蛋白试剂盒定量蛋白,根据定量结果校正蛋白样本。将蛋白与上样缓冲液按照比例混合,100 ℃水浴5 min使蛋白变性;每孔上样40 μg待测样本,恒定电压下行SDS-PAGE凝胶电泳分离,湿法转膜,加入封闭液常温封闭2 h,加入兔抗人cyclin-D1、c-myc、p-β-catenin、β-catenin(工作浓度1∶1 000)单克隆抗体,4 ℃孵育过夜,TBTS漂洗3 min×2次,加入山羊抗兔IgG二抗(1∶8 000),常温孵育2 h,TBTS漂洗。暗室加入ECL显影剂显影,Fluor Chem FC2凝胶成像系统扫描、分析,以目的基因灰度值/内参GAPDH灰度值表示蛋白相对表达量。

2 结果
2.1 不同浓度CDDP对SKOV3、SKOV3/CDDP细胞的增殖抑制作用 CDDP对SKOV3、SKOV3/CDDP细胞的IC50分别为2.41、6.15 mg·L-1,SKOV3/CDDP对DDP的RI为2.55倍,与购买耐药细胞株时的说明书基本符合。见表1、图1。
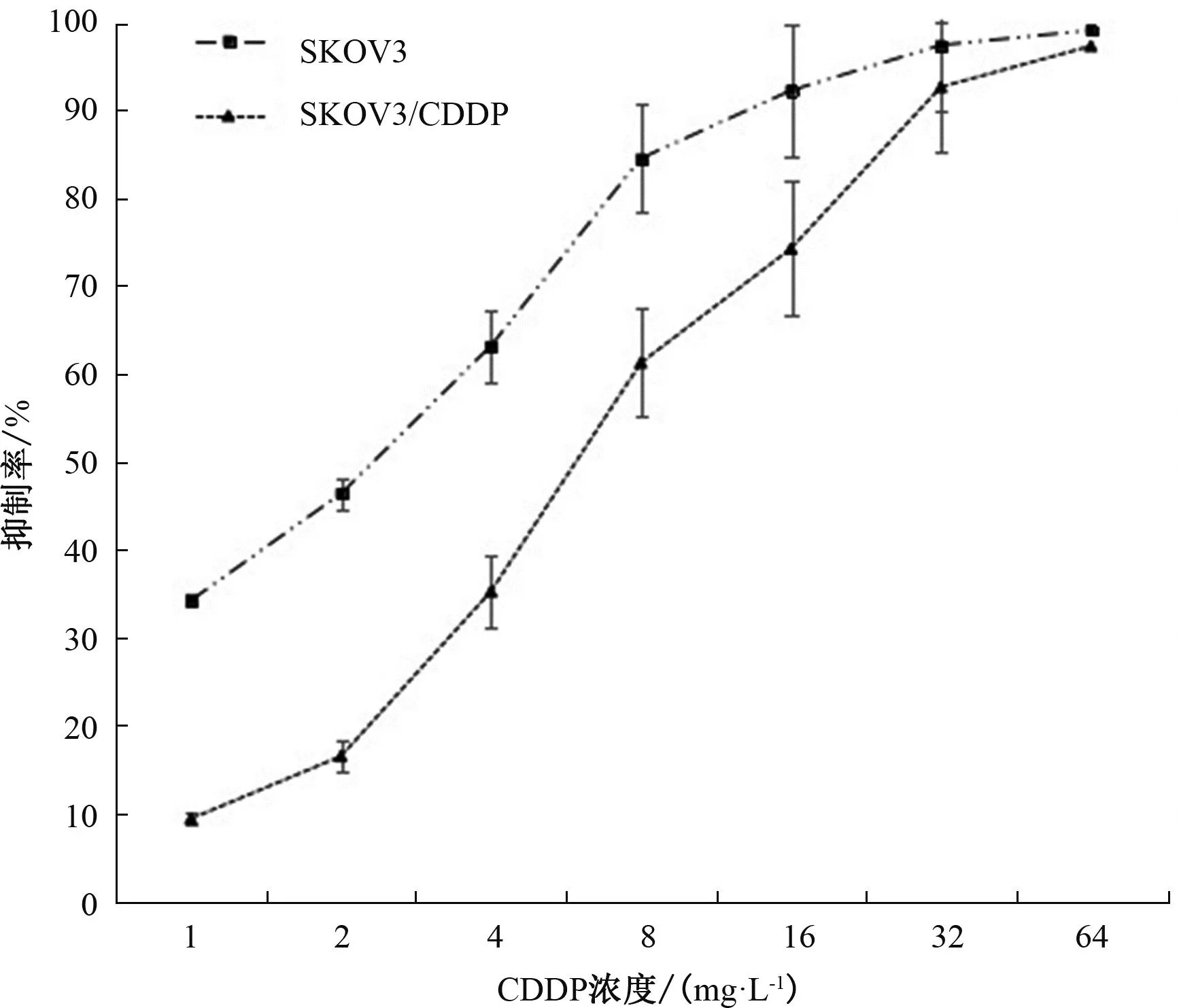
图1 CDDP对SKOV3、SKOV3/CDDP细胞的增殖抑制率
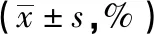
表1 不同浓度CDDP对SKOV3、SKOV3/CDDP细胞的增殖抑制率比较
2.2 不同放疗方式对SKOV3/CDDP细胞的增殖抑制作用 不放疗、0.5 Gy、0.5 Gy×4次、2 Gy时,CDDP对SKOV3/CDDP细胞的IC50分别为6.15、5.17、3.92、4.31 mg·L-1,0.5 Gy、0.5 Gy×4次、2 Gy时RF分别为1.19、1.57、1.43,表明0.5 Gy×4次放疗对SKOV3/CDDP细胞化疗增敏效果最好。因此,将顺铂浓度8.00 mg·L-1、0.5 Gy×4次放疗作为后续实验条件。见表2、图2。
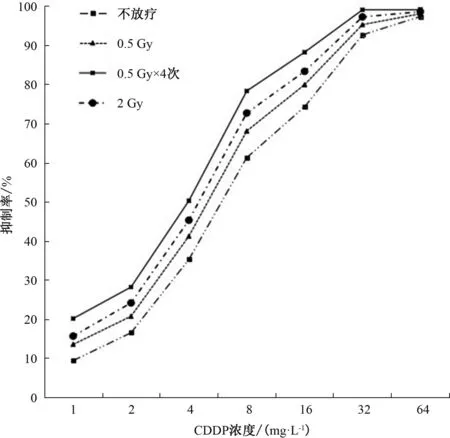
图2 不同放疗方式对SKOV3/CDDP细胞的增殖抑制率
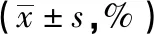
表2 不同放疗方式对SKOV3/CDDP细胞的增殖抑制率比较
2.3 克隆形成率比较 空白组、低剂量分割放疗组克隆形成率分别为(40.26±5.73)%、(22.94±3.30)%,低剂量分割放疗组克隆形成率低于空白组(P<0.05)。见图3。
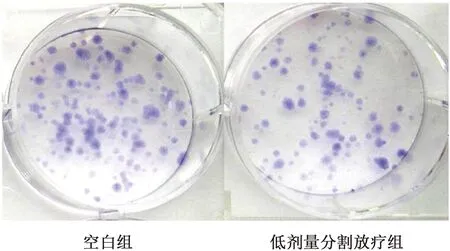
图3 平板克隆实验结果
2.4 凋亡率比较 空白组、低剂量分割放疗组凋亡率分别为(17.02±2.58)%、(36.94±4.01)%,低剂量分割放疗组凋亡率高于空白组,差异有统计学意义(P<0.05)。图4。
2.5 细胞周期比较 低剂量分割放疗组G0/G1占比高于空白组,S、G2/M占比低于空白组,差异有统计学意义(P<0.05)。见表3、图5。
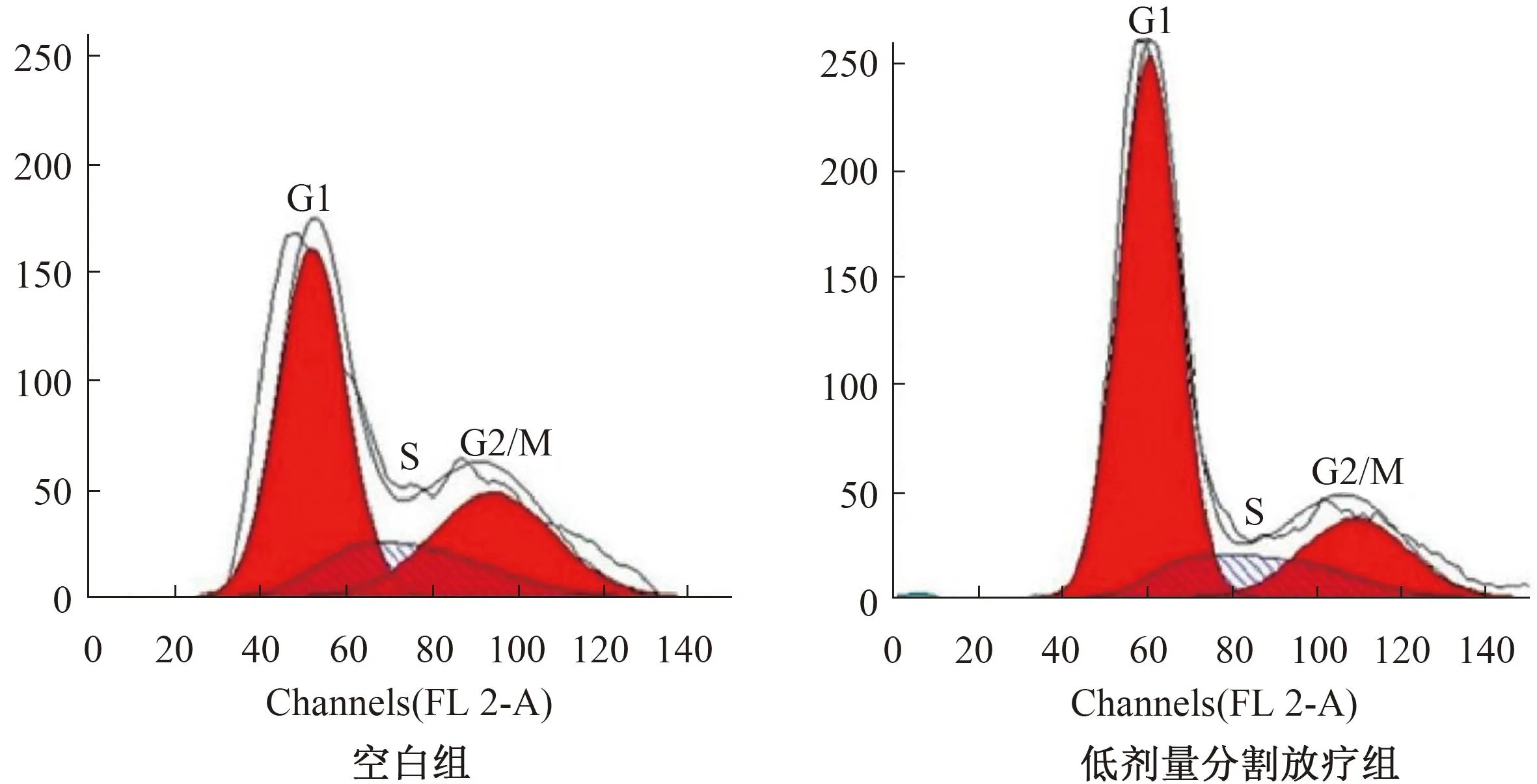
图5 细胞周期分布流式图
表3 2组细胞周期分布比较
2.6 cyclin-D1、c-myc蛋白表达,p-β-catenin/β-catenin比较 低剂量分割放疗组cyclin-D1、c-myc蛋白相对表达量,p-β-catenin/β-catenin低于空白组,差异有统计学意义(P<0.05)。见表4、图6-7。
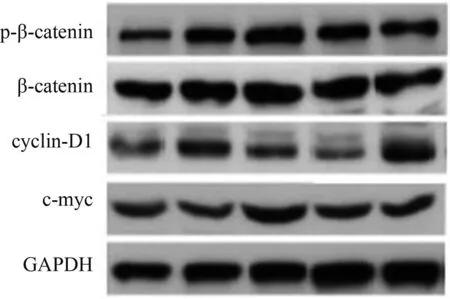
图6 空白组p-β-catenin、β-catenin、cyclin-D1、c-myc蛋白表达Western Blot图

图7 低剂量分割放疗组p-β-catenin、β-catenin、cyclin-D1、c-myc蛋白表达Western Blot图
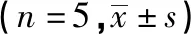
表4 2组cyclin-D1、c-myc蛋白表达,p-β-catenin/β-catenin比较
3 讨论
卵巢癌细胞的耐药性多发生于用药过程中,在化疗初期,肿瘤细胞较正常细胞对化疗药物更为敏感,但随着药物的长期应用,肿瘤细胞较正常细胞对所用抗癌药物及其他结构甚至作用机制不同的化疗药物敏感性更低,即产生耐药性[5-6]。卵巢癌CDDP耐药是多因素、多基因综合作用所致,目前关于其发生机制尚待完全明确,通常认为与细胞中CDDP有效浓度降低、CDDP介导DNA损伤时致命信号通路改变、DNA损伤修复能力增强、凋亡相关基因异常表达等有关[7-8]。CDDP耐药性可显著影响卵巢癌患者生存率,故探寻合适的化疗增敏方式,抵抗化疗耐药是改善耐药卵巢癌预后的关键。
放化疗联合的序贯治疗,有利于降低局部肿瘤负荷,且对卵巢癌切除术后残留微小病灶的患者效果更佳[9]。尽管卵巢癌病灶对放射线具有中度敏感性,但病灶周围组织对放疗的耐受性较低,易导致泌尿系统、消化系统等并发症。然而,有学者发现[10],与常规剂量放疗不同,低剂量辐射可诱导糖酵解,促进正常细胞与组织对后续高剂量放疗产生适应性保护,增强放疗抗性,提示低剂量放疗在肿瘤治疗中更具优势。AL-RAJHI等[11]报道指出,在多西紫杉醇和CDDP诱导化疗联合同步放化疗的同时加用低剂量分割放疗在局部区域控制率及无远处转移生存率上可获取更高收益。而关于放疗对化疗增敏性方面,有研究[12]认为,低剂量全腹放疗联合每周紫杉醇治疗铂类耐药卵巢癌具有协同活性,并观察到令人鼓舞的疗效。由此可推测,低剂量分割放疗可能具有化疗增敏作用,用于化疗耐药肿瘤的治疗。本研究结果显示,采用低剂量分割放疗处理SKOV3/CDDP耐药细胞株,可抑制其增殖,促进其凋亡,将细胞阻滞于G0/G1期,使其不能进入S期而死亡,提示低剂量分割放疗可增强卵巢癌CDDP耐药细胞化疗敏感性。
Wnt/β-catenin信号通路是常见的肿瘤干细胞通路,其作为交叉环节介导多种信号通路转导,参与细胞分化、增殖及肿瘤发生。有研究[13]显示,激活Wnt/β-catenin信号通路可增强胰腺癌细胞的多药耐药性,且降低该通路活性可抑制胰腺癌细胞增殖及上皮间质转化介导的转移,以该通路相关分子作为化疗增敏的新靶点备受肿瘤及药物研究者的关注。β-catenin、cyclin-D1、c-myc是Wnt/β-catenin信号通路重要成员,其中β-catenin作为一种黏附分子通过结合钙依赖性跨膜糖蛋白胞内段等来介导细胞间黏附,并维持其形态,随着其表达增加,多耐药基因水平相应上调,从而增强细胞耐药性。有证据表明[14-15],β-catenin在细胞中大量累积是Wnt/β-catenin信号通路活化的关键,β-catenin自胞浆转至细胞核结合对应基因并激活cyclin-D1、c-myc等下游基因,抑制Wnt/β-catenin信号通路主要通过调节β-catenin表达及其磷酸化作用实现。c-myc、cyclin-D1同时具备刺激细胞增殖、诱导细胞凋亡的作用,通过调节细胞周期发挥生物学效应,当其异常高表达时将加快细胞分裂至S期的速度,同时抑制细胞程序性凋亡,降低细胞化疗敏感性。ZHU等[16]在研究柚皮苷对卵巢癌SKOV3/CDDP细胞CDDP耐药性逆转的作用时发现,细胞中p-β-catenin、c-Myc和cyclin D1蛋白水平显著降低,推测该通路可能与卵巢癌耐药性的获得相关。本研究结果显示,采用低剂量分割放疗处理SKOV3/CDDP耐药细胞株后cyclin-D1、c-myc蛋白相对表达量及β-catenin磷酸化水平明显降低,提示低剂量分割放疗对卵巢癌耐药细胞株的化疗增敏作用可能通过抑制Wnt/β-catenin信号通路相关基因表达来实现。
综上所述,低剂量分割放疗可抑制卵巢癌顺铂耐药细胞增殖,促进其凋亡,具有化疗增敏作用,推测其作用机制与抑制Wnt/β-catenin信号通路有关。然而,本研究尚存在一些不足,即对低剂量分割放疗影响化疗敏感性的机制尚在猜测阶段,在客观条件的限制下未使用Wnt/β-catenin信号通路激活剂进行反向实验,可作为今后研究方向。
