“茶叶对水中金属离子的吸附”物理化学设计性实验
2024-03-05毕慧琴卫艳新
王 慧,毕慧琴,颜 瑞,卫艳新
(1.合肥师范学院化学与化学工程学院,安徽合肥 230601;2.安徽工程大学化学与环境工程学院,安徽芜湖 241000)
水是人类赖以生存和社会发展的自然资源,也是社会可持续发展的重要因素。随着社会工业的不断发展,水的重金属污染越来越严重,重金属容易通过食用水、粮食等途径进入人体内部,对人体健康造成影响[1]。因此找到一些方法去除废水中的重金属尤为重要。近年来,各国学者都在积极研制价格低廉、高吸附性能的新型吸附剂,其中生物质材料在吸附方面的应用研究引起了人们的关注,其具有低成本、可再生、安全无毒、可重复利用、节能减排等特点,在处理重金属方面占据了很重要的地位。茶叶是一种具有多孔结构的生物质材料,具有优异的空隙结构,使其可以与被吸附物质充分接触,达到良好的吸附效果[2]。
传统的物理化学验证实验一般难度较低,实验内容单一,实验成绩考核方式较简单,无法达到培养创新型人才的目的。物理化学设计性实验的开展有助于学生在实验设计的过程中培养创新能力和独立思考能力。设计性实验不只是简单地重复一些基础实验,而是基础实验的提升,要求学生对于基础实验的内容学以致用。本次物理化学设计性实验是在大三上学期开课,学生已经在分析化学实验、仪器分析化学实验、有机化学实验和无机化学实验中进行了大量的实验基本技能操作训练,拥有了一定的实验基本技能,通过物理化学设计性实验可以培养学生的科学研究能力。本实验利用茶叶良好的吸附性能,研究影响茶叶吸附重金属的初始浓度、吸附时间、pH、吸附温度等因素,分析学习吸附能力及吸附动力学内容。
1 实验目的
(1)了解吸附法的基本原理和主要应用领域,理解吸附量、饱和吸附量、等温吸附方程。
(2)设计实验方案,研究茶叶对金属离子的吸附性能。
(3)设计水中金属离子的定量分析方法。
2 实验要求
(1)设计一种重金属离子溶液的配制和含量测定方法。
(2)优化茶叶对重金属离子的吸附条件,考查茶叶对重金属离子的等温吸附方程。
(3)处理实验数据,归纳总结茶叶对重金属离子的性能影响,提出吸附的最佳工艺条件。
3 实验原理
吸附量按下式计算:
式中:Г—吸附量,mol/g;C0、C—吸附前后金属离子浓度,mol/L;V—被吸溶液的体积,L;w—吸附剂茶叶的质量,g。
若为单分子层吸附,平衡吸附量与吸附平衡浓度之间符合Langmiur等温吸附方程:
式中:Г—吸附量,mol/g;Г∞—饱和吸附量,mol/g;c—吸附平衡溶液浓度,mol/L;b—吸附系数,L/mol。
Fe3+的检测方法:邻二氮杂菲分光光度法测定Fe2+,测定之前需要先加盐酸羟胺将Fe3+全部还原为Fe2+,其反应方程式为:
在pH=2~9 的条件下,Fe2+与邻二氮杂菲生成稳定的橘红色配合物[Fe(Phen)3]2+,该配合物的最大吸收峰在510 nm 处,摩尔吸光系数ε510=1.1×104L/(mol·cm)。测定时,控制溶液的酸度(pH=1左右),防止Fe2+水解,影响显色。本实验主要研究茶叶对水中Fe3+的吸附。
分光光度法在测定物质含量时,一般要经过取样、显色和测量等步骤。为了得到较高的灵敏度、选择性和准确度,必须选择适宜的显色条件和吸光度测量条件。吸光度测量条件主要有测量波长、吸光度范围和参比溶液等,该测定方法不仅灵敏度高,稳定性好,而且选择性高。
茶叶中含有大量的吸附活性中心,如-OH、=NH、>C=C<、>C=O、二氮杂环及多元酚类等,这些基团在适宜条件下与金属离子发生不同反应,即可将金属离子吸附在茶叶上,并且多元酚类物质具有活性羟基,可使多种金属离子沉淀,用甲醛处理后发生酚醛缩合,既提高了物理吸附能力,又增强了化学吸附能力[4]。
4 实验试剂与仪器
4.1 实验试剂
1 g/L 邻二氮杂菲溶液,1 mol/L NaAc 溶液,2 mol/L HCl溶液,10 μg/mL铁标液,100 g/L盐酸羟胺溶液(用时现配),1 000 μg/mL Fe3+溶液。
4.2 实验仪器
50 mL容量瓶若干,圆底烧瓶,紫外-可见光分光光度计,电子天平,1 000 mL 容量瓶若干,1 mL、2 mL、3 mL、10 mL吸量管若干,100 mL碘量瓶若干,烧杯,恒温水浴锅等。
5 实验过程与结果讨论
5.1 改性茶叶的制备
称取10 g茶叶于圆底烧瓶中,依次加入50 mL 40%的甲醛溶液,200 mL 0.02 mol/L 的稀硫酸溶液,充分振荡,60℃水浴加热回流4 h,用水洗至中性,烘干,备用。
5.2 不同浓度Fe3+溶液的配制
分别从1 000 μg/mL 铁贮备液的容量瓶中移取20 mL、40 mL、60 mL、80 mL、100 mL的铁溶液加入到对应的1 000 mL 容量瓶中,调至pH=1 左右,定容摇匀得到对应的铁溶液,即浓度为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的铁溶液。
5.3 吸收曲线与标准曲线的绘制
取6 个容积为50 mL 的容量瓶,编号1~6,分别准确移取10 μg/mL 铁标液0.0 mL、2.0 mL、4.0 mL、6.0 mL、10.0 mL于6个容量瓶中(其中不加铁标液的所得为空白溶液,用来作参比溶液),然后向容量瓶中各加入1 mL 盐酸羟胺溶液,摇匀静置2 min,依次加入5 mL NaAc溶液和3 mL 邻二氮杂菲溶液,加入蒸馏水定容放置10 min。以空白溶液作参比,用1 cm的比色皿,选择4 号容量瓶(即浓度为1.2 μg/mL 的铁标液)中的溶液,在430~560 nm 之间,每隔10 nm 测定一次吸光度(其中在490~530nm 之间每隔5 nm 测定一次),并记录数据,找到最大吸收波长。从测试的数据可以看出最大吸收波长为510 nm,见图1。
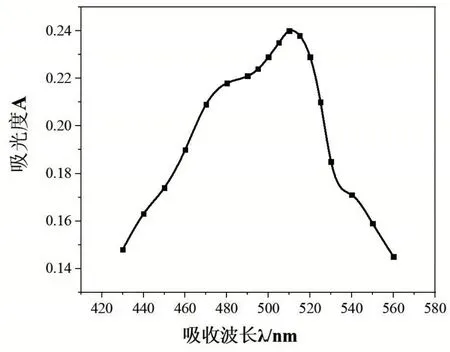
图1 铁标液的吸收波长与对应的吸光度
以空白溶液作参比溶液,用1 cm比色皿,在最大波长处分别测定2~6号容量瓶的溶液吸光度,记录数据并绘制标准曲线,见图2。

图2 铁标液标准曲线图
从浓度为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL 的五个铁溶液容量瓶中分别移取1 mL溶液加入到50 mL 容量瓶中,编号7~11。向容量瓶中分别加入1 mL盐酸羟胺溶液,摇匀静置2 min之后依次加入5 mL NaAc 溶液和3 mL 邻二氮杂菲溶液,加入蒸馏水定容摇匀放置10 min。以空白溶液作参比,用1 cm 比色皿,在最大吸收波长510 nm 处测定编号为7~11 的容量瓶中溶液的吸光度,记录数据并对照吸收曲线,确定各浓度溶液的准确浓度,见表1。
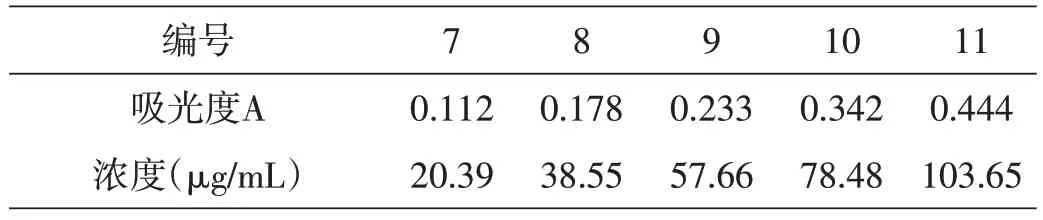
表1 各浓度铁溶液的吸光度对应的浓度大小
5.4 吸附时间对吸附的影响
量取50 mL 初始浓度为60 μg/mL 的铁溶液加入到碘量瓶中,加入约0.5 g(准确称量并记录)改性后的茶叶,在50℃水浴锅中水浴加热,从加入茶叶开始计时,每隔半个小时(30 min、60 min、90 min、120 min、150 min)从碘量瓶中吸取1 mL 的溶液转移到50 mL 容量瓶中,按照时间顺序容量瓶编号12~16,向容量瓶中分别加入1 mL 盐酸羟胺溶液,摇匀静置2 min 之后依次加入5 mL NaAc 溶液和3 mL 邻二氮杂菲溶液,加入蒸馏水定容摇匀放置10 min。以空白溶液作参比,用1 cm 比色皿,在最大吸收波长510 nm 处测定编号为12~16 容量瓶中溶液的吸光度,并记录数据,吸附时间对吸附的影响结果如图3所示。
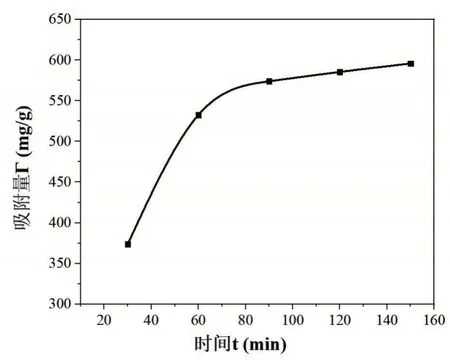
图3 吸附时间对吸附的影响
由图3 可知,在60 min 时吸附增长减慢,在此之前吸附量与时间呈直线上升关系,吸附量增长迅速,显示出离子交换的特征。60 min 之后,增长较缓慢,吸附时间越长,曲线越趋于平缓。另外,由于茶叶中的茶氨酸、茶多酚和咖啡因以及酚类衍生物对重金属有络合作用,因此这个过程还包括Fe3+被快速络合和吸附[4]。由此可以看出,最佳的吸附时间为60 min 左右。吸附时间小于60 min 时,吸附量随时间变化增长较快,时间越短,吸附效果越差;吸附时间大于60 min时,吸附量随时间增长变化不大,没有实际意义。
5.5 初始浓度对吸附的影响
量取50 mL 不同初始浓度的铁溶液(20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL)加入到碘量瓶中,置于50℃的水浴锅中预热10 min,然后向碘量瓶中分别加入0.5 g(准确称量并记录)改性后的茶叶,加入茶叶后开始计时,吸附进行90 min后,分别从碘量瓶中移取1 mL溶液至50 mL容量瓶中,编号17~21。向容量瓶中分别加入1 mL盐酸羟胺溶液,摇匀静置2 min之后依次加入5 mL NaAc 溶液和3 mL 邻二氮杂菲溶液,加入蒸馏水定容摇匀放置10 min。以空白溶液作参比,用1 cm 比色皿,在最大吸收波长510 nm 处测定编号为17~21的容量瓶中溶液的吸光度,结果见图4。
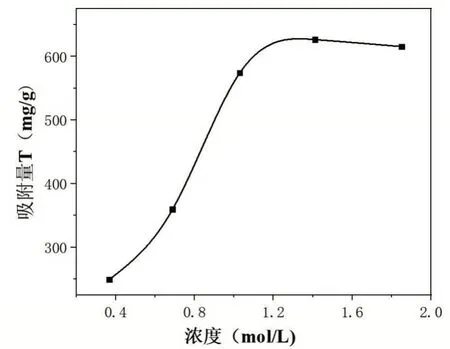
图4 初始浓度对吸附的影响
由图4可知,当初始浓度C0<1.20 mol/L时,随着初始浓度C0的增加,吸附剂对Fe3+的吸附量逐渐增加,并且初始浓度C0与吸附量呈直线的增长趋势。当初始浓度C0>1.20 mol/L 时,吸附量随初始浓度的增长变化较小,增长缓慢,当初始浓度C0≈1.70 mol/L 时,达到吸附剂对Fe3+的最大吸附量,吸附达到饱和。之后随着初始浓度C0的增加,吸附量呈现缓慢的减少趋势。由此可以看出,实验最佳的初始浓度在1.20~1.30 mol/L,小于最佳初始浓度达不到最好的吸附效果,大于该浓度随初始浓度的增长吸附量增长较小,达不到理想效果。
5.6 吸附温度对吸附的影响
量取50 mL 初始浓度为60 μg/mL 的铁溶液加入到碘量瓶中,在不同温度(30℃、50℃、70℃、90℃)的环境下进行吸附。在不同温度(30℃、50℃、70℃、90℃)的水浴锅中水浴预热10 min,然后分别加入约0.5 g(准确称量并记录)改性后的茶叶,从加入茶叶开始计时,90 min后从4 个碘量瓶中分别吸取1 mL 的溶液转移到50 mL 容量瓶中,容量瓶编号22~25,向容量瓶中分别加入1 mL盐酸羟胺溶液,摇匀静置2 min 之后依次加入5 mL NaAc溶液和3 mL邻二氮杂菲溶液,加入蒸馏水定容摇匀放置10 min。以空白溶液作参比,用1 cm比色皿,在最大吸收波长510 nm处测定编号为22~25容量瓶中溶液的吸光度,并记录数据,吸附温度对吸附的影响如图5所示。
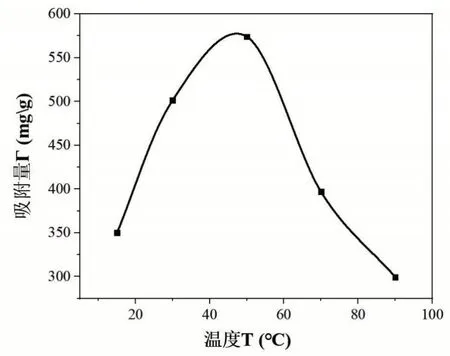
图5 吸附温度对吸附的影响
由图5可知,温度较低时,吸附键的强度大,键能分布较宽,吸附活性点较多[5],因此吸附量较大。在T<50℃时,随着温度的升高,吸附剂对Fe3+的吸附量增加迅速;当温度T>50℃时,随着温度的升高,吸附量会急剧减少,温度过高会加速溶液中Fe3+的水解,不利于吸附剂对Fe3+的吸附。除此之外,温度过高会使得吸附剂过度溶胀,破坏了表面吸附,使得吸附减弱[4]。由此可以看出,吸附温度在48℃~53℃之间,吸附效果较好。
6 教学建议
在实验设计之前,老师首先应给出实验课题,讲解一些设计性实验的要点、实验室具备的仪器和试剂条件等,对学生进行启发引导,鼓励学生先查阅相关文献资料,将理论知识掌握理解透彻再设计方案。学生在实验正式开展之前应提前上交自己设计的实验方案,教师审查实验方案的可行性和安全性,对于存在问题的设计方案,及时给出修改意见,让学生对实验有更深层次的理解,不断优化自己的实验方案。老师最终提交可行性方案和所需试剂及仪器设备清单给相关的实验技术人员,提前准备相关仪器设备以确保实验正常进行。
对于本设计性实验的课时安排,实验前安排1个课时给学生讲解设计性实验的要点、实验室具备的仪器和试剂条件等,要求学生在课余时间完成设计性实验预习报告内容的撰写,并在实验正式进行之前审核学生的实验设计方案。实验课程安排3~4个课时,学生需要独立完成整个设计性实验并记录相关数据。在实验探索过程中学生遇到问题,老师应及时引导学生分析问题,允许实验失败,但应给出尽可能详细的分析说明。
对于本设计性实验的成绩评价,参考其他院校的经验,结合学校实际情况,教师应从以下几个方面对学生的设计性实验做出评价:实验方案是否简洁,基本操作是否准确,实验报告的条理性和表达能力,是否进行相关问题的分析与讨论[6]。按照总评=实验前设计性预习报告撰写*0.3+实验操作*0.4+实验结果的分析及科技报告的撰写*0.3,给予学生物理化学设计性实验课程的成绩评价。
7 结束语
从上述实验结果可以得到,改性茶叶对Fe3+吸附时,最佳溶液pH在0.9~1.0之间;Fe3+初始浓度在1.20~1.30 mol/L 之间吸附量较大,吸附50 min 基本达到饱和,吸附温度范围为48℃~53℃有较大的吸附量。通过本实验,学生可以锻炼查阅文献、收集和整理数据的能力。本实验操作简单,应用性强,实验过程主要以学生为主,实验综合性较强,学生可以通过本实验将之前学习的理论知识与实验过程建立链接,深化学生对专业理论知识的理解与认知,激发学生学习物理化学实验的积极性和主动性,培养学生的创造力和科研探究能力。
