重组大肠杆菌产耐热α-L-鼠李糖苷酶高密度发酵条件的优化
2024-03-05刘英英周芳名展凌玲
葛 林,刘英英,周芳名,展凌玲
(苏州健雄职业技术学院生物医药学院,江苏 太仓 215411)
α-L-鼠李糖苷酶(α-L-rhamnosidase,EC 3.2.1.40)广泛存在于自然界中,如哺乳动物组织、植物、真菌、细菌等[1-4]。该酶是一种应用广泛的糖苷水解酶,它能高效水解多种末端含有非还原性鼠李糖残基的天然化合物,如水解芦丁为异槲皮苷[3],水解淫羊藿苷C 为淫羊藿苷[5],水解柚皮苷为普鲁宁等[4]。此外,少数α-L-鼠李糖苷酶还能以L-鼠李糖为供体,通过逆水解反应催化合成鼠李糖苷,如甘露醇鼠李糖基化、酚类化合物鼠李糖基化等[6,7]。迄今为止,根据CAZy 数据库,α-L-鼠李糖苷酶分属于三大糖苷水解酶家族,即GH13 家族、GH78家族和GH106 家族[8],其中大部分属于GH78 家族。此外,α-L-鼠李糖苷酶是一种重要的酶,在食品和制药工业中有着广泛的应用。然而,目前报道的α-L-鼠李糖苷酶普遍产量不高,到目前为止,全球还没有商品化的α-L-鼠李糖苷酶产品,这极大限制了该酶在工业上的应用。
大肠杆菌是遗传背景最清楚的菌株,其具有培养成本低、抗污染能力强、生长周期短、蛋白表达量高等优势,已经成为最常用的外源蛋白表达系统。采用高密度发酵技术,能显著提高所培养的菌体密度,最终增加单位体积单位时间内目的产物的比生产率,缩减生产周期,提升经济效益,已经在工业中有很广泛的应用[9]。在大肠杆菌高密度发酵中,大多采用补料分批发酵方式,以实现高密度的大肠杆菌和所需的蛋白质生产[10]。这种补料方式一方面可以避免因某些营养成分初始浓度过高而出现底物抑制现象,另一方面又能够防止因限制性营养成分被耗尽而影响细胞的生长和产物的形成。重组大肠杆菌高密度发酵是一个复杂的过程,需要对其生长的发酵参数进行优化,如葡萄糖进料速率、诱导温度、诱导pH等。葡萄糖是一种便宜且速效碳源,在大肠杆菌发酵生产中优于其他碳源。但是,在有氧条件下,过多的葡萄糖会导致大肠杆菌代谢副产物的产生。最常见的副产物是乙酸,它是由磷酸转乙酰酶(PTA)/乙酸激酶(ACKA)和丙酮酸氧化酶(POXB)两种途径产生的[11],主要原因是加入中央代谢系统的碳与细胞呼吸或三羧酸循环的有限能力之间不平衡[12]。乙酸的积累通常发生在大肠杆菌的快速生长期,尤其是在所需蛋白质合成的诱导阶段,会抑制生长和产物的形成[13]。因此,对于补料分批发酵生产重组耐热α-L-鼠李糖苷酶来说,构建一种避免补料不足或过量的补料策略是极其重要的。在确保溶解氧恒定的情况下,诱导温度和诱导pH对高密度发酵过程诱导后代谢乙酸的积累量产生影响[14]。在高温条件下加速细胞的新陈代谢和生长,导致大量乙酸的形成[15]。诱导后的pH值是通过添加氨水形成铵盐来降低乙酸浓度的关键因素。然而,高浓度的NH4+对能源效率和大肠杆菌的生长有负面影响[15]。到目前为止,关于调控乙酸来提高耐热α-L-鼠李糖苷酶产量的影响还未见报道。
在我们前期的研究中,克隆了来源于Thermoclostridium stercorariumDSM 2910 的GH78 家族的α-L-鼠李糖苷酶(TstRhaA),在最优的摇瓶水平最佳表达条件下,该酶最高酶活力仅有25.2 U/mL,产量远不能达到工业化需求。在本研究中,我们研究了在7.5 L 发酵罐中发酵生产耐热α-L-鼠李糖苷酶时,葡萄糖补料策略、诱导温度和诱导pH对副产物乙酸生成量及TstRhaA酶产量的影响,最终发现通过控制乙酸的生成量,能够显著提高TstRhaA 的产酶量,最高酶活力达到589.0 U/mL,研究结果为大规模生产TstRhaA提供了技术保障。
1 材料与方法
1.1 实验菌种
重组基因工程大肠杆菌BL21(DE3)/pET20b-TstRhaA由笔者前期构建并保存,目的基因来自于Thermoclostridium stercorariumDSM 2910。
1.2 主要试剂
二水合磷酸二氢钠、三水合磷酸氢二钾、葡萄糖、硫酸铵、七水合硫酸镁、乙二胺四乙酸,上海阿拉丁生化科技股份有限公司;4-硝基苯基-α-L-鼠李吡喃糖苷(pNPR),Sigma 公司;胰蛋白胨、酵母提取物,OXOID公司;氨苄青霉素钠(Amp)、异丙基β-D 硫代半乳糖苷(IPTG)、消泡剂、氯化钠、柠檬酸、氨水,上海生工生物工程股份有限公司。
1.3 主要仪器
Agilent 7820A 气相色谱仪,安捷伦科技有限公司;JY98-III DN 型超声波破碎仪,南京思麦盛医疗生物科技有限公司;BioFlo 310 型发酵罐,苏州牧笛自动化科技有限公司;D-1 型自动蒸气灭菌锅,北京发恩科贸有限公司;ZHWY-2102C 摇床,上海智城分析仪器制造有限公司;BS124S 电子天平,北京赛多利斯仪器系统有限公司;ZHWY-10X 水浴锅,上海智城分析仪器制造有限公司;多功能酶标仪,巩义市英峪予华仪器厂;AIR TECH US-1300L-U 型超净工作台,苏州安泰空气技术有限公司;艾本德5418R台式高速冷冻离心机,上海璞珉科技有限公司;UV9000紫外可见分光光度计,上海元析仪器有限公司;LC-SPX-250B型生化培养箱,上海力辰仪器科技有限公司。
1.4 主要溶液与培养基
1.4.1 主要溶液
(1)IPTG 溶液(1 mmol /L):精确称取2.383 g IPTG,加入适量无菌水溶解,定容至10 mL,用0.22 μm无菌滤膜过滤除菌,-20℃备用。
(2)Amp 溶液(100 mg/mL):精确称取1 g 氨苄青霉素钠,加入适量无菌水溶解,定容至10 mL,用0.22 μm无菌滤膜过滤除菌,-20℃备用。
(3)pNPR 溶液(5 mmol/L):精确称取14.3 mg pNPR,加入适量无菌水溶解,定容至10 mL,用0.22 μm无菌滤膜过滤除菌,-80℃备用。
1.4.2 主要培养基
(1)LB 固体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,琼脂15 g/L。
(2)种子培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L。
(3)发酵培养基:二水合磷酸二氢钠4.2 g/L,三水合磷酸氢二钾8.7 g/L,酵母提取物50.0 g/L,葡萄糖30 g/L,硫酸铵5.5 g/L,七水合硫酸镁2.5 g/L,乙二胺四乙酸1.1 g/L,微量元素混合液1 mL/L,消泡剂0.3 g/L。
(4)补料培养基:二水合磷酸二氢钠12.6 g/L,三水合磷酸氢二钾26.0 g/L,酵母提取物200 g/L,葡萄糖800 g/L,硫酸铵16.5 g/L,七水合硫酸镁20 g/L,乙二胺四乙酸3.3 g/L,微量元素混合液3 mL/L,消泡剂0.3 g/L。
1.5 试验方法
1.5.1 重组大肠杆菌发酵生产TstRhaA
(1)种子活化
取-80℃甘油保存的菌种,在超净工作台中于氨苄抗性的LB 固体培养皿上进行四区划线法划线,倒置放37℃生化培养箱中培养12~20 h。
(2)种子液培养
从活化平板上挑取单菌落于50 mL 种子培养基(含50 mg/L Amp)中,放入37℃、180 r/min 的摇床中培养12~16 h。然后按照2%的接种量接入到含有150 mL 新鲜发酵液体培养基(含50 mg/L Amp)中,于37℃、1 800 r/min 条件下培养10 h。
(3)发酵罐培养
在7.5 L发酵罐中装入3.0 L的初始发酵培养基(含50 mg/L Amp),接种量为2%,搅拌速度为300~1 200 rpm,控制溶氧(DO)≥15%,空气流速为60 L/h,培养温度为37℃,用100%的氨水和25%的HCl 来调节发酵pH 在7.0±0.1。当发酵培养9 h 时,将IPTG 以固定的速率添加到初始培养基中,开始诱导表达重组蛋白。
通过溶氧(DO)或pH 值的变化来反馈生物反应器中的剩余葡萄糖,然后采用指数流加和两阶段流加策略启动分批补料[10,16]。由底物基本质量平衡可知,不同比生长速率下的补料速率(F,mL/h)为:
式中:μ—比生长速率(h-1);μset—诱导前比生长速率;μ′set—诱导后比生长速率;X0—细胞初始浓度(g/L);V0—初始培养体积(L);YX/S—细胞对葡萄糖的理论产率;SF—补料培养基中葡萄糖浓度;t—培养时间。
基于上述结果,进一步研究不同诱导温度(30℃、33℃、37℃、42℃)和不同诱导pH(6.8、7.0、7.2、7.4)对重组大肠杆菌发酵生产TstRhaA的影响。
1.5.2 TstRhaA酶活力测定方法
以5 mmol/L pNPR 为底物。反应体系:75 μL 50 mmol/L 柠檬酸-磷酸氢二钠缓冲液,20 μL 底物,混匀预热后加入5 μL 酶液,在酶的pH 6.5 和65℃下反应10 min。之后加入0.3 mL 1 mol/L 的Na2CO3溶液终止反应,立即冷却,混匀并离心5 min 后在405 nm条件下测定其吸光值。以不加酶液的反应体系做对照。
TstRhaA 酶活力单位(U)定义为:在pH 6.5 和65℃条件下反应,每分钟水解相应底物pNPR 释放1 μmol对硝基苯酚所需的酶量。
酶活力计算公式(U/mL)= c×V1/(t×V2)×N
式中:c—由对硝基苯酚标准方程计算出的酶反应后的对硝基苯含量(μmol);V1—反应体系总体积(mL);t—酶与底物反应时间(min);V2—反应体系中酶液的体积(mL);N—酶液的稀释倍数。
1.5.3 乙酸浓度测定方法
取2 mL 发酵液,在4℃、10 000 rpm 下离心1 min,取1 mL上清液于5 mL离心管中,再加入0.2 mL 50%硫酸和1 mL乙醚,混匀后获得样品,经0.22 μm的有机滤膜过滤到色谱瓶中,用气相色谱仪检测乙酸的浓度。气相色谱方法:柱温在70℃的初始温度保持3 min,然后以每分钟8℃的增量升至230℃,并保持3 min(30 m×0.25 mm×0.25 μm,安捷伦);载气(N2)的流速为2 mL/min;前端检测器(FID)的温度为300℃;尾气的流速为25.00 mL/min;H2流速为30.00 mL/min;空气流速为400 mL/min[17]。
2 结果与讨论
2.1 指数流加培养对重组大肠杆菌发酵产酶的影响
在指数流加培养中,大肠杆菌的比生长速率由限制性营养的进料速率决定[18]。当μ超过阈值时,过量的葡萄糖通常会迫使大肠杆菌通过PTA-ACKA 和POXB 合成途径产生乙酸,但当μ 低于阈值时,就不会产生乙酸[19]。尽管氧化乙酸可以产生额外的ATP 来支持大肠杆菌的更快生长,但乙酸的过度积累对重组大肠杆菌生产TstRhaA有不利影响。因此,减少乙酸形成和增加大肠杆菌生物量的最佳方法是调整比生长速率,这有利于增加重组蛋白的表达[14]。
从图1a 中可以看出,当比生长速率为0.1 h-1时,乙酸含量开始迅速下降,诱导后最终浓度约为0 g/L,这可能是因为补充的碳源低于一定的阈值。此外,发酵17 h时,大肠杆菌的生物量(0.1 h-1)达到最大值,然后生物量缓慢下降,这表明大肠杆菌开始老化和死亡。结果表明,在0.1 h-1的低比生长速率下,补充的营养物质不能满足其自身生长的需要,并且菌株在发酵后期缺乏生长。当比生长速率为0.2 h-1时(图1b),诱导后乙酸含量开始逐渐降低,乙酸的终浓度为2.56 g/L,TstRhaA的最高活性达到306.5 U/mL,干细胞重量(DCW)为45.2 g/L。尽管乙酸的浓度保持在相对较高的水平,但它减缓了大肠杆菌的生长,并间接促进了大肠杆菌增加TstRhaA 的产量。当比生长速率为0.3 h-1时(图1c),在诱导发酵最后,发酵液中的乙酸含量高于3.2 g/L。这是因为好氧发酵中碳源的补充超过了细胞生长的要求,导致培养物中大肠杆菌产生过量的乙酸,从而抑制了细胞生长和TstRhaA的产生。实验结果表明,乙酸的产生对大肠杆菌的细胞生长和重组α-L-鼠李糖苷酶蛋白的产生有极其不利的影响,不同比生长速率的指数补料可以明显调节乙酸的积累。

图1 不同比生长速率的指数流加培养对重组大肠杆菌高密度发酵产酶的影响Fig.1 Effect of exponential fed-batch with different specific growth rates on the enzyme production of recombinant E.coli by high-density fermentation
2.2 两阶段指数流加培养对重组大肠杆菌发酵产酶的影响
为了实现大肠杆菌的高密度培养和重组耐热TstRhaA 的大量生产,我们采用了基于比生长速率和诱导后葡萄糖残余量的两阶段葡萄糖补料策略来控制菌体生长和乙酸形成[16,20]。在诱导前阶段,按照指数补料速率,使菌体以0.2 h-1的比生长速率生长。当发酵培养8 h 时,加入IPTG 进行诱导,并基于梯度递减方法改变补料速率。当μ′set为0.14 h-1时(图2a),发酵后期的DCW 和乙酸含量迅速下降,这可能是有限的碳源无法支持大肠杆菌正常生长的主要原因。当μ′set为0.16 h-1时(图2b),在诱导结束后,尽管大肠杆菌产生的乙酸浓度低于0.9 g/L,DCW 达到52.4 g/L,但最高酶活性仅为286.2 U/mL。当μ′set为0.18 h-1时(图2c),乙酸浓度保持在1.6 g/L 左右,DCW 仅有44.3 g/L,比μ′set为0.16 h-1时降低了8.1 g/L,但最高酶活为364.8 U/mL,其是μ′set为0.16 h-1时的1.27倍,是摇瓶培养的14.5倍。结果表明:在诱导后期,乙酸的积累随着μ′set的梯度增加而增加;在微生物发酵过程中,不同诱导前和诱导后比生长速率的指数流加培养可以很好地控制乙酸的积累。

图2 两阶段不同比生长速率指数流加培养对重组大肠杆菌高密度发酵产酶的影响Fig.2 Effect of exponential fed-batch with two-stage specific growth rate on the enzyme production of recombinant E.coli by high-density fermentation
2.3 诱导温度对重组大肠杆菌发酵产酶的影响
一般来说,诱导温度是通过控制重组大肠杆菌的生长速率和代谢速度来调节乙酸的关键参数。研究表明,低温通常可以防止重组蛋白的错误折叠,并增加大肠杆菌中的正确表达[21]。因此,在上述最优条件的基础上,研究了不同诱导温度对TstRhaA 产量的影响。研究结果如图3所示:当诱导温度过低时,TstRhaA的酶活力和DCW 均较低,这是因为低温下重组大肠杆菌的生长受到影响,从而影响了TstRhaA 的产量。当诱导温度为33℃时,TstRhaA 的酶活力是最高的,达到468.5 U/mL,是在30℃诱导下的1.6 倍;乙酸含量是最低的,只有1.3 g/L,是在30℃诱导下的72%;DCW 是最高的,达到49.5 g/L,是在30℃诱导下的1.31 倍。当诱导温度为37℃和42℃时,TstRhaA 的酶活力和DCW 均逐渐降低,而乙酸含量显著升高,这是因为高温加速了细胞的代谢转移,并在恒定的溶氧水平下快速积累乙酸,从而抑制了大肠杆菌的生长和TstRhaA的产生。这些结果表明:在高密度发酵过程中,低温虽然可以防止重组蛋白的错误折叠,但是温度太低会影响菌体生长速率,从而影响TstRhaA 的酶产量;TstRhaA 的酶活力和DCW 与乙酸含量呈负相关;适当的诱导温度可以控制乙酸的积累,并提高耐热酶的产量。
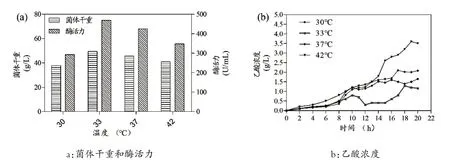
图3 诱导温度对重组大肠杆菌高密度发酵的影响Fig.3 Effect of induction temperature on high-density fermentation of recombinant E.coli.
2.4 诱导pH对重组大肠杆菌发酵产酶的影响
很多研究较少关注酸度或碱度对高密度培养过程中大肠杆菌产生的乙酸积累的影响[22-23]。pH 的影响是复杂的,它与其他条件有关,如DO、生长阶段和大肠杆菌自身代谢变化等[24]。发酵液的酸碱度通常被误认为是保证适宜细菌生长的酸碱度条件,而忽略了pH 对乙酸形成的调节作用。在诱导前的pH(pH 7.0)不改变的情况下,本文研究了在诱导后阶段通过梯度递减法调节诱导pH 获得乙酸的最适pH,如图4所示,当诱导pH 为7.2时,DCW达到69.6 g/L,TstRhaA的酶活力为589.0 U/mL,达到了最高水平,与摇瓶培养相比提高了23.4 倍。此时,乙酸的浓度被进一步控制到非常低的水平,一直保持在0.8 g/L 以下,与其他诱导pH 相比处于最低水平,其可能原因是培养基中的乙酸变为铵盐,并且代谢成分抑制乙酸的形成[25]。但是当诱导pH为7.4时,乙酸含量显著提升,可能的原因是高pH 诱导大肠杆菌的代谢酶参与精氨酸和谷氨酸的分解代谢途径,将碳转化为酸,而不是产生碱性胺[23]。研究结果表明,在诱导后阶段通过调整诱导pH能够实现对乙酸的调控;适当的pH不仅可以加速细菌的生长,而且可以调节和控制乙酸的形成。
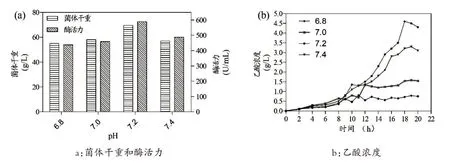
图4 诱导pH对重组大肠杆菌高密度发酵的影响Fig.4 Effect of induction temperature on high-density fermentation of recombinant E.coli.
3 结论
本文研究了指数流加培养、两阶段指数流加培养、诱导温度、诱导pH对重组大肠杆菌发酵产酶的影响,研究结果表明,在发酵过程中通过调节乙酸的积累能够显著提升酶的产量。最终确定了最佳发酵工艺:诱导前比生长速率0.2 h-1,诱导后比生长速率0.18 h-1,诱导温度33℃,pH 7.2。在最佳发酵工艺条件下,乙酸浓度始终保持在0.8 g/L 以下,DCW 最大为69.6 g/L,最高酶活力为589.0 U/mL,是摇瓶发酵的23.4 倍,最终实现了重组大肠杆菌高密度发酵生产TstRhaA。
